胸、腹腔镜联合微创食管癌根治术的麻醉管理
2015-03-11徐德军马少华吴长毅
徐德军 马少华 王 军 吴长毅
(北京大学第三医院麻醉科,北京 100191)
·临床论著·
胸、腹腔镜联合微创食管癌根治术的麻醉管理
徐德军 马少华①王 军 吴长毅*
(北京大学第三医院麻醉科,北京 100191)
目的 总结胸、腹腔镜联合微创食管癌根治术的麻醉管理经验。 方法 2013年5~11月12例双腔支气管内插管静吸复合全麻下行胸、腹腔镜联合微创食管癌根治术。麻醉诱导采用丙泊酚、芬太尼和顺苯磺酸阿曲库铵静脉注射,插入左侧双腔支气管导管,纤维支气管镜检查定位。术中吸入七氟烷和静脉持续输注瑞芬太尼维持麻醉。胸腔镜操作中行左侧单肺通气(one-lung ventilation,OLV)。记录麻醉诱导前、麻醉诱导后、OLV前、OLV后30 min以及手术结束时等不同时点SBP、DBP、MAP、HR、PaO2、PaCO2和Ppeak值。 结果 12例均完成胸、腹腔镜联合微创食管癌根治术。手术时间(425.7±90.1)min,麻醉时间(497.3±84.6)min。术中共输液(3020±606)ml,其中晶体液(2020±527)ml,胶体液(1000±316)ml,2例各输入红细胞悬液400 ml;术中出血量(204±80)ml,尿量(700±231)ml。与麻醉诱导前相比,SBP在麻醉诱导后、OLV前和手术结束时有统计学差异(q=7.607,P<0.05;q=4.890,P<0.05;q=3.713,P<0.05),MAP在麻醉诱导后有统计学差异(q=5.560,P<0.05);不同时点DBP、HR均无显著性差异(F=2.31,P=0.070;F=0.45,P=0.770)。与麻醉诱导后相比,OLV 30 min时PaCO2和Ppeak值明显升高(q=5.657,P<0.05;q=8.132,P<0.05),PaO2显著降低(q=14.375,P<0.05)。术中8例使用1种以上的血管活性药物。4例在OLV刚开始时出现SpO2下降,经右肺持续吹入低流量氧气2 L/min,左肺加用5 cm H2O PEEP处理后SpO2升至97%以上。术后9例返回普通病房,3例转入ICU。术后均无复张性肺水肿、肺不张及其他麻醉并发症发生。 结论 胸、腹腔镜联合微创食管癌根治术对麻醉管理的要求较高,只有采取合理的麻醉管理措施,才能保证麻醉效果和手术安全。
胸腔镜; 腹腔镜; 麻醉; 食管癌根治术
微创腔镜技术的飞速发展使胸、腹腔镜联合进行微创食管癌根治术成为可能。与传统开胸手术相比,胸、腹腔镜联合微创食管癌根治术具有创伤小、出血少、胸腔生理完整性破坏少、术后疼痛轻、恢复快等特点,在临床上应用越来越多[1,2]。但此手术持续时间较长,对患者循环和呼吸功能干扰大,对麻醉管理的要求很高。我院2013年5~11月共实施胸、腹腔镜联合微创食管癌根治术12例,均在静吸复合全身麻醉下完成手术,麻醉中我们采用双腔支气管内插管和纤维支气管镜定位技术,有效保证单肺通气效果和微创手术的顺利进行,现将围术期麻醉管理总结如下,旨在提高此类手术麻醉管理的质量和安全性。
1 临床资料与方法
1.1 一般资料
本组12例,男10例,女2例。年龄42~79岁,(64.5±10.1)岁。体重指数 21.4±2.0。术前均行上消化道造影、胸部CT及纤维胃镜检查,并经组织活检确诊,病理类型均为鳞状细胞癌,其中胸上段食管癌5例,中段7例,肿瘤长度1.0~5.6 cm,平均2.8 cm。术前心功能NYHA分级Ⅰ~Ⅱ级,ASA分级Ⅱ~Ⅲ级。合并1种以上全身性疾病8例(66.7%):原发性高血压6例,冠心病4例,糖尿病1例,支气管哮喘2例,颈动脉粥样硬化斑块形成2例。术前心电图检查异常7例:轻度ST-T段改变4例,窦性心动过缓2例,偶发房性早搏、左前分支阻滞、完全性右束支传导阻滞1例。术前肺功能检查异常5例,以阻塞性通气功能障碍为主,术前血气分析均基本正常。
1.2 麻醉方法
采用双腔支气管内插管静吸复合全身麻醉。入室后开放外周静脉通路,连接多功能监护仪监测心电图、血压和脉搏氧饱和度(pulse oxygen saturation,SpO2)。局麻下行桡动脉穿刺测量直接动脉压,右侧颈内静脉或右侧锁骨下静脉穿刺置入中心静脉导管。麻醉诱导采用丙泊酚1~2 mg·kg-1、芬太尼6~8 μg·kg-1、顺苯磺酸阿曲库铵0.15 mg·kg-1静脉注射,然后插入左侧双腔支气管导管,纤维支气管镜检查确认导管位置准确无误。男性患者采用F39导管,女性患者采用F37号导管,双腔支气管导管前段距门齿深度27~32 cm。术中麻醉维持采用静吸复合麻醉,静脉持续输注瑞芬太尼 0.1~0.2 μg·kg-1·min-1,吸入1.5%~3%七氟烷并间断静注顺苯磺酸阿曲库铵0.03 mg·kg-1维持肌松。
在胸腔镜操作期间,行左侧单肺通气(one-lung ventilation,OLV),使右肺塌陷便于食管游离。OLV期间的呼吸参数为吸入氧浓度100%,潮气量6~8 ml·kg-1,呼吸频率12~16次·min-1,吸呼比1∶2或1∶1.5。当出现低氧血症时,可经双腔管右侧导管持续吹入低流量氧气2 L/min,或左肺加用5 cm H2O(1 cm H2O=0.098 kPa)呼气末正压通气(positive end-expiratory pressure,PEEP),必要时嘱术者暂停手术操作改为双肺通气,待血氧改善后再继续手术。胸腔镜操作结束后即可行双肺通气,将萎陷的肺叶完全膨胀。腹腔镜手术期间CO2气腹压力为13 mm Hg(1 mm Hg=0.133 kPa),调整呼吸参数,使呼气末二氧化碳分压(end tidal carbon dioxide pressure,PETCO2)维持在35~45 mm Hg。
术中根据患者循环状态和尿量等指标进行输液,晶体液采用乳酸钠林格注射液(中国大冢制药有限公司),胶体液采用6%万汶注射液(北京费森尤斯卡比医药有限公司),当血红蛋白浓度低于70 g/L时输入红细胞悬液。术毕待患者神志清醒、呼吸与肌力完全恢复正常后,拔除气管导管。若患者病情较重,则将双腔支气管导管更换为单腔气管导管后送ICU进一步监护治疗。
麻醉成功后患者左侧卧位,取右胸入路。胸腔镜下游离胸段食管,超声刀清扫纵隔和双侧喉返神经链淋巴结。改体位为平卧位置,腹腔镜下游离胃及食管下端,清扫腹腔淋巴结。取左侧胸锁乳突肌前缘切口,游离并离断颈部食管。剑突下5 cm行正中切口,将胃与食管提出腹腔,在贲门处离断胃与食管并制作管型胃。最后将管型胃送达颈部与颈部食管吻合,缝合所有切口。
1.4 观察指标
由于OLV对于患者的心肺功能干扰较大,故术中重点关注循环和呼吸指标变化。记录麻醉诱导前、麻醉诱导后、OLV前、OLV后30 min以及手术结束时等不同时点的收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)、动脉血氧分压(arterial partial pressure of oxygen,PaO2)、动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)和气道峰压(peak airway pressure,Ppeak)值。同时记录手术时间、麻醉时间、输液量、出血量、尿量等指标。
1.5 统计方法

2 结果
12例均在全身麻醉下完成胸、腹腔镜微创食管癌根治术,无中转开胸、开腹。手术时间为(425.7±90.1)min,麻醉时间(497.3±84.6)min。术中共输液(3020±606)ml,其中晶体液(2020±527)ml,胶体液(1000±316)ml,2例各输入红细胞悬液400 ml;术中出血量(204±80)ml,尿量(700±231)ml。
术中不同时点SBP、DBP、MAP、HR、PaO2、PaCO2和Ppeak值变化见表1。与麻醉诱导前相比, SBP在麻醉诱导后、OLV前和手术结束时有统计学差异,MAP在麻醉诱导后有统计学差异(P<0.05);不同时点DBP、HR均无显著性差异(P>0.05)。与麻醉诱导后相比,OLV 30 min时PaCO2和Ppeak值明显升高(P<0.05),PaO2显著降低(P<0.05)。
术中8例使用1种以上的血管活性药物。所有患者双腔管定位理想,左右肺隔离满意,胸腔镜操作期间右肺完全萎陷,手术视野暴露清晰。4例在OLV刚开始时出现SpO2下降(最低至90%),经右肺持续吹入低流量氧气2 L/min,左肺加用5 cm H2O PEEP等处理后SpO2升至97%以上。腹腔镜操作期间SpO2维持在98%~100%,PETCO2维持在35~45 mm Hg。
术后9例在手术室或麻醉恢复室清醒拔管,返回普通病房;3例送入ICU,均在手术次日拔除气管导管。术后随访所有患者均在拔除气管导管后第2天开始下床活动,均能正常咳嗽排痰,无复张性肺水肿、肺不张及其他麻醉并发症发生。
坡脚道路工程受边坡影响长度为边坡的走向长度150 m,道路工程包括路基和路面,参照福建高速公路的造价,路基工程每延米造价2.2万元,路面工程每延米造价0.9万元,故公路工程直接损失为465万元。

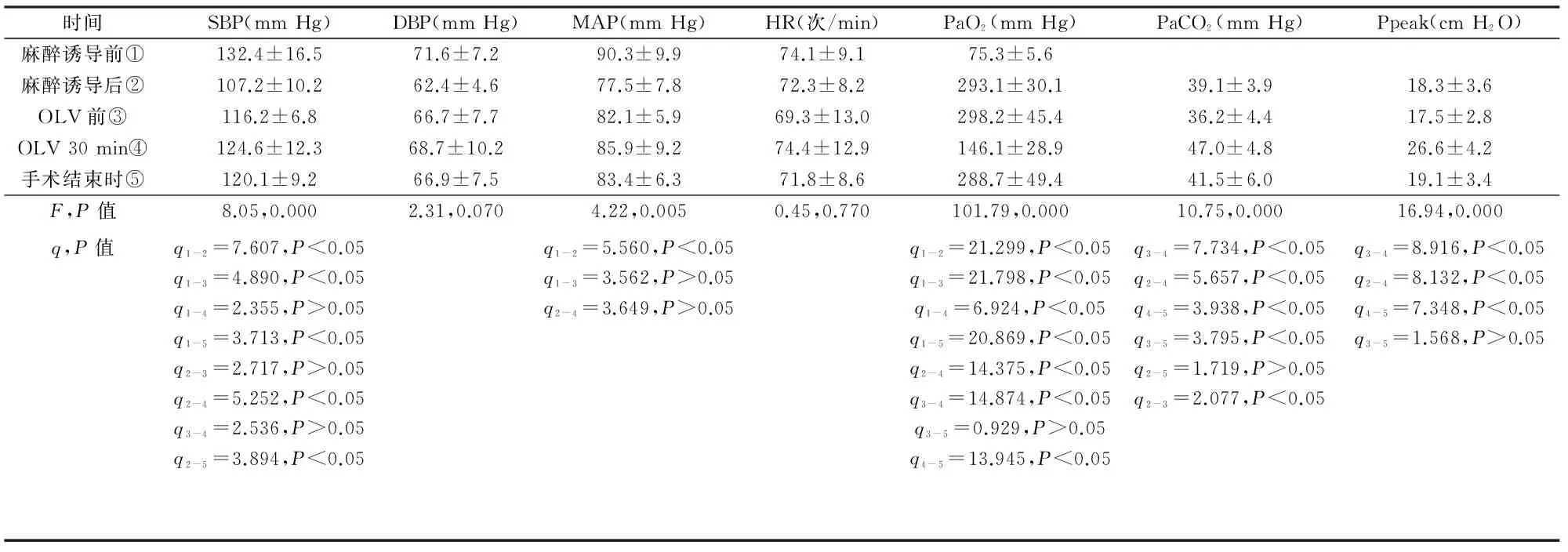
时间SBP(mmHg)DBP(mmHg)MAP(mmHg)HR(次/min)PaO2(mmHg)PaCO2(mmHg)Ppeak(cmH2O)麻醉诱导前①132.4±16.571.6±7.290.3±9.974.1±9.175.3±5.6麻醉诱导后②107.2±10.262.4±4.677.5±7.872.3±8.2293.1±30.139.1±3.918.3±3.6OLV前③116.2±6.866.7±7.782.1±5.969.3±13.0298.2±45.436.2±4.417.5±2.8OLV30min④124.6±12.368.7±10.285.9±9.274.4±12.9146.1±28.947.0±4.826.6±4.2手术结束时⑤120.1±9.266.9±7.583.4±6.371.8±8.6288.7±49.441.5±6.019.1±3.4F,P值8.05,0.0002.31,0.0704.22,0.0050.45,0.770101.79,0.00010.75,0.00016.94,0.000q,P值q1-2=7.607,P<0.05q1-3=4.890,P<0.05q1-4=2.355,P>0.05q1-5=3.713,P<0.05q2-3=2.717,P>0.05q2-4=5.252,P<0.05q3-4=2.536,P>0.05q2-5=3.894,P<0.05q1-2=5.560,P<0.05q1-3=3.562,P>0.05q2-4=3.649,P>0.05q1-2=21.299,P<0.05q1-3=21.798,P<0.05q1-4=6.924,P<0.05q1-5=20.869,P<0.05q2-4=14.375,P<0.05q3-4=14.874,P<0.05q3-5=0.929,P>0.05q4-5=13.945,P<0.05q3-4=7.734,P<0.05q2-4=5.657,P<0.05q4-5=3.938,P<0.05q3-5=3.795,P<0.05q2-5=1.719,P>0.05q2-3=2.077,P<0.05q3-4=8.916,P<0.05q2-4=8.132,P<0.05q4-5=7.348,P<0.05q3-5=1.568,P>0.05
3 讨论
传统的三切口开放食管癌根治术对患者的生理功能干扰较大,术后容易出现呼吸系统感染、呼吸功能衰竭、心律失常等并发症,术后恢复时间较长。2000年Luketich等[1]首次报道胸、腹腔镜联合食管癌根治术,此后多项研究[2~4]表明,胸、腹腔镜联合食管癌根治术在术中出血、术后康复质量及住院时间等各方面均优于常规开胸手术,而在吻合口漏、乳糜胸等手术并发症发生率及术后无复发生存率方面与后者相近。因此,胸、腹腔镜联合食管癌根治术既可以保证手术的根治性切除,又能充分体现微创腔镜技术的优势,必将成为食管癌治疗的主流手术方式。然而,胸、腹腔镜联合微创食管癌根治术手术时间较长,术中需行单肺通气,对循环和呼吸有显著影响,麻醉管理有其特殊性,现将我们的经验体会总结如下。
3.1 术前准备
术前应进行全面检查,包括检查有无原发性高血压、冠心病、心律失常及心功能分级情况;是否存在肺部疾病,如肺部感染、慢性支气管炎、肺气肿等;有无糖尿病、肝肾功能不全;是否存在电解质紊乱、贫血、低蛋白血症等。上述问题应在术前尽量予以纠正。术前准备的重点是关注患者的心肺功能,评估患者对于OLV的耐受情况,对于呼吸储备功能降低的患者应及早给予戒烟、控制肺部感染、雾化吸入、加强排痰训练等处理。
3.2 麻醉管理
3.2.1 麻醉及术后镇痛药物的选择 本手术为双腔支气管插管下胸、腹腔镜手术,术中需要维持足够的麻醉深度,同时手术时间较长、麻醉药用量较大,故麻醉药物的选择非常重要,应选择起效快、对心血管功能抑制轻、蓄积作用少的药物。本组麻醉诱导药物选择的是丙泊酚、芬太尼和顺式阿曲库铵。丙泊酚是目前临床上普遍使用的新型短效静脉全麻药物,具有起效快、苏醒快且完善、术后恶心呕吐发生率低等优点,适应于麻醉诱导及维持。芬太尼为强效阿片类镇痛药,具有起效快、时效短、对循环影响小等优点。顺式阿曲库铵是新型的中时效肌松药,突出特点是主要通过Hofmann降解途径消除,代谢几乎不受患者的年龄和肝肾功能影响,特别适用于老年及肝肾功能不全的患者。本组麻醉维持选择的药物是七氟烷和瑞芬太尼。七氟烷是一种较为理想的新型吸入麻醉药,具有诱导和清除迅速、对呼吸道刺激小、血流动力学平稳等优点,研究[5]显示七氟烷可通过抑制肺泡内炎性介质(肿瘤坏死因子α、白介素1β、白介素6、白介素8等)释放等机制对单肺通气所致的肺损伤产生一定的保护作用。瑞芬太尼是一种超短效的阿片类镇痛药,具有起效快、作用时间短、持续输注无蓄积等特点。Schilling等[6]研究表明,相对于丙泊酚和瑞芬太尼联合应用,七氟烷和瑞芬太尼联合应用于此类手术的麻醉维持中,肺内炎性反应更轻、术后肺部并发症更少,更有利于患者术后的早期康复。在术后镇痛方面,本组采用的是舒芬太尼病人自控镇痛。舒芬太尼是高选择性和高亲和力的阿片μ受体激动剂,镇痛作用强、起效快、持续时间长,且持续输注后在体内蓄积少、呼吸抑制作用轻、安全范围宽,所以适应于术后镇痛。我们采用的背景输注剂量是2 μg·h-1,单次给药量是2 μg,锁定时间是15 min,与林春水等[7]报道的剂量相似,此剂量可以安全有效地用于胸科手术的术后镇痛。
3.2.2 循环管理 表1显示与麻醉诱导前相比,麻醉诱导后的SBP和MAP均出现明显降低(P<0.05)。麻醉诱导后的血压下降与多种因素有关,包括患者年龄、心功能状态、术前禁食水和麻醉药物的副作用等,表明此类患者在麻醉诱导阶段容易出现血流动力学波动,故应加强循环功能监测,小剂量分次试探性给药,适当延长给药时间间隔,注重个体化用药。一旦发生低血压,我们的处理方法是在合理补液的基础上及时给予血管活性药物(麻黄碱10 mg/次或去氧肾上腺素40 μg/次)以保证心脑等重要脏器的灌注压。在胸腔镜操作期间也容易发生血压降低,主要原因是由于外科操作对于纵隔结构的刺激和压迫,故此时除给予升压药物外,还应密切关注手术操作,必要时需要提醒外科医师暂停手术以解除刺激和压迫。术中的液体管理十分重要,本组术中出血量(204±80)ml,与Nagpal等[8]和吴奇勇等[9]的报道一致,可见,此类手术术中出血量较少,通常不需要输血。本组2例各输入红细胞悬液400 ml,是因为此2例术前存在贫血,术中检查血红蛋白浓度<70 g/L,故输入红细胞悬液。术中过多的液体输入会增加肺复张性水肿、吻合口水肿等并发症的发生率,不利于患者的术后康复。因此,我们的处理经验是在保证循环稳定的前提下采用限制性的输液策略,尤其限制晶体液的用量,相应增加胶体液的用量,与Suzuki等[10]的观点一致。
3.2.3 呼吸管理 OLV期间的呼吸管理是此类手术麻醉管理的关键。OLV的优点是使手术侧肺野完全塌陷,为胸腔镜下游离胸段食管和清扫淋巴结提供良好的操作空间,但增加呼吸管理的难度。表1显示与麻醉诱导后相比,OLV 30 min时PaCO2和Ppeak值明显升高(P<0.05),PaO2显著降低(P<0.05),PaCO2值虽明显升高(P<0.05),但仍处于临床可接受的范围内。罗宏等[11]的研究表明,老年患者对于轻度的高碳酸血症(PaCO2<55 mm Hg)有较好的耐受,同时轻度的高碳酸血症还可舒张脑血管、增加脑血流、改善脑氧代谢并降低患者术后认知功能障碍的发生率,具有一定的脑保护作用。因此,在OLV期间将PaCO2调整到完全正常的水平并无绝对必要,但对于合并严重高血压或有颅内压升高倾向的患者则应格外谨慎。表2显示OLV 30 min时Ppeak较麻醉诱导后明显升高(P<0.05)。Michelet等[12]报道OLV期间Ppeak与术后急性肺损伤的程度密切相关,因此,应尽量维持较低的Ppeak值,通常应低于35 cm H2O。Ppeak值出现异常升高时,我们的处理包括:①采用纤维支气管镜重新确认双腔管位置。双腔管位置正确是确保良好通气和氧合的前提条件,传统的定位方法主要靠听诊,但错位率较高。纤维支气管镜定位是目前最准确的定位方法,尤其是当患者发生体位改变或Ppeak值出现急剧变化时,应用纤维支气管镜重新定位。②合理设置潮气量和呼吸频率。我们采用6~8 ml·kg-1的小潮气量通气模式,相应增加呼吸频率(12~16次·min-1),有利于降低Ppeak值。Fernndez-Pérez等[13]研究表明相对于OLV中的小潮气量通气模式,大潮气量通气(二者的中位数分别为6.7、8.3 ml·kg-1)会使通气侧肺泡过度扩张,增加肺气压伤和术后呼吸功能衰竭的发生率,还可促使血液更多地流入非通气侧,增加肺内分流。③维持足够的麻醉深度,及时清理呼吸道分泌物,确保气道通畅。与麻醉诱导后相比,OLV 30 min时PaO2显著降低,OLV期间PaO2降低的主要原因是由于手术侧肺萎陷,同侧肺血没有经过氧合便回流到左心,造成通气/血流比值失调,肺内分流增加。OLV期间有9%~27%患者可发生显著低氧血症[14]。低氧血症会直接降低患者的氧供,威胁其安全,故应及时进行处理。我们采用2种有效方法提高氧合,包括:①在非通气侧肺持续吹入氧气2 L/min。何秀莉等[15]报道与非通气侧肺未施加任何干预措施的对照组相比,OLV期间通过一细导管向非通气侧肺持续低压吹入氧气2 L/min可显著提高患者的PaO2。其机制是增加非通气侧肺的功能残气量,同时促使血液向通气侧转移,从而降低肺内分流、改善氧合。②在通气侧肺加用PEEP通气。Grichnik等[16]报道OLV中在通气侧肺加用4~10 cm H2O PEEP不仅可提高肺顺应性、增加PaO2,更为重要的是,PEEP作为肺保护性通气策略的一部分,还可减轻机械通气所致的急性肺损伤,降低患者术后肺部并发症的发生率。在采取以上措施后,如果PaO2或SpO2还继续降低,应与术者沟通及时改为双肺通气,待血氧改善后再继续手术。本组4例在OLV刚开始时出现SpO2下降(最低至90%),经上述处理后SpO2升至97%以上,顺利完成手术,说明经过良好的呼吸管理,大部分患者均可较好地耐受胸腔镜期间的OLV。
此外,由于本手术时间较长、患者年龄大,术中易出现低体温、代谢性酸中毒、电解质失衡等改变。因此,还应加强保温等措施,积极行血气分析和血糖监测,及时发现和处理可能存在的内环境紊乱。本文的不足之处是临床病例数较少,观察指标和数据有一定的局限性,后续尚需更多的临床实践以提高和完善麻醉管理技术。
总之,胸、腹腔镜联合微创食管癌根治术对麻醉管理的要求较高,麻醉医师只有做好充分的术前准备、选择合适的麻醉及镇痛药物、加强术中循环和呼吸功能的监测与管理,才能保证患者的围术期安全,充分发挥此类手术创伤小、术后恢复快、并发症少的特点。
1 Luketich JD, Schauer PR, Christie NA, et al. Minimally invasive esophagectomy. Ann Thorac Surg,2000,70(3):906-911.
2 Levy RM,Pennathur A,Luketich JD. Randomized trial comparing minimally invasive esophagectomy and open esophagectomy: early perioperative outcomes appear improved with a minimally invasive approach. Semin Thorac Cardiovsac Surg,2012,24(3):153-154.
3 Lazzarino AI, Nagpal K, Bottle A, et al. Open versus minimally invasive esophagectomy:trends of utilization and associated outcomes in England. Ann Surg,2010,252(2):292-298.
4 Sgourakis G, Gockel I, Radtke A, et al.Minimally invasive versus open esophagectomy: meta-analysis of outcomes.Dig Dis Sci,2010,55(11):3031-3040.
5 De Conno E,Steurer MP, Wittlinger M, et al. Anesthetic-induced improvement of the inflammatory response to one-lung ventilation. Anesthesiology,2009,110(6):1316-1326.
6 Schilling T,Kozian A,Senturk M,et al. Effects of volatile and intravenous anesthesia on the alveolar and systemic inflammatory reponse in thoracic surgical patients. Anesthesiology,2011,115(1):65-74.
7 林春水,卢 刚,阮骆阳,等. 舒芬太尼和芬太尼用于开胸术后病人自控静脉镇痛的比较研究. 南方医科大学学报,2006,26(2):240-241,244.
8 Nagpal K, Ahmed K, Vats A, et al. Is minimally invasive surgery beneficial in the management of esophageal cancer? A meta-analysis. Surg Endosc,2010,24(7):1621-1629.
9 吴奇勇,童继春,王 勇,等.胸、腹腔镜联合手术治疗食管癌的临床对比.中国微创外科杂志,2012,12(12):1107-1109.
10 Suzuki T, Morisaki H. Perioperative management for esophagectomy. Masui,2014,63(5): 498-505.
11 罗 宏,陶 凡,汪国香,等.允许性高碳酸血症机械通气对老年患者脑氧代谢及术后认知功能的影响.中华麻醉学杂志,2012,32(9):1054-1057.
12 Michelet P, D’Journo XB, Roch A, et al. Protective ventilation influences systemic inflammation after esophagectomy: a randomized controlled study. Anesthesiology, 2006,105(5): 911-919.
14 Schwarzkopf K, Klein U, Schreiber T, et al. Oxygenation during one-lung ventilation: the effects of inhaled nitric oxide and increasing levels of inspired fraction of oxygen. Anesth Analg, 2001, 92(4): 842-847.
15 何秀莉,袁清霞,陈 锴.全麻单肺通气期间非通气侧肺持续低压吹氧预防低氧血症的观察.第四军医大学学报,2007,28(22):2109.
16 Grichnik KP, Shaw A. Update on one-lung ventilation: the use of continuous positive airway pressure ventilation and positive end-expiratory pressure ventilation-clinical application. Curr Opin Anaesthesiol,2009,22(1):23-30.
(修回日期:2015-03-11)
(责任编辑:李贺琼)
Anesthetic Management of Combined Thoracoscopic and Laparoscopic Esophagectomy
XuDejun*,MaShaohua,WangJun*,etal.
*DepartmentofAnesthesiology,PekingUniversityThirdHospital,Beijing100191,China
WuChangyi,E-mail:iamwuchangyi@yahoo.com.cn
Objective To summarize the anesthetic management of combined thoracoscopic and laparoscopic minimally invasive esophagectomy. Methods Twelve patients underwent combined thoracoscopic and laparoscopic esophagectomy under intravenous and inhalational anesthesia. After induction of anesthesia with propofol,fentanyl, and cisatracurium, a double-lumen endobronchial tube was intubated and its position was checked by using fiberoptic bronchoscopy. Anesthesia was maintained with sevoflurane and remifentanil. One-lung ventilation (OLV) was performed during the thoracoscopic operation. Values of systolic blood pressure (SBP), diastolic blood pressure (DBP), mean arterial pressure (MAP), heart rate (HR), arterial partial pressure of oxygen (PaO2), arterial partial pressure of carbon dioxide (PaCO2), and peak airway pressure (Ppeak) were recorded at following time points: before anesthesia induction, after anesthesia induction, before OLV, 30 min after OLV, and end of surgery.Results The operation was successfully completed in all the patients. The total operation time was (425.7±90.1) min and the anesthesia time was (497.3±84.6) min. The volume of fluid given intraoperatively was (3020±606) ml, including crystal solution (2020±527) ml and colloid solution (1000±316) ml. Two patients received 400 ml red blood cells. The volume of blood loss and urinary output intraoperatively were (204±80) ml and (700±231) ml, respectively. The SBP values after anesthesia induction, before OLV, and at the end of surgery were significantly lower than that before anesthesia induction (q=7.607,P<0.05;q=4.890,P<0.05;q=3.713,P<0.05); the MAP after anesthesia induction was significantly lower than that before anesthesia induction (q=5.560,P<0.05). No significant difference was found between values of DBP and HR(F=2.31,P=0.070;F=0.45,P=0.770). The PaCO2and Ppeak values at 30 min after OLV were significantly higher than those after anesthesia induction (q=5.657,P<0.05;q=8.132,P<0.05), and the PaO2values at 30 min after OLV were significantly lower than those after anesthesia induction (q=14.375,P<0.05). A total of 8 cases were given more than one kind of vasoactive drugs. The SpO2dropped in 4 cases at the beginning of OLV, and recovered after blowing 2 L/min oxygen into the right lung and adding 5 cm H2O PEEP to the left lung. Nine cases returned to the general ward after operation and 3 cases were transferred to ICU. No postoperative anesthesia-related complications occurred, such as reexpansion pulmonary edema and atelectasis. Conclusions The surgery of combined thoracoscopic and laparoscopic esophagectomy presents anesthetists with more challenges. Reasonable management skills are essential to ensure anesthetic quality and patient safety.
Thoracoscopy; Laparoscopy; Anesthesia; Esophagectomy
R614.2
A
1009-6604(2015)04-0293-05
10.3969/j.issn.1009-6604.2015.04.002
2014-09-23)
*通讯作者,E-mail:iamwuchangyi@yahoo.com.cn
① 胸外科
