分子生物学检测在α-地中海贫血中的应用
2015-03-10郭柳薇
郭柳薇
分子生物学检测在α-地中海贫血中的应用
郭柳薇★
[摘要]α-地中海贫血是一组由于α-珠蛋白基因缺失或功能障碍导致α-珠蛋白链完全缺如或合成不足所引起的遗传性溶血性疾病,是我国长江以南各省发病率最高、影响最大的遗传病之一。目前对α-地中海贫血尚无理想的治疗方法。通过加强人群、婚前、产前筛查及基因诊断,防止重型地贫儿出生,是最有效的预防措施。因此快速实用、准确有效的基因诊断技术是人群、婚前、产前筛查及诊断的有力保障。本文对α-地中海贫血的分子机制、生物学检测及应用等方面进行综述。
[关键词]α-地中海贫血;分子机制;基因诊断;应用
作者单位:广西医科大学第七附属医院梧州市工人医院检验科,广西,梧州543001
Molecular biological detection of alpha-thalassemia
GUO Liuwei★
(Clinical Laboratory, The Seventh Affiliated Hospital of Guangxi Medical University, Gongren Hospital of Wuzhou, Wuzhou, Guangxi, China, 543001)
[ABSTRACT] Alpha-thalassemia is a group of genetic and hemolytic disease which is caused by alpha globin chain synthesis insufficient or absent due to a group of alpha globin gene deletion or dysfunction. As one of the largest genetic diseases, alpha-thalassemia is prevalent in south of the Yangtze River provinces in China. Currently, there are still lack of ideal treatment to the alpha-thalassemia. Strengthening on screening and diagnosing to the gene before marriage and childbirth is the best measure to prevent severe thalassemia births. Therefore, fast, accurate and effective gene diagnosis technology is a powerful guarantee for population, premarital and prenatal screening as well as diagnosis. In this paper, molecular mechanism, biological detection and application for alpha-thalassemia are summarized.
[KEY WORDS] Alpha thalassemia; Molecular mechanism; Gene diagnosis; Application
α-地中海贫血(简称α-地贫)是由于α-珠蛋白基因的缺失或突变导致α-珠蛋白肽链的合成减少或缺乏所致的遗传性溶血性疾病[1]。α-地贫主要是因为α-珠蛋白基因的大片段缺失引起(缺失型--SEA、-α3.7、-α4.2),少数类型为小片段碱基插入、缺失或点突变所致(非缺失型αWS、αCS、αQS)。α-地贫最大的危害是严重影响生命质量的血红蛋白H (hemoglobin H,HbH)病和致死的血红蛋白(hemoglobin,Hb)Bart’s胎儿水肿综合征。据WHO估计,全球有接近5亿的人携带血红蛋白病突变基因,占全球总人数7%[2],其中约有2.6亿人是α-地中海贫血基因携带者,主要集中分布在非洲、地中海、东南亚等地区;我国长江以南的广大地域为地中海贫血高发区,其中尤以广西、广东和海南三省(区)为甚。广西自治区2010年的地贫流行病学调查显示α-地贫的人群携带率高达17.55%[2],广东省2004年的地贫流行病学抽样调查显示α-地贫的人群携带率为8.53%[2],对人类健康和人口质量构成严重威胁。目前对α-地中海贫血尚无理想的治疗方法。通过加强人群、婚前、产前筛查及基因诊断,防止重型地贫儿出生,是最有效的预防措施。因此快速实用、准确有效的基因诊断技术是人群筛查、婚前、产前诊断的有力保障。本文对α-地中海贫血的分子机制、生物学检测及应用等方面综述如下。
1 α-地中海贫血分子遗传机制
地中海贫血1925年由Cooley和Lee首先描述,最早发现于地中海地区的人群,故称为地中海贫血,又被称为海洋性贫血或珠蛋白生成障碍性贫血,其致病基因为人类珠蛋白基因。20世纪70年代末,α-珠蛋白基因被定位,随后发现人类珠蛋白基因以基因簇的形式存在,α-珠蛋白基因簇定位于16号染色体16p13.3位点。
如图1所示,α-珠蛋白基因簇上含有1个胚胎期表达基因(ζ),2个胎儿期和成人期表达基因(α2和α1),2个假基因(Ψζ和Ψα1)和2个疑似珠蛋白基因(Ψα2和θ)。基因在基因簇上的排列顺序为5'-ζ-Ψζ-Ψα2-Ψα1-α2-α1-θ-3'。在ζ-基因上游40kb处,存在1个影响α-珠蛋白表达的重要调控位点HS-40。正常人每条16号染色体上有2个高度同源的α-珠蛋白基因,即α1和α2,每对染色体上共有4个α-基因,基因型为αα/αα[3]。α1 和α2基因表达同一种产物,即α-珠蛋白链,它们在人的一生从发育到6周后即持续高水平表达,参与合成胚胎(α2ε2)、胎儿(α2γ2)、和成人(α2δ2和α2β2)4种血红蛋白。
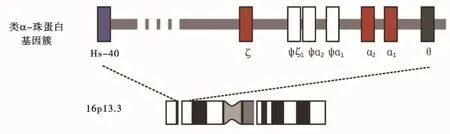
图1 人体α-珠蛋白基因簇的染色体定位和基因结构Figure 1 Chromosomal localization and gene structure of human alpha globin gene cluster
α-珠蛋白基因的突变可分为缺失型和非缺失型两种类型。对于缺失型而言,如果缺失了1 个α-基因,则该基因功能丧失,α-珠蛋白链的产量减少,如(-α3.7/)(-α4.2/)等,其杂合子由于还保留3个α-基因,表现为静止型α-地中海贫血,称为α+-地中海贫血。(-α3.7/)(-α4.2/)缺失是中国人最常见的α+-地中海贫血,广西地区人群的携带者频率分别约为4.78%和1.61%[2]。如果同一条染色体缺失了2个α-基因,则该条染色体完全不能合成α-珠蛋白链,称为α0-地中海贫血,如(--SEA/)、(--THAI/)等,其杂合子表现为典型的轻型α-地中海贫血。如果同一对色体缺失了3个α-基因(基因型为--/-α),仅剩1个正常的α-基因,称为血红蛋白H病,临床表型轻重不一,贫血程度有很大的差异,轻者只有轻度的地中海贫血表征,没有明显的临床症状,重者则需要定期输血,出现肝脾肿大等明显的地中海贫血特征。如果同对染色体缺失了4个α-基因(基因型为--/--),称为重型α-地中海贫血(血红蛋白Bart’s胎儿水肿综合征),临床表现是胎儿宫内死亡或早产后数小时死亡。目前全球已鉴定的α-地中海贫血缺失超过20种,中国人最常见的是(--SEA/),在广西地区该突变的携带者频率高达7.84%[2]。对于非缺失地中海贫血而言,可因点突变、核苷酸缺失或插入而引起,以αT表示累及的基因,目前发现至少有68种α-珠蛋白基因点突变可导致α-地中海贫血的发生,在广西最常见是αWSα/、αCSα/、αQSα/点突变,在人群中该基因发生率为1.55%、1.21%、0.36%[2]。由于非缺失型比缺失型导致更严重的α-珠蛋白链合成的减少,因此,非缺失型的临床表现和血液学改变均比缺失型重,非缺失型血红蛋白H患者(基因型为--/ααT)血红蛋白可低于60 g/L,需定期输血维持生命[4]。
2 α-地中海贫血分子生物学诊断及应用
α-地中海贫血的分子生物学诊断可采用PCR技术、等位基因特异的寡核苷酸探针斑点杂交(allele specific oligonucleotide probe hybridization,ASO)和近年来日趋成熟的有重大影响的基因芯片技术等方法进行基因突变类型的分析。
2.1Southern blotting技术
Southern技术是研究DNA图谱的基本技术,在分析PCR产物和遗传疾病诊断分析等方面有重要价值。本方法用一种或多种限制性内切酶消化基因组DNA,用琼脂糖凝胶电泳分离酶解片断,将这些分离好的酶片段大小次序不变地转移至硝酸纤维膜或尼龙膜上的相应位置,然后与放射性同位素标记的DNA或RNA探针杂交,经放射性自显影确定与探针杂交的酶解片断的大小及位置。它被认为是分析α-珠蛋白基因缺陷的金标准。但该技术操作繁琐费时,且需要质高、量多的基因组DNA,并使用放射性同位素,因而限制了其在常规诊断中的应用,但常作为其他DNA诊断方法和基于PCR产前诊断结果的确证试验。
2.2缺口PCR(gap-PCR)是目前检测缺失型α-地中海贫血的最常用的方法
gap-PCR技术是设计与缺失序列两侧序列互补的引物,缺失使本来在正常DNA序列中相距很远的这对引物之间的距离因断端连接而靠近,并能扩增出特定长度的片段,再通过琼脂糖凝胶电泳,根据电泳片段大小检测样品的基因型。Chong等[5]报道运用单管多重PCR技术检测6种α-地贫缺失型。刘敬忠等[6]在优化单管多重PCR技术的基础上成功的检出中国人常见的(--SEA/)、(-α3.7/)、(-α4.2/)3种缺失型地中海贫血,具有简便、快速、准确实用而又经济等特点,非常适合于我国以预防为目的而开展的大人群α-地贫的分子筛查和临床样品的基因诊断。郭柳薇、徐卫华[7-10]等亦应用该技术用于大样本人群中的α-地中海贫血基因分型及频率的研究。
2.3反向点杂交(reverse dot,RDB)技术
RDB技术是目前检测非缺失α-地中海贫血点突变的一种首选技术。它与传统等位基因特异寡核苷酸探针点杂交的不同是将膜上固定探针取代了固定靶DNA方式,从而改变了传统杂交法一次只能检测一种突变的方式。用固化了多种特异性探针的膜条与扩增靶序列杂交,使一次杂交即可同时筛查出被检DNA中多种突变。李莉艳等[11]建立的反向点杂交检测体系证明了RDB技术可用于快速诊断中国人非缺失型α-地中海贫血点突变。该方法也成为目前国内许多省市人群筛查、产前诊断非缺失型α-地中海贫血快速有效的方法[12-14]。而肖奇志等[15]在采用反向点杂交检测非缺失型α-地贫过程中,发现该技术既可准确检出常见非缺失α-地贫突变类型,还可以验证单管多重PCR检测严重类型α-地贫基因的可靠性,这种相互验证检测结果的方法,对于无条件开展MLPA和其他DNA诊断方法的实验室,不失为一种有效的质量控制的替代方法,可保证产前诊断的准确性,值得在临床遗传诊断实验室中推广应用。曾赤佳等[16]报道运用PCR-RBD结合导流技术在同一芯片上同时检测缺失型和非缺失型α-地贫用于育龄妇女地贫诊断,缩短了检测时间,降低检测成本,减少了复合地贫漏诊,非常适合基层实验室用于常规地贫基因的筛查及诊断。
2.4基因芯片法
自1997年Affymetrix公司开始将DNA芯片技术用于诊断地中海贫血,芯片技术成为了20世纪90年代中期以来影响深远的重大科技进展。其基本原理是用2种不同荧光染料标记的靶序列同时与同1个cDNA芯片杂交,通过不同颜色的荧光信号强度分析即可反映出基因表达的变化。由于用该技术可以将极其大量的探针同时固定于支持物上,所以一次可以对大量的生物分子进行检测分析,从而解决了传统PCR、核酸印迹杂交等检测项目单一,低通量、费用昂贵等不足。具有快速、高效、敏感、平行化和自动化等特点,能快速、准确地从分子水平诊断疾病。钟华敏等[15]建立的基因芯片快速诊断技术,由Cy5荧光标记的引物扩增得到的PCR产物无需琼脂糖凝胶电泳,将产物与包含不同类型基因探针的芯片杂交后,应用计算机根据芯片上不同位置出现荧光信号有无及强弱来判断结果,可同时检测中国地区最常见的-α3.7、-α4.2和--SEA三种缺失型及2种非缺失型(HbCS、HbQS)α-地贫。其检测结果与Southern blotting分析或直接测序结果一致,能快速、准确地用于人群中α-地贫基因的筛查及胎儿α-地贫基因产前诊断。
2.5实时荧光定量PCR结合融解曲线(dissociation curve,DC)分析技术
实时荧光定量PCR结合DC分析技术为一种不需要凝胶电泳技术及特异性探针的应用于快速检测缺失型地中海贫血的技术。闫梅等[16]运用SYBR-Green和ABI 7000热循环仪分别进行3个实时荧光定量聚合酶链反应,同时进行DC和Tm值分析,根据特定Tm值对应的DC峰值判定基因型,灵敏、准确的检测我国3种缺失型及非缺失型的α-珠蛋白等位基因。该技术全部操作均由仪器自动完成,具有自动化程度高、不需荧光标记探针、不需电泳、成本低、易质控、防污染、高通量等优点,适用于进行α-地中海贫血缺失型的产前诊断,具有很好的应用前景。袁晓文等[17]采用双重Taq-Man实时荧光嵌套PCR技术,于同一检测体系同时检测各标本α-地贫SEA缺失截短序列及缺失范围内正常序列,根据荧光PCR阳性扩增结果结合其Ct值差异诊断受检个体的α-地贫SEA缺失基因型。同时采用检测α-地贫SEA缺失的常规gap-PCR法,以PCR扩增结合产物凝胶电泳分析各标本α-地贫SEA缺失基因型,以验证及对比分析新方法的准确性与实用性。结果显示该方法不但能实现其快速分子诊断,而且能准确判断受检标本中的外源性污染,从而有效避免假阴性或假阳性误诊。表明双重TaqMan实时荧光嵌套PCR可以快速准确检测α-地贫SEA缺失,操作简单实用,适合大规模人群筛查和常规分子诊断。
2.6多重连接探针扩增技术(multiplex ligationdependent probe amplification,MLPA)
2002年由荷兰学者Schouten等[20]首先报道、MLPA技术是近几年发展起来的一种针对待测核酸中靶序列进行定性和定量分析的新技术。其原理是经过探针的杂交、连接、PCR扩增及毛细管电泳,根据各靶序列的扩增产物量进行相对定量分析,从而可以检出目的序列内几乎所有的基因缺陷。叶国永等[21]应用MLPA技术联合基因测序技术平台,提高了地中海贫血基因缺陷检测的准确率,为地贫家系成员的遗传咨询和产前基因诊断提供准确的依据。而陈亚军等[22]应用常规gap-PCR联合MLPA技术可防止α-地贫基因的漏诊及产前诊断中的假阳性和假阴性。由于MLPA操作相对繁琐、仪器设备条件要求较高,不适合大规模常规应用,但以其高灵敏性及目的序列相对定量的优势,可作为当前α-地贫基因缺失检测方法上的有效补充。
2.7 DNA测序分析技术
对一个目的基因或某一片段进行分析的最精确方法之一就是获得其核苷酸序列。DNA测序分析可以鉴定未知突变,是分析点突变的金标准。目前此方法已达到自动化。随着国内经济实力的提升,以前这种主要用于科研机构研究用的技术已经在很多医疗单位逐渐开展起来。
3 小结
随着分子生物学检验技术的迅猛发展,α-地中海贫血基因诊断技术亦随之提高,大量的新技术、新方法被应用于α-地中海贫血的诊断中,在α-地中海贫血人群筛查、遗传咨询、产前诊断等方面起到了非常重要的作用。但是如何减少误诊和漏诊,是目前α-地中海贫血分子检测所面临的难题。因此,在方法学上突破原有的分子诊断模式,建立高通量、操作简单、费用低廉、结果准确、安全省时的基因诊断技术仍然是人们翘首以待的事情。在地贫基因诊断技术方面还须要精益求精,不断发展和完善更简便、精确易于推广的诊断技术。
参考文献
[1]Yu XY, Chen P, Chen WQ, et al. The genotyping research on 200 children with hemoglobin h disease in guangxi province[J]. Journal of Guangxi Medical University, 2011,28(3):365-368.
[2]Xu XM. Mediterranean anemia prevention and control guidelines [M]. Beijing: People's Medical Publishing House, 2011:25-28.
[3]Sun SP, Wu ZK, Liu GJ. Research progress of molecular mechanism of the mediterranean anemia and it’s related microRNA regulation of expression[J]. Joumal of Medical Research, 2014,43(1):135-137.
[4]Zhang ZN, Shen T. Standard of diagnosis and curative effect of blood disease[M]. Beijing: Science Press, 2007:29-35.
[5]Chong SS, Boehm CD, Higgs DR, et al. Single-tube multiplex-PCR screen for common deletional determinants of alpha-thalassemia[J]. Blood, 2000,95(1):360-362.
[6]Liu JZ, Ou CY, Wang LR, et al. Detection of three common, deletional alpha-thalassemia determinants in southern china by a single-tube multiplex polymerase chain reaction method[J]. Hemoglobin,2004,28(1):39-44.
[7]Guo LW, Huang Y, Li YL. The incidence and genetic diagnosis of β-thalassemia compound α-thalassemia in the border area of guangdong and guangxi [J]. Chongqing Medicine, 2010,39(14):1827-1828.
[8]Xu WH, Cen XQ, Li XJ, et al. Genotying and frequency of thalassemia in hainan province [J]. China Tropical Medicine, 2013,13(7):804-806.
[9]Ruan LM, Zhou YJ, Zhu ML, et al. Application of single tube multiplex PCR deletionα-thalassemia diagnosis [J]. Chine J Birth Health & Heredity, 2013,13(7):804-806.
[10]Li GF, Hu M, Xu Y, et al. Gene diagnosis of α- thalassemia in guizhou[J]. Maternal and Child Health Care of China, 2011,26(11):1667-1669.
[11]Li LY, Mo QH, Xu XM. Rapid diagnosis of non-deletion α-thalassemias by reverse dot blot [J]. Chinese Journal of Medical Genetics, 2003,20(4):345-347.
[12]Pan GH, Shen YZ, Huang Y, et al. Molecular epidemiological investigation of nondeletion alpha thalassemia in nanhai area of guangdong[J]. Int J Lab Med, 2014, 35(1):56-57.
[13]Tu ZH, Huang CD, Wen YM, et al. Gene analysis of mediterranean anemia in haikou area[J]. Chine J Birth Health & Heredity, 2013,21(10):28-29.
[14]Ma XW, Xu Y, Dai W, et al. Analysis of the results of screening and genetic diagnosis of thalassemia for 1143 pregnant women from Guiyang region[J]. Chongqing Medicine, 2013,42(17):1990-1991.
[15]Xiao QZ, Zhou YQ, Zhang YL, et al.Application of single-tube multipex PCR combined with reverse dot blot technology for the prenatal diagnosis of α-thalassemia[J]. Int J Lab Med, 2012,33(3):271-273.
[16]Zeng CJ, Liu JL, Zhuang XW, et al. Application of PCR combined with flow-through hybridization technique for alpha and beta thalassemia diagnosis in women of childbearing age[J]. J Mol Diagn Ther, 2014,6 (2):93-96.
[17]Zhong HM, OU XB, Luo MY. Study on microarray technique for rapid genetic diagnosis of α-thalassemia [J]. Chinese Journal of Birth Health & Heredity, 2011,9 (3):23-24.
[18]Yan M, Liang Y, Wang LR, et al. Application of realtime polymeras chian reaction with SYBR-Green I combined with dissociation curve analysis in molecular diagnosis of α-thalassemia[J]. J Appl Clin Pediatr, 2008,23(15):1181-1182.
[19]Yuan XW, Liu YK, Huang Q, et al. The establishment and application of double TaqMam real-time fluorescence nested PCR method for rapid detection of α-thalassemia SEA deletion [J]. Chinese Journal of Laboratory Medicine, 2011,34(8):681-685.
[20]Schouten JP, McElgunn CJ, Waaijer R, et al. Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification[J]. Nucleic Acids Res, 2002,30:e57.
[21]Ye GY, Zang L, Huang GZ, et al. Analysis of the drawback of the combination of MLPA and gene sequencing technology in detecting thalassemia genes [J]. China Modern Medicine, 2012,19(24):90-91.
[22]Chen YJ, Yang XH, Zeng XQ, et al. The application of multiplex ligation-dependent probe amplification technology in diagnosis and Prenatal diagnosis of αthalassemia [J]. Chin J Hematol, 2013,34(7):591-594.
·讲座·
通讯作者:★郭柳薇,E-mail:guolw510@163.com
