除草剂硝磺草酮在环境中残留的液相色谱分析
2015-03-10陈国峰任红波金海涛马文琼张晓波
陈国峰,任红波,金海涛,刘 峰,马文琼,张晓波,赵 琳
(农业部谷物及制品质量监督检验测试中心,哈尔滨 150086)
除草剂硝磺草酮在环境中残留的液相色谱分析
陈国峰,任红波,金海涛,刘 峰,马文琼,张晓波,赵 琳
(农业部谷物及制品质量监督检验测试中心,哈尔滨 150086)
分别采用不同的前处理方法处理土壤、植株和玉米样品.土壤样品以水为提取剂,振荡提取,液液分配净化;玉米植株样品和玉米样品以乙腈为提取剂,振荡提取,氨基柱净化.样品中硝磺草酮的残留量采用高效液相色谱-紫外检测器测定.硝磺草酮在0.05~0.4 mg/L范围内线性良好,相关系数为0.999 9.土壤、玉米植株以及玉米样品的平均加标回收率分别为88.8%~100.0%、94.0%~109.0%、103.2%~109.0%,相对标准偏差在2.2%~10.6%之间.
硝磺草酮;高效液相色谱;环境
硝磺草酮又称甲基磺草酮,为三酮类低毒除草剂.英文通用名为:mesotrione,化学名为:2-(4-甲磺酰基-2-硝基苯甲酰基)环己烷 -1,3-二酮.纯品外观为浅黄色固体[1].
硝磺草酮是一种能够抑制羟基苯基丙酮酸酯双氧化酶(HPPD)的芽前和苗后广谱选择性除草剂,硝磺草酮容易在植物木质部和韧皮部传导,具有触杀作用和特效性,可有效防治主要的阔叶草和一些禾本科杂草[2].
对硝磺草酮的原药的分析方法的研究屡见报导,但对环境中的硝磺草酮的一个系统性的分析方法的研究在国内却未见报导[3-6],本研究采用振荡提取,液液萃取,HPLC紫外检测器直接测定,建立了硝磺草酮在玉米植株、土壤和玉米中的残留分析方法.
1 实验部分
1.1 仪器与试剂
高效液相色谱仪:岛津LC-20A,附紫外检测器、自动进样器和化学工作站;色谱柱:Waters C18(250 mm×4.6 mm,5 μm)不锈钢柱;电子天平:Sartorius;过滤器: 滤膜孔径约0.22 μm;超声波清洗器;IKA HS501型振荡器;IKA旋转蒸发器;常用玻璃器皿.
硝磺草酮标准品(98.0%)由国家农药检定所提供;乙腈(色谱纯) ;磷酸(分析纯);NaCl(分析纯);二氯甲烷(分析纯);去离子水(过0.22 μm滤膜).
1.2 高效液相色谱操作条件
流动相:甲醇/水(0.5%磷酸)=60/40(V/V)
流速: 1.0 mL/min;
柱温: 30 ℃ ;
检测波长: 270 nm;
进样量: 40 μL;
硝磺草酮的保留时间4.838 min,色谱图见图1.
上述色谱操作条件系典型操作参数,可根据仪器特点,对给定操作参数作适当调整,以获得最佳效果.

图1 硝磺草酮标样色谱图
1.3 方法
2019年,智慧建筑专委会将着重加强组织建设工作,深入了解会员单位、紧密团结核心会员单位、搭建会员单位有效沟通平台;继续围绕标准工作稳步推进,充分发挥标准对行业的发展支撑作用;积极推动课题项目落地成熟,以问题为导向, 推动国密算法、节能技术在智能建筑领域的应用。
1.3.1土壤样品前处理
土壤样品除去碎石、杂草和植株根茎等杂物、风干后过40目筛[7].
称取上述土壤样品10 g置于250 mL具塞三角瓶中,加入40 mL水(用磷酸调pH值至3),浸泡2 h后,振荡1 h,抽滤,滤液全部移至100 mL具塞容量筒中,加入40 mL二氯甲烷,用力振摇5 min后静止30 min,移取下层二氯甲烷至鸡心瓶中旋转蒸发至干.用5 mL流动相定容,过0.22 μm有机滤头,待上机.
1.3.2植株样品和玉米样品前处理
将采集的植株样品切碎,充分混匀,用四分法缩分样品,分取100 g样品两份,待测.将采集的玉米样品脱粒后,充分混匀,用四分法缩分样品,分取100 g样品两份,待测[8].
称取上述植株样品或玉米样品10 g置于250 mL具塞三角瓶中,加入20 mL水和40 mL乙腈,浸泡30 min后,超声提取30 min,上清液过滤,滤液转移至加有5 gNaCl的具塞量筒中,用力振摇5 min后静止分层30 min,分取上层乙腈20 mL至鸡心瓶中旋转蒸发至干.残渣待固相萃取净化.
用5 mL体积比10∶90的甲醇/二氯甲烷预饱和氨基柱小柱;用10 mL体积比10∶90的甲醇/二氯甲烷分三次溶解残渣后上样,开始收集,收集后在40 ℃下真空浓缩至干,残渣用2.5 mL流动相溶解,过0.22 μm滤膜,液相色谱检测.[9]
1.3.3加标回收率测定
2 结果与讨论
2.1 标准曲线的绘制
准确称取10 mg硝磺草酮标准品,用甲醇配制成质量浓度为100 mg/L的储备液,再用甲醇逐级稀释成0.01、0.05、0.10、0.50、1.00 mg/L的标准溶液.在上述色谱条件下测定,以硝磺草酮峰面积(A)-质量浓度(C)作标准曲线见图2.线性方程:A= 111 489C- 373.85(r= 0.999 9).在试验的质量浓度范围内,仪器对硝磺草酮有较好的线性相关.
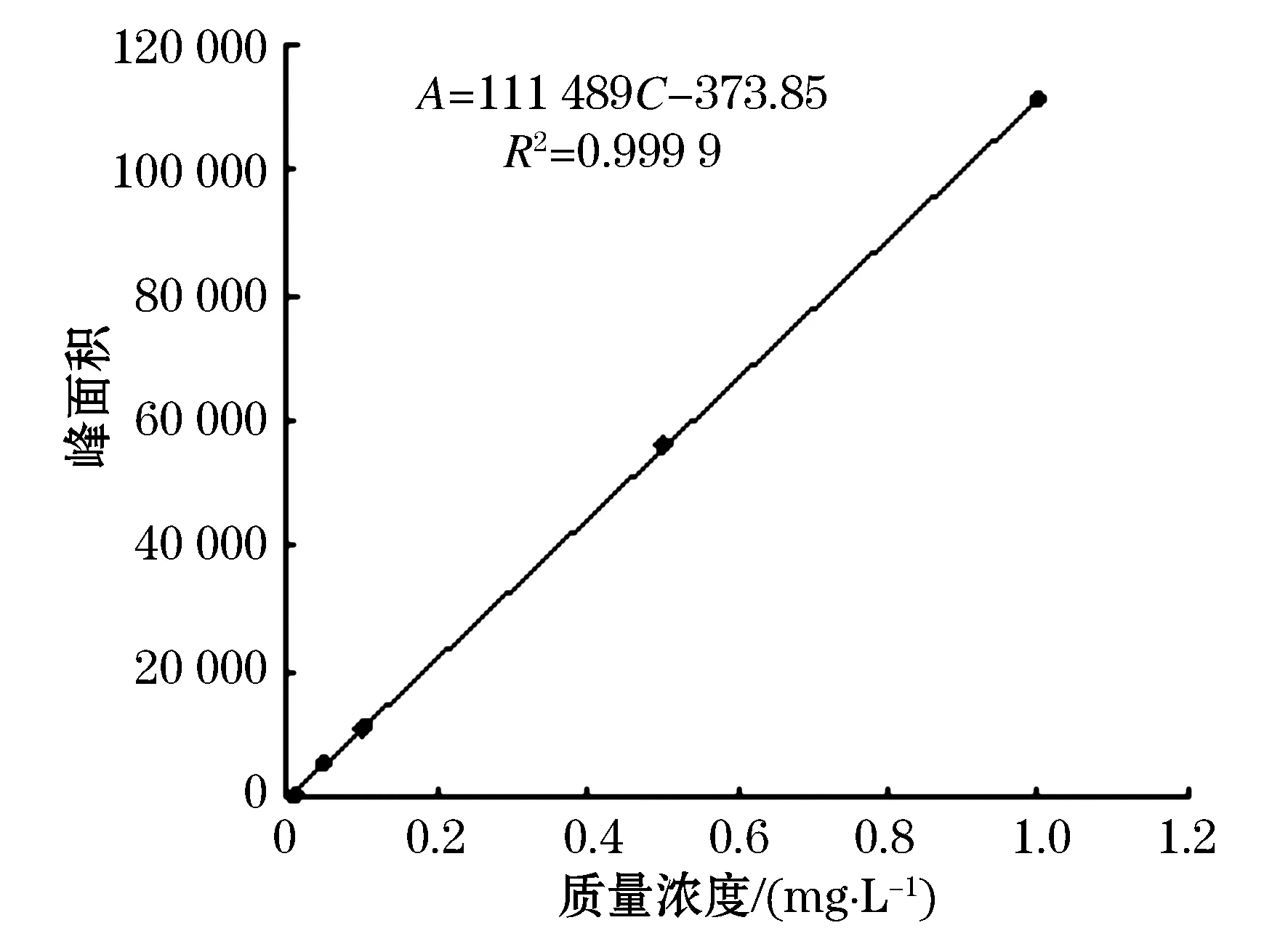
图2 硝磺草酮标准曲线图
该测定条件下仪器硝磺草酮的标准样色谱图见图2,最低检出质量比为0.005 mg/kg,最低检出量为5×10-10g.
2.2 色谱条件的优化
由于硝磺草酮呈弱酸性,选用C18柱,当用甲醇与水配比作为流动相时,不能完成待测物的完全分离.用磷酸调节流动相中水相的pH值进行实验,待测组分能与杂质完全分离.本实验选择流动相中水相添加0.5%的磷酸.
2.3 样品的提取与净化
2.3.1土壤样品的提取与净化
在添加质量比为1.0 mg/kg的土壤样品中分别加40 mL 不同提取溶剂,比较了不同提取溶剂对土壤中硝磺草酮残留添加回收率及效果的影响.结果表明,用水提取,二氯甲烷萃取所得添加回收率较高,平均添加回收率达 98.0%,变异系数3.8%,且无杂质干扰,见表1和图3.
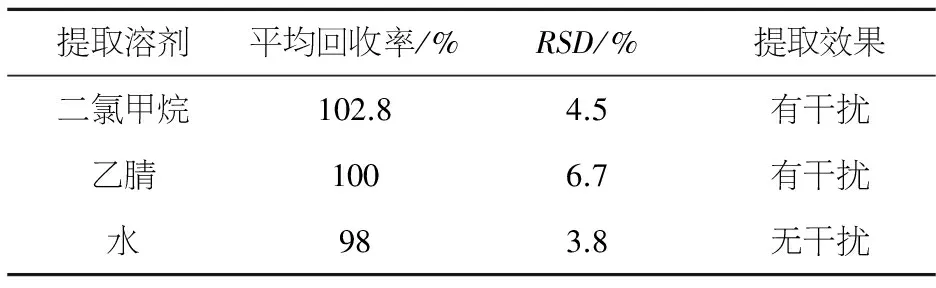
表1 不同提取溶剂对土壤中硝磺草酮添加回收率
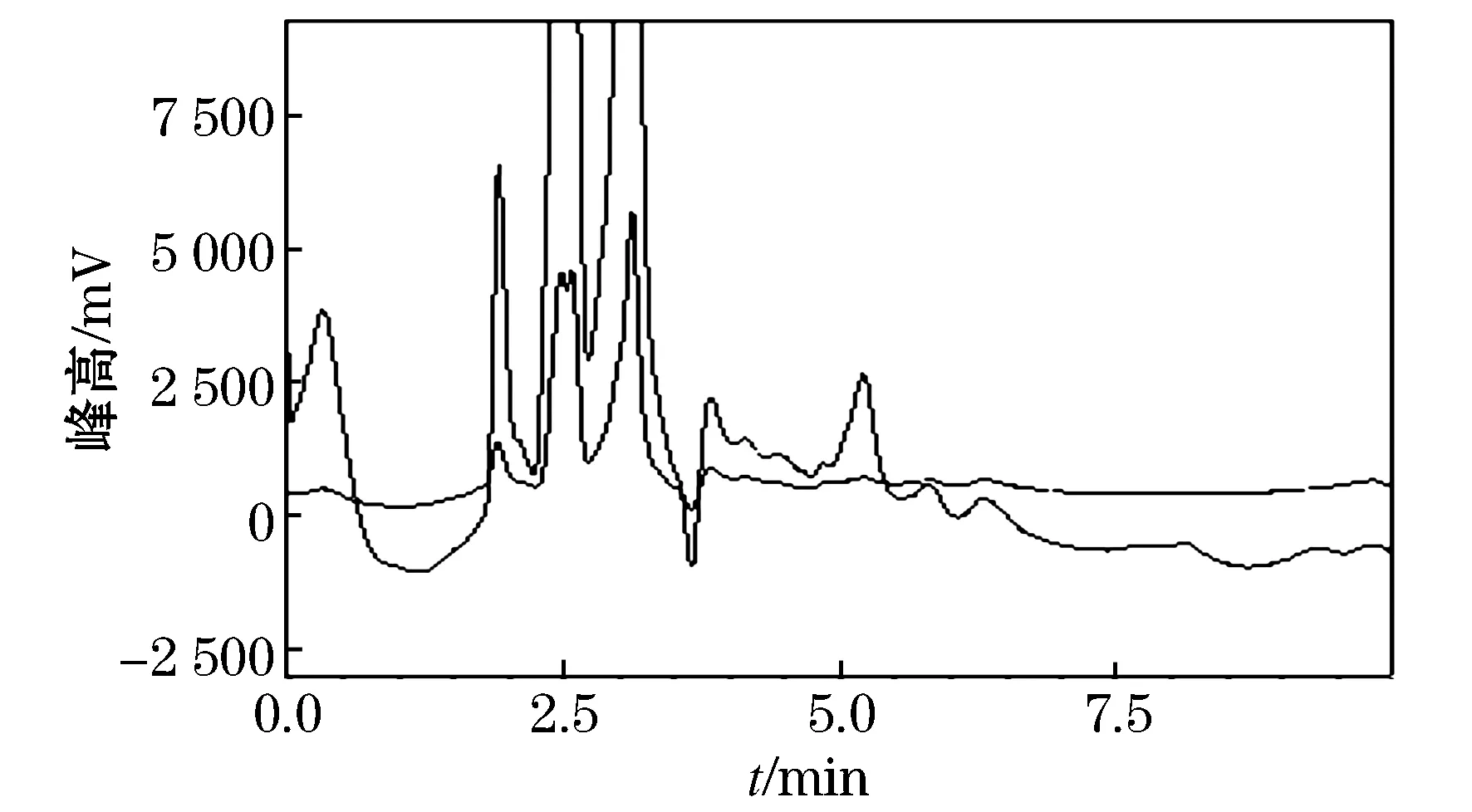
图3 土壤空白样品及添加硝磺草酮色谱图
2.3.2玉米植株的提取与净化
在添加质量比为1.0 mg/kg的玉米植株和玉米样品中添加20 mL水和40 mL乙腈,浸泡30 min后,振荡提取1 h,上清液过滤,滤液转移至加有5 gNaCl的具塞量筒中,用力振摇5 min后静止分层30 min,分取上层乙腈20 mL至鸡心瓶中旋转蒸发至干.残渣待固相萃取净化.净化分别用1/99(V/V)、10/90(V/V)、20/80(V/V)的甲醇/二氯甲烷预淋、上样,操作过程同1.3.2.结果表明通过体积比1∶99的甲醇/二氯甲烷净化的回收率较低;而通过体积比20∶80的甲醇/二氯甲烷净化的,有杂质干扰;通过体积比10∶90的甲醇/二氯甲烷的净化结果表明,不仅回收率较高,平均回收率达94.0%,变异系数为8.8%,而且能够有效的消除玉米植株中的杂质干扰,见图4、5.
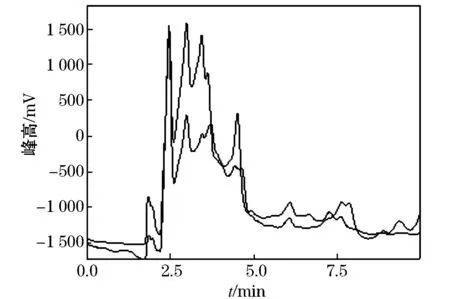
图4 玉米植株空白样品及添加硝磺草酮色谱图
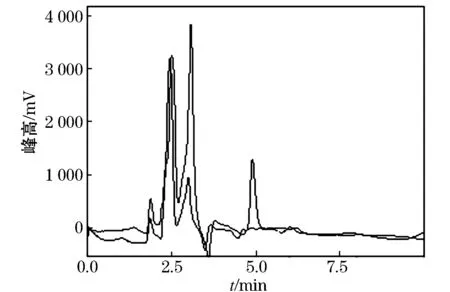
图5 玉米空白样品及添加硝磺草酮色谱图
2.4 方法精密度
在土壤、玉米植株和玉米等空白对照样本中添加硝磺草酮标准溶液,测得不同质量浓度下的添加回收率和相对标准偏差见表2.
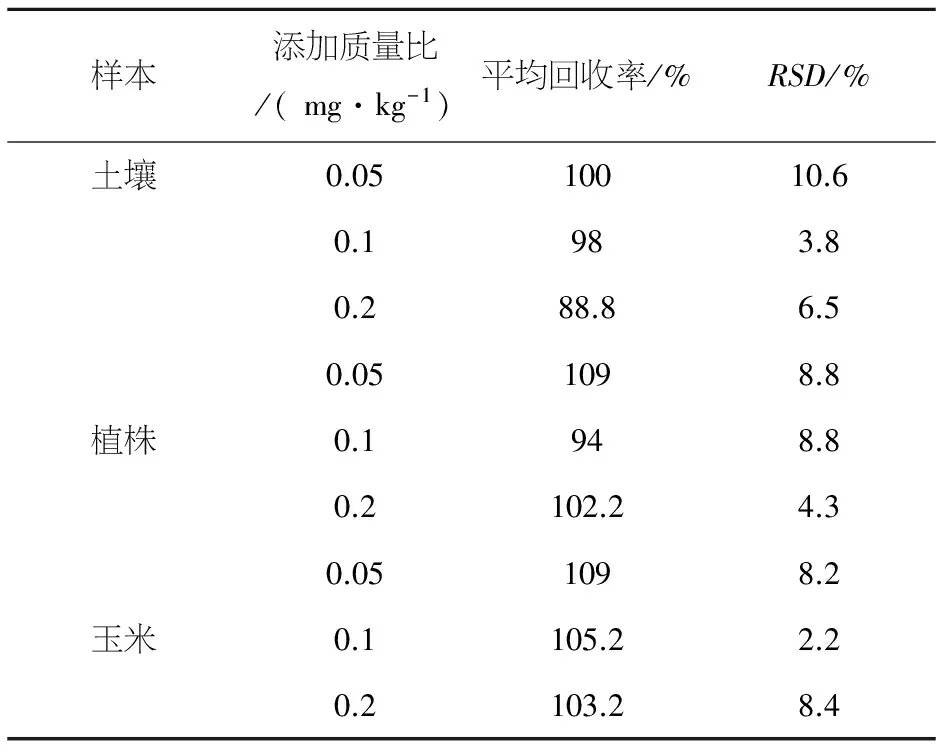
表2 土壤、玉米植株和玉米中添加硝磺草酮的回收率
在添加质量浓度为0.05、0.1、0.2 mg/kg时,土壤回收率为88.8%~100.0%,变异系数为3.8%~10.6%;植株回收率为94.0%~109.0%,变异系数为4.3%~8.8%;玉米回收率为103.2%~109.0%,变异系数为2.2%~8.4%.
3 结 语
本文采用不同的样品前处理方法对土壤和玉米植株以及玉米中样品进行了处理.玉米植株和玉米分别采用SPE-NH2小柱净化,避免了大量有机溶剂的使用,缩短了前处理时间.土壤样品用水振荡提取,液液分配净化,测定结果令人满意.研究结果为不同环境介质中除草剂硝磺草酮的残留量检测提供了有效的前处理方法和检测手段.
[1] 高 爽, 张宗俭, 安伟良, 等. 玉米田除草剂甲基磺草酮的生物活性及安全性[J]. 农药, 2004, 43(10): 469-471.
[2] 苏少泉. 三酮类除草剂磺草酮与硝磺酮的作用特性与使用[J]. 现代农药, 2002, 3: 1-4.
[3] 王小丽, 陈铁春, 李友顺, 等. 硝磺草酮原药高效液相色谱分析方法研究[J]. 农药科学与管理, 2009, 30(6): 44-46.
[4] 李 岩, 于 荣, 姜宜飞, 等. 硝磺·莠去津550克/升悬浮剂高效液相色谱分析方法研究[J]. 农药科学与管理, 2010, 21(5): 41-44.
[5] 吴艳芳, 徐家俊, 李治国, 等. 甲基磺草酮的高效液相色谱分析[J]. 农药, 2009, 48(3): 183-184.
[6] 庞民好, 刘 顺, 张利辉, 等. 新型玉米田除草剂甲基磺草酮在土壤中残留的高效液相色谱分析[J]. 河北农业大学学报, 2007, 30(5): 75-78.
[7] 吴艳娇, 付旭维, 杨 红. 磺酰脲类除草剂在水、土壤及小麦中残留分析的前处理方法研究[J]. 分析科学学报, 2010, 26(5): 517-520.
[8] 汤 婕, 岳永德, 汤 锋. 戊唑醇在小麦中残留分析方法的研究[J]. 安徽农业大学学报, 2011, 38(3): 434-438.
[9] 牛纪娥,叶暾旻,王 璞,等.SPE-HPLC测定土霉素菌渣中土霉素的残留效价[J].哈尔滨商业大学学报:自然科学版,2015,31(2):187-190.
Determination of residue of mesotrione in environmental samples by liquid chromatography
CHEN Guo-feng, REN Hong-bo, JIN Hai-tao, LIU Feng, MA Wen-qiong, ZHANG Xiao-bo, ZHAO Lin
(Ministry of Agriculture Grain and Products Quality Supervision and Testing Center, Harbin 150086, China)
Several pretreatment methods were used for analysis of mesotrione in soil, corn straw and corn. Residues in soil were extracted by water, purified by liquid-liquid extraction. Corn plant samples and corn samples were extracted by acetonitrile and purified by a SPE-Amino. The mesotrione residues in samples were determined by high performance liquid chromatography with UV detector. The linear range was 0.05~0.4 mg/L with the correlation coefficient of 0.999 9. The recoveries were in the range of 88.8%~100.0%, 94.0%~109.0% and 103.2%~109.0%, with relative standard deviations (RSD) of 2.2%~10.6% for the soil, corn straw and corn samples, respectively.
mesotrione; high performance liquid chromatography; environment
2014-04-09.
陈国峰(1983-),男,硕士,助理研究员,研究方向:农药残留及环境毒理.
TQ450
A
1672-0946(2015)03-0341-04
