18F标记正电子分子探针在肿瘤受体显像的应用
2015-03-10贾丽娜
贾丽娜,张 岚
(1.中国科学院 上海应用物理研究所 放射化学与工程技术部,上海 201800;2.中国科学院 钍基熔盐堆核能系统卓越创新中心,上海 201800;3.中国科学院 核辐射与核能技术重点实验室,上海 201800)
18F标记正电子分子探针在肿瘤受体显像的应用
贾丽娜1,2,3,张 岚1,2,3
(1.中国科学院 上海应用物理研究所 放射化学与工程技术部,上海 201800;2.中国科学院 钍基熔盐堆核能系统卓越创新中心,上海 201800;3.中国科学院 核辐射与核能技术重点实验室,上海 201800)
肿瘤受体显像具有高亲和性、高特异性、高选择性及良好的药代动力学特性,在肿瘤的诊断和分期中具有重要作用。本文根据不同的肿瘤受体,对生长抑素(SST)受体、血管活性肠肽(VIP)受体、肿瘤生长因子受体、类固醇激素(SH)受体类肿瘤受体显像剂的18F标记的正电子分子探针进行了综述。
肿瘤受体;正电子分子探针;18F标记;分子影像
大多数的肿瘤细胞能够过量表达某些特定的受体,从而可以应用放射性核素标记的配体对肿瘤进行受体显像,其通过放射性配体与肿瘤受体靶组织产生高亲和性,高特异性的结合,来揭示体内受体的空间分布、密度和亲和力状况[1],不仅在肿瘤的诊断和分期中具有良好的应用前景,还有助于治疗方案确定和预后评价。18F具有优良的核性质与化学性质,其半衰期(109.6 min)相对较长,适于多步合成;正电子能量相对较低(0.64 MeV),显像的分辨率高;18F通过加速器生产,无载体,可获得高比活度的正电子发射断层显像(PET)探针,因此18F-PET探针在肿瘤受体显像中的最具应用潜力。肿瘤受体显像在生长抑素(somatostatin,SST)受体、血管活性肠肽(vasoactive intestinal peptide,VIP)受体、血管内皮生长因子(vascular endothelial growth factor,VEGF)受体、表皮生长因子(epidermal growth factor,EGF)受体、类固醇激素受体、蛙皮素/胃泌素释放肽等的PET显像方面取得了许多研究成果。本文根据上述肿瘤受体的不同,综述了18F标记的PET探针的研究进展。
1 SSTR 18F标记探针
SST是一种含有十四个或十八个氨基酸的环状多肽,广泛存在于中枢神经系统和消化系统,其受体SSTR是一种表达于细胞膜上的G-蛋白偶联受体,通过与配体结合产生跨膜信号[2]。SSTR除在正常组织细胞分布外,在神经内分泌瘤、脑膜瘤、垂体腺瘤、成神经细胞瘤、乳腺癌、小细胞肺癌等中均过量表达[3],因此,可以应用放射性核素标记的SST及其类似物
进行肿瘤受体靶向显像。目前可用于放射性标记的SST类似物有奥曲肽(octreotide,SMS201-995)、伐普肽(vapreotide,RC-160)、兰乐肽(lanreotide,BIM23014)等,研究最多也最成熟的是奥曲肽,其中111In-DTPA-octreotide(OctreoscanTM)[4]于1994年通过了FDA批准,是一种在临床上用于对的SSTR阳性表达的神经内分泌瘤显像探针。由于18F标记方法的限制,奥曲肽的18F标记探针(图1)的报道较少。
研究发现,糖基化的奥曲肽Gluc-Lys(18F-FP)TOC(18F(N(α)-(1-deoxy-D-fructosyl)-N(ε)-(2-[18F]fluoropropionyl)-Lys(0)-Tyr(3)-octreotide)亲脂性降低,药代动力学性质明显改善,在对腹部和肺部肿瘤的PET显像中,肿瘤摄取均较高,并且应用Gluc-Lys(18F-FP)TOC可以诊断出一些111In-DTPA-octreotide无法检测到的病变[5],但是该PET探针需要完善制备方法,解决制备繁琐耗时、放化产率低的问题。Cel-S-Dpr([18F]FBOA)TOCA是Schottelius等[6]通过两步法选择性的成肟偶联反应制备的第一个适于临床常规应用的生长抑素PET显像探针,该探针具有良好的药代动力学特性,比Gluc-Lys([18F]FP)TOCA有更高的肿瘤与正常组织吸收比,合成时间(50 min)极大缩短,放化产率(65%~85%)显著提高。利用[18F]AlF-NOTA偶联法对奥曲肽进行标记避免了苛刻的无水反应条件,反应过程简单,标记时间更短[7-8]。最近,Iddon研究小组采用点击化学的方法合成了五种18F标记的奥曲肽,其中18F-FET-G-TOCA和18F-FET-βAG-TOCA标记率最高,在20 ℃反应5 min就能够完全转化[9]。PET显像可见18F-FET-G-TOCA和18F-FET-βAG-TOCA在肿瘤的摄取均高于18F-AIF-NOTA-TOCA,能高结合特异性的快速在靶点浓集,并具有较快的药代动力学,从而能得到高对比度的PET图像,具有应用于临床的巨大潜能[10]。

图1 生长抑素受体(SSTR)18F标记PET探针Fig.1 18F labeling PET probes of somatostatin receptor (SSTR)
2 血管活性肠肽受体18F标记探针
血管活性肠肽(vasoactive intestinal polypeptide,VIP)是一种由28个氨基酸组成的肽激素(H-His-Ser-Asp-Ala-Val-Phe-Thr-Asp-Asn-Tyr-Thr-Arg-Leu-Arg-Lys-Gln-Met-Ala-Val-Lys-Lys-Tyr-Leu-Asn-Ser-Ile-Leu-Asn-OH),广泛存在于外周和中枢神经系统[11]。VIP受体有VPAC1和VPAC2两个亚型,除了在各种正常组织中表达外,还在各种恶性肿瘤中大量表达,如肺癌、乳腺癌、前列腺癌、结直肠癌等[12-13]。
VIP受体阳性表达的肿瘤,具有较高的显像灵敏度和特异性。多种放射性核素标记的VIP类似物显像探针在肿瘤的诊断中都有较好的应用价值[14]。程登峰等[[15-16]]报道了18F标记的VIP类PET显像探针,设计了一种[R8,15,21,L17]-VIP类似物,通过两种不同的合成子18F-SFB和18F-SFMB对VIP类似物进行了标记,两种方法用时均较短,且标记产物具有较高的放化纯度、放化产率和比活度。其中18F-FB-[R8,15,21,L17]-VIP显示出更好的体内代谢稳定性,在对结肠癌的micro-PET显像评价证实,该探针有较高的肿瘤特异性吸收,肿瘤与正常组织的吸收比在1 h时达3.03。与123I-VIP相比,肺部与肿瘤吸收比显著降低,并且在120 min时肝脏吸收背景较低,有利于对结肠癌肝转移病变显像[17]。
3 肿瘤生长因子受体18F标记探针
生长因子是一类能够通过与特异的高亲和的细胞膜受体结合来调节细胞生长与组织分化等多种功能的细胞因子,属于多肽类物质。主要包含EGF、VEGF、胰岛素样生长因子(insulin-like growth factor,IGF-1)、成纤维细胞生长因子(fibroblast growth factor,FGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)等。由于生长因子受体在很多肿瘤中都表达或过量表达,因此,近年来针对肿瘤生长因子受体显像进行了大量的研究报道,特别是EGFR和VEGFR。
3.1 肿瘤血管表皮生长因子受体18F标记探针
EGFR是一个具有酪氨酸激酶活性的跨膜糖蛋白,研究表明,许多肿瘤中都存在着EGFR的表达增高或异常表达,如非小细胞肺癌、乳腺癌、宫颈癌等[18]。EGFR与肿瘤细胞的增殖、新生血管生成、肿瘤侵袭、转移及预后密切相关[19],因此是非常有潜力的肿瘤PET显像靶点。
喹唑啉类的EGFR酪氨酸激酶(tyrosine kinase,TK)抑制剂18F-PET探针(图2)研究报道的较多。Bonasera等[20]制备了五个EGFR-TK PET探针,对18F-1~18F-3进行了体外评价与荷人表皮样畸胎瘤鼠的体内评价。尽管有较好的体外评价结果,但是较差的药代动力学性质造成显著的肝摄取和肠道再吸收,使得这些探针不适于体内的EGFR-TK显像应用。通过在探针上偶联聚乙二醇侧链可以增加了探针的亲水性[21-22],但是生物学评价发现18F-4对EGFR的特异结合性和肿瘤摄取没有因亲水性的增加而显著改善[21],并且耗时的多步合成导致放化产率较低。Kobus等[23]通过点击化学的方法制备了EGFR-TK PET探针18F-5,PET显像评价发现18F-5在肿瘤有明显浓集,但是非靶器官也有摄取。Pisaneschi等[24]为解决上述问题,制备了18F-6,代谢稳定性更高,PET显像肿瘤摄取清晰可见。
靶向EGFR的多肽、蛋白类的18F-PET探针也有报道。Denholt等[25]研究发现,在荷人多形性胶质母细胞瘤模型中,多肽类PET探针18F-FBAFALGEANH能够选择性的与EGFRvⅢ结合,肿瘤与肌肉的吸收比和EGFRvⅢ表达水平具有显著相关性,但是该探针在体内会快速降解,需要进一步的结构修饰提高体内稳定性。Li等[26]制备了18F标记的EGF-18F-FBEM-cEGF,当肝脏用优化量的EGF阻断时,在头颈部鳞状细胞癌模型中,18F-FBEM-cEGF在肿瘤的摄取(5.99±1.61)% ID/g,注射后30 min,p<0.01)和肿瘤与正常组织吸收比会显著提高。18F-FBEM-Cys-ZEGFR是1907[27]首个报道的18F标记的抗EGFR亲合体PET探针,在EGFR阳性表达的肿瘤和监测EGFR表达水平显像中极具潜力。尽管亲和力较低,但是在恶性胶质母细胞瘤、结肠癌、口腔癌等多种动物模型中均有良好的显像效果。

图2 喹唑啉类的EGFR 18F-PET探针Fig.2 EGFR 18F-PET probes of quinazolines
3.2 肿瘤血管内皮生长因子受体18F标记探针
VEGF是目前理解最为透彻的生成因子合成肽,主要通过与其受体VEGFR-1(Flt-1)以及VEGFR-2(KDR/Flk-1)相互作用调控血管生成的过程[28]。VEGF在多种肿瘤中过量表达[29-30],是目前研究比较活跃的肿瘤显像和治疗靶点。
3-(4’-[18F]氟-苯亚甲基)二氢吲哚-2-酮(18F-SU5416)是SU5416(Semaxinib®)的类似物[31],对VEGFR具有微摩尔级的抑制活性,放化产率只有4%。18F-SU5416的体内代谢稳定性较差,注射20 min后只有12%的示踪剂没有降解。在人咽鳞癌动物模型PET显像评价发现肿瘤或者其他VEGFR表达丰富的组织都没有对18F-SU5416的特异性摄取。18F-PET探针18F-Sorafenib(1-[4-(6,7-Dimethoxy-quinolin-4-yloxy)-3-fluorophenyl]-3-(4-[18F]fluoro-phenyl)-urea)是索拉非尼(Sorafenib)的类似物,放化产率46%,在人血清中具有良好的稳定性[32]。18F-SU5416与18F-Sorafenib的结构如图3所示。
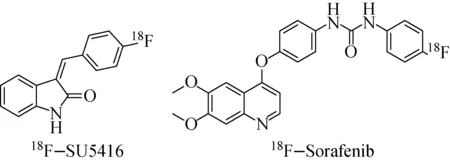
图3 18F-SU5416和18F-Sorafenib的分子结构Fig.3 Molecular structures of 18F-SU5416 and 18F-Sorafenib
Wang等[33]制备了18F标记的单链VEGF蛋白(sc-VEGF)18F-FBEM-scVEGF,放化产率(20.6±15.1)%(n= 5,未衰变校正),比活度(58.8±12.4) GBq/μmol。该探针具有高的受体结合特异性,在乳腺癌、人恶性胶质母细胞瘤等VEGFR大量表达的动物模型中,肿瘤都有特异性的摄取。18F-FBEM-scVEGF在VEGFR表达的PET显像具有重要潜力,对于肿瘤诊断和疗效评价具有重要价值。
4 类固醇激素受体18F标记探针
类固醇激素受体(steroid hormone receptor, SHR)是一种细胞内受体,主要分为糖皮质激素受体(glucocorticoid receptor)、盐皮质激素受体(mineralocorticoid receptor)、雄激素受体(androgen receptor,AR)、雌激素受体(estrogen receptor,ER)、孕酮受体(progesterone receptor,PR)等。类固醇激素受体是激素依赖性肿瘤潜在的生物学诊断和治疗靶标,受体蛋白在多种癌细胞中的过量表达以及其与特定配体的特异结合性有利肿瘤诊断。目前,研究报道比较多的是ER、AR和PR的PET显像探针(图4)。

图4 类固醇激素受体(SHR)18F标记PET探针Fig.4 18F-PET probes of steroid hormone receptor
4.1 雌激素受体18F标记探针
18F-FES(16α-[18F]fluoro-17β-estradiol)已经在临床得到应用,主要经肝脏摄取并代谢,注射到体内30 min后即能够获得最佳的PET显像结果[34]。18F-FES在临床中广泛应用于ER阳性表达的乳腺癌及其转移灶诊断、分期和预后评估[35]。应用18F-FES-PET显像检测乳腺癌ER表达的敏感度为69%~100%,特异性为80%~100%(与体外评价比较)[36]。雌激素受体显像与ER在体外分析结果关系实验发现,18F-FES的摄取值与ER的浓度相关性良好,对于不能活检的患者,18F-FES-PET显像可以无损伤的评估ER表达水平,协助治疗方案的制定[37]。18F-FES-PET显像还能够用于评价抗雌激素疗法对乳腺癌患者的疗效评估[38]。但是,从18F-FES的肿瘤吸收降低还不能可靠的区分治疗相应患者和无治疗响应患者,还需结合其他显像探针的显像结果。
此外,为了提高探针对ER的亲和性以及稳定性,近年还有其他靶向ER的18F-PET探针研究报道,如18F-βFMOX(16β-[18F]fluoromoxestrol)[39],但探针的性质都不够理想,还需进一步完善。
4.2 孕酮受体18F标记探针
PR在某些乳腺癌和子宫内膜癌中过量表达,是非常有利的肿瘤显像靶点。18F-FENP是首个被报道PR类18F-PET显像探针[40],但其对PR的亲和性较低,且探针的摄取与肿瘤PR表达水平无相关性,另外18F-FENP代谢稳定性差、易脱氟[41],从而限制了其在人体的PR显像应用。最近,Lee等报道了一种新的PR18F-PET探针18F-FFNP[42],在对乳腺癌患者临床显像发现[43],肿瘤与正常组织比与PR表达水平显著相关,而SUVmax与PR的表达水平无显著相关性。18F-FFNP可用于评价乳腺癌患者的PR水平,同时也是一种确定在开始治疗前或者在一线或二线内分泌疗法后确定患者是否适合抗雌激素治疗的重要手段。Fowler等[44]研究证实了18F-FFNP PET显像在评价抗雌激素疗法早期治疗效果中具有十分重要的潜力。
4.3 雄激素受体18F标记探针
目前,有多种雄激素类似物的18F-PET探针被报道[69-71]。20-18F-FMib是首个被报道的AR18F-PET探针,20-18F-FMib的摄取可以被睾丸素和内源性的雄激素阻断[45]。18F-FDHT是一个非常有潜力的监测前列腺癌中AR表达水平的PET探针。该探针通过三步反应制备,放化产率31%~48%,放化纯度>99%,比活度43 GBq/μmol[46]。Larson研究小组[47]首次证明了18F-FDHT应用于前列腺癌患者显像的可行性,18F-FDHT会在肿瘤部位迅速浓集,并最少保留50 min。Dehdashti等[48]研究证实前列腺癌经过AR拮抗剂治疗后18F-FDHT的摄取显著降低,通过18F-FDHT PET显像可以检测到前列腺癌的转移和复发,并可应用于对治疗效果的评估。
5 结语
肿瘤受体PET显像不仅能够提供配体在肿瘤特异性浓集的直观证据,还能够提供肿瘤受体与配体特异性结合的信息,既揭示了肿瘤受体的密度和空间分布,又揭示了肿瘤受体的亲和力,具有广泛的应用前景。目前,我国肿瘤受体18F标记正电子显像的临床研究和应用较少,还没有建立比较完善的肿瘤受体显像的定量分析方法,因此还需发展特异性好、稳定性高、具有理想药代动力学特性的肿瘤受体18F标记PET显像探针,建立精确的肿瘤受体显像定量分析方法,加速肿瘤受体显像18F标记PET探针在肿瘤早期诊断、分期、治疗方案确定和预后评价中的应用。
[1] 王荣福. PET/CT—分子影像学新技术应用[M]. 北京:北京大学医学出版社,2011:255-271.
[2] Reichlin S. Somatostatin.1[J]. N Engl J Med, 1983, 309(24): 1 495-1 501.
[3] Schulz S, Schmitt J, Quednow C, et al. Immunohistochemical detection of somatostatin receptors in human ovarian tumors[J]. Gynecol Oncol, 2002, 84(2): 235-240.
[4] Rufini V, Calcagni M L, Baum RP. Imaging of neuroendocrine tumors[J]. Semin Nucl Med, 2006, 36(3): 228-247.
[5] Meisetschlager G, Poethko T, Stahl A, et al. Gluc-Lys( F-18 FP)-TOCA PET in patients with SSTR-positive tumors: Biodistribution and diagnostic evaluation compared with In-111 DTPA-octreotide[J]. J Nucl Med, 2006, 47(4): 566-573.
[6] Schottelius M, Wester H J, Reubi J C, et al. Improvement of pharmacokinetics of radioiodinated Tyr(3)-octreotide by conjugation with carbohydrates[J]. Bioconjug Chem, 2002, 13(5): 1 021-1 030.
[7] Laverman P, McBride W J, Sharkey R M, et al. A Novel Facile Method of Labeling Octreotide With18F-Fluorine[J]. J Nucl Med, 2010, 51(3): 454-461.
[8] McBride W J, D Souza C A, Sharkey R M, et al. Improved F-18 Labeling of Peptides with a Fluoride-Aluminum-Chelate Complex[J]. Bioconjugate Chem, 2010, 21(7): 1 331-1 340.
[9] Iddon L, Leyton J, Indrevoll B, et al. Synthesis and in vitro evaluation of F-18 fluoroethyl triazole labelled Tyr(3) octreotate analogues using click chemistry[J]. Bioorg Med Chem Lett, 2011, 21(10): 3 122-3 127.
[10]Leyton J, Iddon L, Perumal M, et al. Targeting Somatostatin Receptors: Preclinical Evaluation of Novel F-18-Fluoroethyltriazole-Tyr(3)-Octreotate Analogs for PET[J]. J Nucl Med, 2011, 52(9): 1 441-1 448.
[11]Ishihara T, Shigemoto R, Mori K, et al. Functional expression and tissue distribution of a novel receptor for vasoactive intestinal polypeptide[J]. Neuron, 1992, 8(4): 811-819.
[12]Szilasi M, Buglyo A, Treszl A, et al. Gene expression of vasoactive intestinal peptide receptors in human lung cancer[J]. Int J Oncol, 2011, 39(4): 1 019-1 024.
[13]Fernandez-Martinez AB, Carmena MJ, Arenas MI, et al. Overexpression of vasoactive intestinal peptide receptors and cyclooxygenase-2 in human prostate cancer. Analysis of potential prognostic relevance[J]. Histol Histopath, 2012, 27(8): 1 093-1 101.
[14]Rangger C, Helbok A, Ocak M, et al. Design and Evaluation of Novel Radiolabelled VIP Derivatives for Tumour Targeting[J]. Anticancer Res, 2013, 33(4): 1 537-1 546.
[15]Cheng D F, Yin D Z, Li G C, et al. Radiolabeling and in vitro and in vivo characterization of F-18 FB- R-8, R-15, R-21, L-17 -VIP as a PET imaging agent for tumor overexpressed VIP receptors[J]. Chem Biol Drug Des, 2006, 68(6): 319-325.
[16]Cheng DF, Yin DZ, Zhang L, et al. Preparation of the novel fluorine-18-labeled VIP analog for PET imaging studies using two different synthesis methods[J]. J Fluor Chem, 2007, 128(3): 196-201.
[17]Cheng D F, Liu Y X, Shen H, et al. F-18 Labeled Vasoactive Intestinal Peptide Analogue in the PET Imaging of Colon Carcinoma in Nude Mice[J]. Biomed Research International, 2013.
[18]Wieduwilt M J, Moasser M M. The epidermal growth factor receptor family: biology driving targeted therapeutics[J]. Cell Mol Life Sci, 2008, 65(10): 1 566-1 584.
[19]Chung C H, Ely K, McGavran L, et al. Increased epidermal growth factor receptor gene copy number is associated with poor prognosis in head and neck squamous cell carcinomas[J]. J Clin Oncol, 2006, 24(25): 4 170-4 176.
[20]Bonasera T A, Ortu G, Rozen Y, et al. Potential18F-labeled biomarkers for epidermal growth factor receptor tyrosine kinase[J]. Nucl Med Biol, 2001, 28(4): 359-374.
[21]Pantaleo M, Mishani E, Nanni C, et al. Evaluation of modified PEGanilinoquinazoline derivatives as potential agents for EGFR imaging in cancer by small animal PET[J]. Mol maging Biol, 2010, 12(6): 616-625.
[22]Pal A, Balatoni J, Mukhopadhyay U, et al. Radiosynthesis and initial in vitro evaluation of [18F]FPEG- IPQA - a novel PET radiotracer for imaging EGFR expression-activity in lung carcinomas[J]. Mol Imaging Biol, 2011, 13(5): 853-861.
[23]Kobus D, Giesen Y, Ullrich R, et al. A Fully Automated Two-Step Synthesis of An18F-Labelled Tyrosine Kinase Inhibitor for EGFR Kinase Ativity Imaging in Tumors[J]. Appl Radiat Isot, 2009, 67: 1 977-1 984.
[24]Pisaneschi F, Nguyen Q D, Shamsaei E, et al. Development of A New Epidermal Growth Factor Receptor Positron Emission Tomography Imaging Agent Based on the 3-Cyanoquinoline Core: Synthesis and Biological Evaluation[J]. Bioorg Med Chem, 2010, 18(18): 6 634-6 645.
[25]Denholt C L, Binderup T, Stockhausen M T, et al. Evaluation of 4- F-18 fluorobenzoyl-FALGEA-NH2 as a positron emission tomography tracer for epidermal growth factor receptor mutation variant Ⅲ imaging in cancer[J]. Nucl Med Biol, 2011, 38(4): 509-515.
[26]Li W H, Niu G, Lang L X, et al. PET imaging of EGF receptors using F-18 FBEM-EGF in a head and neck squamous cell carcinoma model[J]. Eur J Nucl Med Mol Imaging, 2012, 39(2): 300-308.
[27]Miao Z, Ren G, Liu H G, et al. PET of EGFR Expression with an F-18-Labeled Affibody Molecule[J]. J Nucl Med, 2012, 53(7): 1 110-1 118.
[28]Cai W B, Chen X Y. Multimodality imaging of vascular endothelial growth factor and vascular endothelial growth factor receptor expression[J]. Frontiers in Bioscience, 2007, 12: 4 267-4 279.
[29]Aricò A, Giantin M, Gelain M E, et al. The role of vascular endothelial growth factor and matrix metalloproteinases in canine lymphoma: in vivo and in vitro study[J]. BMC Vet Res, 2013, 9: 94.
[30]Ma C Y, Li Y, Zhang X F, et al. Levels of vascular endothelial growth factor and matrix metalloproteinase-9 proteins in patients with glioma[J]. Int Med Res, 2014, 42(1): 198-204.
[31]Kniess T, Bergmann R, Kuchar M, et al. Synthesis and radiopharmacological investigation of 3-[4′-[18F]fluorobenzylidene]-indolin-2-one as possible tyrosine kinase inhibitor[J]. Bioorg Med Chem, 2009, 17(22): 7 732-7 742.
[32]Ilovich O, Jacobson O, Aviv Y, et al. Formation of fluorine-18 labeled diaryl ureas-labeled VEGFR-2/PDGFR dual inhibitors as molecular imaging agents for angiogenesis[J]. Bioorg Med Chem, 2008, 16(8): 4 242-4 251.
[33]Wang H, Gao H K, Guo N, et al. Site-Specific Labeling of scVEGF with Fluorine-18 for Positron Emission Tomography Imaging[J]. Theranostics, 2012, 2(6): 607-617.
[34]Mankoff D A, Tewson T J, Eary J F. Analysis of blood clearance and labeled metabolites for the estrogen receptor tracer [F-18]-16α-fluoroestradiol (FES)[J]. Nucl Med Biol, 1997, 24(4): 341-348.
[35]Linden H M, Stekhova S A, Link J M, et al. Quantitative fluoroestradiol positron emission tomography imaging predicts response to endocrine treatment in breast cancer[J]. J Clin Oncol, 2006, 24(18): 2 793-2 799.
[36]Peterson L M, Mankoff D A, Lawton T, et al. Quantitative imaging of estrogen receptor expression in breast cancer with PET and18F-fluoroestradiol[J]. J Nucl Med, 2008, 49(10): 367-374.
[37]van Kruchten M, Glaudemans A W, de Vries EF, et al. PET Imaging of Estrogen Receptors as a Diagnostic Tool for Breast Cancer Patients Presenting with a Clinical Dilemma[J]. J Nucl Med, 2012, 53(2), 182-190.
[38]Fowler A M, Chan S R, Sharp T L, et al. Small-Animal PET of Steroid Hormone Receptors Predicts Tumor Response to Endocrine Therapy Using a Preclinical Model of Breast Cancer[J]. J Nucl Med, 2012, 53(7): 1 119-1 126.
[39]Jonson S D, Bonasera T A, Dehdashti F, et al. Comparative breast tumor imaging and comparative in vitro metabolism of 16-[18F]fluoroestradiol-17 and 16-[18F]fluoromoxestrol in isolated hepatocytes[J]. Nucl Med Biol, 1999, 26(1): 123-130.
[40]Zeelen F J, Vandenbroek A J. Synthesis of 16α-ethyl-21-hydroxy-19-norpregn-4-ene-3, 20-dione (Org 2058)[J]. Recueil Des Travaux Chimiques Des Pays-Bas-Journal of the Royal Netherlands Chemical Society, 1985, 104(9): 239-242.
[41]Dehdashti F, McGuire A H, Vanbrocklin H F, et al. Assessment of 21-[18F]fluoro-16α-ethyl-19- norprogesterone as a positron emitting radiopharmaceutical for the detection of progestin receptors in human breast carcinomas[J]. J Nucl Med, 1991, 32(8): 1 532-1 537.
[42]Lee J H, Zhou H B, Dence C S, et al. Development of [F-18]fluorinesubstituted Tanaproget as a progesterone receptor imaging agent for positron emission tomography[J]. Bioconjug Chem, 2010, 21(6): 1 096-1 104.
[43]Dehdashti F, Laforest R, Gao F, et al. Assessment of Progesterone Receptors in Breast Carcinoma by PET with 21-18F-Fluoro-16alpha,17alpha-[(R)-(1′-alphafurylmethylidene)Dioxy]-19-Norpregn-4-Ene-3, 20-Dione[J]. J Nucl Med, 2012, 53(3): 363-370.
[44]Fowler A M, Chan S R, Sharp T L, et al. Small-Animal PET of Steroid Hormone Receptors Predicts Tumor Response to Endocrine Therapy Using a Preclinical Model of Breast Cancer[J]. J Nucl Med, 2012, 53(7), 1 119-1 126.
[45]Liu A J, Katzenellenbogen J A, VanBrocklin HF, et al. 20-[18F]fluoromibolerone, a positron-emitting radiotracer for androgen receptors: synthesis and tissue distribution studies[J]. J Nucl Med, 1991, 32(1): 81-88.
[46]Liu A, Dence C S, Welch M J, et al. Fluorine-18-labeled androgens: radiochemical synthesis and tissue distribution studies on six fluorine-substituted androgens, potential imaging agents for prostatic cancer[J]. J Nucl Med, 1992, 33(5): 724-734.
[47]Larson S M, Morris M, Gunther I, et al. Tumor localization of 16b-18F-fluoro-5a-dyhidrotestosterone versus18F-FDG in patients with progressive, metastatic prostate cancer[J]. J Nucl Med, 2004, 45(3): 366-373.
[48]Dehdashti F, Picus J, Michalski J M, et al. Positron tomographic assessment of androgen receptors in prostatic carcinoma[J]. Eur J Nucl Med Mol Imag, 2005, 32(3): 344-350.
Application of18F-Labeling Positron Molecular Probes in Tumor Receptor Imaging
JIA Li-na1,2,3, ZHANG Lan1,2,3
(1.DepartmentofRadiochemistryandEngineering,ShanghaiInstituteofAppliedPhysics,ChinaAcademyofSciences,Shanghai201800,China; 2.CAScenterforexcellenceTMSRenergysystem,Shanghai201800,China; 3.KeyLaboratoryofNuclearRadiationandNuclearEnergyTechnology,ChinaAcademyofSciences,Shanghai201800,China)
Tumor receptor imaging characterized by high affinity, high specificity, high selectivity and favorable pharmacokinetic properties, plays a significant role in the diagnosis and staging of tumor. The research progress of18F labeling positron molecular probes for tumor receptor imaging were reviewed according to tumor receptors which included somatostatin (SST) receptor, vasoactive intestinal polypeptide (VIP) receptor, tumor growth factor receptors, and steroid hormone (SH) receptors.
tumor receptor; positron molecular probe;18F labeling; molecular imaging
10.7538/tws.2015.28.02.0121
2014-09-09;
2014-11-17
中国科学院先导科技专项(XDA02030000)
贾丽娜(1985—),女,博士,主要从事放射性药物研究
张 岚,男,博士,研究员,博士生导师,E-mail: zhanglan@sinap.ac.cn
TL364.5;TL92+3
A
1000-7512(2015)02-0121-09
