参麦注射液联用低分子肝素钙后在大鼠体内药动学特征研究
2015-03-10王鹏薛清丹鞠爱霞康宇红李秋红
王鹏,薛清丹,鞠爱霞,康宇红,李秋红
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
心脑血管疾病发病机制复杂,单用一种药物进行治疗难以收到满意效果,临床目前主要采用药物联用的治疗方法。随着中西医结合的深入开展,加之心脑血管疾病病因复杂,常采用反应较快、针对性强的西药与作用缓和持久的中药联合治疗方针,中西药联合用药方法表现出了独特的疗效和强大的优势[1-2]。参麦注射液是由人参、麦门冬组成的中药制剂,具有益气固脱、养阴生津、生脉的功效,临床用于心脑血管疾病、免疫力低下、肿瘤及各种慢性疾病的辅助治疗[3-5]。近几年随着中西联合用药情况的普遍发展[6-9],参麦注射液与其他西药联合用药治疗心脑血管疾病情况越来越多,且疗效显著[10-14],其中以抗凝类的低分子肝素钙与参麦注射液联用情况最多。然而联合应用的理论基础在国内外尚未有较深入的实验研究。本实验以人参皂苷Rg1、Re、Rb1作为参麦注射液的指标成分,研究单独用药及与低分子肝素钙联用后参麦注射液在大鼠体内的药动学,从药动学角度观察中西药联合用药后西药对中药体内过程的影响,为临床上参麦注射液与西药合理联合应用且疗效增强的机制探讨提供参考依据。
1 材料
1.1 药品与试剂
人参皂苷Rg1、Re、Rb1对照品(中国药品生物制品检定所,批号分别为110703-200726、110754-200822、110704-200921);参麦注射液(神威药业有限公司,批号11122721);低分子肝素钙注射液(兆科药业有限公司,批号01070012);甲醇(Dikma试剂公司,批号70242,色谱纯);乙腈(Tedia试剂公司,批号1110410,色谱纯);其他试剂均为分析纯;水为超纯水。
1.2 仪器
高效液相色谱仪(LC-2010A,日本岛津);旋涡混合器(XW-80A,上海);低速台式离心机(TDL-60B,上海);超声波清洗器(SK8200H,上海);微量移液器(GILSON,法国);电子天枰(AR2140,上海);高速冷冻离心机(TGL16M,长沙)。
1.3 实验动物
清洁级Wistar大鼠,雄性,体质量180~250g,由黑龙江中医药大学实验动物中心提供,动物许可证号:SYXK(黑)2008-001)。
2 方法与结果
2.1 色谱条件
色谱柱:Diamonsil(R)C18柱(250mm×4.6mm,5μm),大连物理化学研究所;流动相:乙腈-水(0~30min,20:80递变至22:78;30~35min,22:78;35~60min,22:78递变至40:60);流速:1.0mL/min;柱温:20℃;检测波长:203nm;进样量:20μL。
2.2 溶液的制备
分别精密称取人参皂苷Rg1、Re、Rb1对照品适量,甲醇溶解,配成1.0mg/mL对照品储备液;另精密取内标大豆苷元对照品适量,甲醇溶解,配成1.0mg/mL储备液。
2.3 生物样品处理
吸取血浆样品150μL置于1.5mL离心管中,加入内标溶液20μL,加入400μL乙腈,涡旋混合3min,14000r/min低温离心10min,取450μL上清液于40℃氮气吹干,而后用100μL 20%的乙腈-水溶液进行复溶,涡旋混合1min,14000r/min低温离心5min,取20μL上清液进样分析。
2.4 方法学考察
2.4.1 专属性实验
给药后的血浆样品,按“生物样品处理”项操作后进样。结果表明血浆中的内源性物质和内标物质均不干扰,本方法的专属性符合要求。

图1 给药后血浆样品中人参皂苷Rg1、Re、Rb1及大豆苷元生物样品色谱图
2.4.2 人参皂苷Rg1、Re、Rb1血浆标准曲线的制备
取空白血浆,分别精密加入人参皂苷Rg1、Re、Rb1标准品溶液适量。配制人参皂苷Rg1、Re、Rb1血浆标准系列。按“生物样品处理”项操作,分别以样品与内标峰面积比值y对样品浓度x进行线性回归,得到人参皂苷Rg1、Re、Rb1血浆标准曲线方程及线性范围为分别为:y=0.0018x-0.002,r=0.9996,1.0~30.0μg/mL;y=0.0012x+0.0005,r=0.9996,0.5~15.0μg/mL;y=0.0014x-0.0004,r=0.9995,0.5~200.0μg/mL。
2.4.3 人参皂苷Rg1、Re、Rb1的精密度与相对回收率
分别配制高、中、低浓度的人参皂苷Rg1、Re、Rb1血浆QC样品。按“生物样品处理”项操作,进行精密度和回收率实验。结果表明该方法的回收率符合要求,人参皂苷Rg1日内和日间精密度的RSD均小于5%;人参皂苷Re、Rb1日内和日间精密度的RSD均小于10%。
2.4.4 稳定性考察
分别配制高、中、低浓度的人参皂苷Rg1、Re、Rb1血浆QC样品,进行稳定性考察。结果表明人参皂苷Rg1、Re、Rb1血浆样品室温稳定保存12h及冷冻保存30天稳定性良好(RSD<5%)。
2.5 药动学研究
Wistar大鼠12只,随机分成2组。分别为参麦注射液单独组(9.00mL/kg,尾静脉注射);低分子肝素钙注射液(1.44mL/kg,皮下注射)+参麦注射液联合组;各组大鼠均于给药前和给药后5min、15min、30min、45min、1h、1.5h、2h、3h、6h、12h、24h、48h、96h、144h眼静脉采集血液样品300μL置肝素化的试管中,3000r/min离心,分离血浆,-20℃保存待测。
2.6 数据处理与统计分析
采用DAS 2.0统计软件对12只健康大鼠服药后各时间点的血浆药物浓度进行分析,用统计矩法计算各项药动学参数,并采用SPSS 18.0对药动学参数进行统计学分析,以P<0.05为差异有统计学意义。
2.7 低分子肝素钙对人参皂苷Rg1、Re、Rb1在大鼠体内药动学的影响
2.7.1 联合用药对人参皂苷Rg1在大鼠体内药动学的影响
单独及联合低分子肝素钙给药后人参皂苷Rg1的血药浓度-时间曲线(图2),相关药动学参数见表1。参麦注射液与低分子肝素钙联用后人参皂苷Rg1的血药浓度均升高,显示出了统计学差异;联合低分子肝素钙后人参皂苷Rg1的CL降低,MRT延长,AUC(0-144)和AUC(0-∞)均显著升高。
表1 联合低分子肝素钙用药后人参皂苷Rg1在大鼠体内的药动学参数(n=6,)
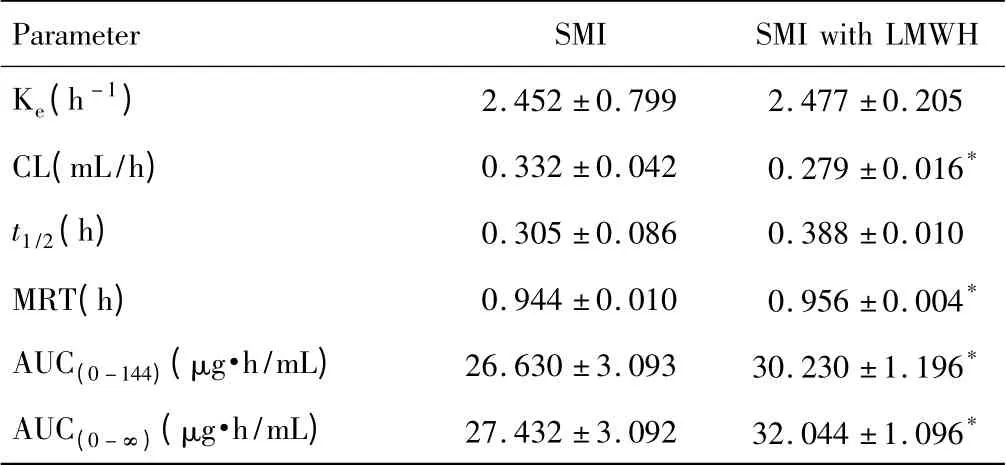
表1 联合低分子肝素钙用药后人参皂苷Rg1在大鼠体内的药动学参数(n=6,)
注:与单独给药组相比,*P<0.05,**P<0.01。
Parameter SMI SMIwith LMWH Ke(h-1)2.452±0.799 2.477±0.205 CL(mL/h) 0.332±0.042 0.279±0.016*t1/2(h) 0.305±0.086 0.388±0.010 MRT(h) 0.944±0.010 0.956±0.004*AUC(0-144)(μg·h/mL) 26.630±3.093 30.230±1.196*AUC(0-∞)(μg·h/mL) 27.432±3.092 32.044±1.096*
2.7.2 联合用药对人参皂苷Re在大鼠体内药动学的影响
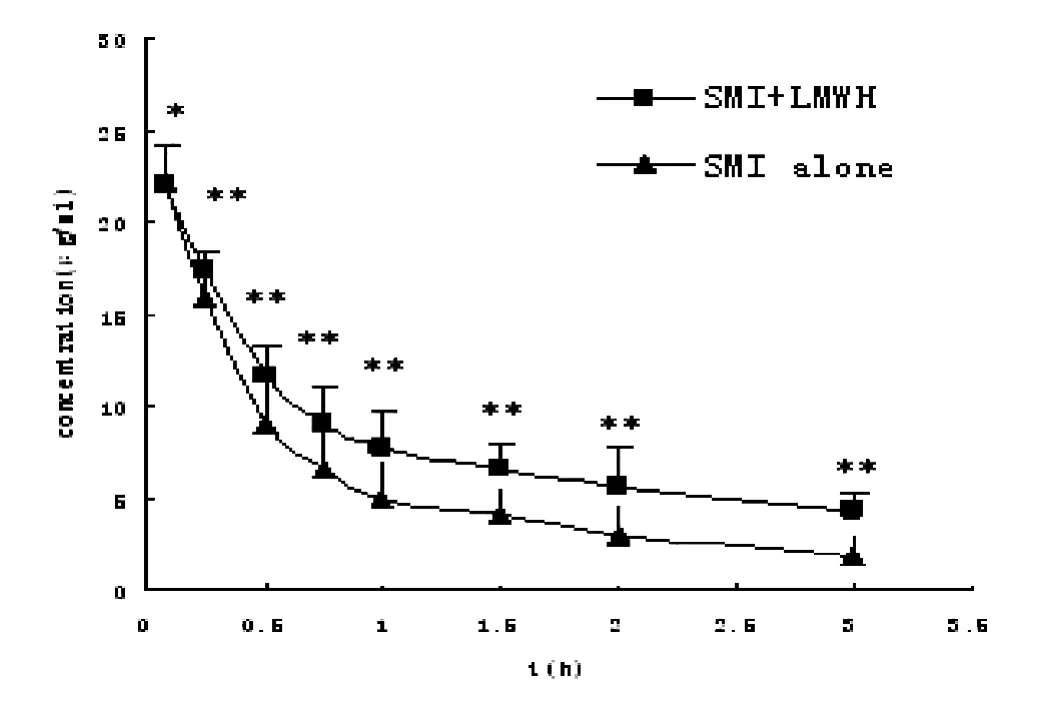
图2 单用及联用低分子肝素钙后人参皂苷Rg1在大鼠体内的血浆药-时曲线(n=6,)
单独及联合低分子肝素钙给药后人参皂苷Re的血药浓度-时间曲线(图3),相关药动学参数见表2。单独及联用低分子肝素钙注射液后人参皂苷Re在大鼠体内的血药浓度变化趋势基本一致,无显著性差异,人参皂苷Re的药动学参数没有显著性变化。
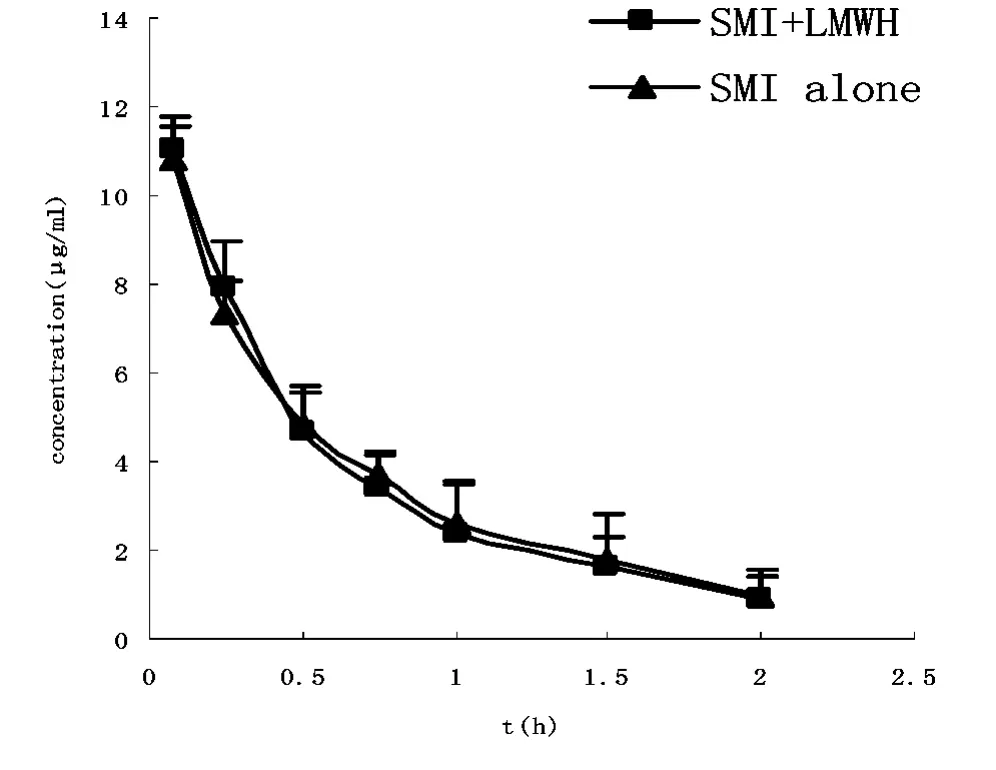
图3 单用及联用低分子肝素钙后人参皂苷Re在大鼠体内的血浆药-时曲线(n=6,)
表2 联合低分子肝素钙用药后人参皂苷Re在大鼠体内的药动学参数(n=6,)

表2 联合低分子肝素钙用药后人参皂苷Re在大鼠体内的药动学参数(n=6,)
Parameter SMI SMIwith LMWH Ke(h-1)1.491±0.081 1.489±0.210 CL(mL/h) 1.092±0.022 1.074±0.097 t1/2(h) 0.466±0.025 0.473±0.069 MRT(h) 0.924±0.005 0.928±0.013 AUC(0-144)(μg·h/mL) 7.622±0.131 7.940±0.706 AUC(0-∞)(μg·h/mL)8.245±0.164 8.558±0.707
2.7.3 联合用药对人参皂苷Rb1在大鼠体内药动学的影响
单独及联合低分子肝素钙给药后人参皂苷Rb1的血药浓度-时间曲线(图4),相关药动学参数见表3。参麦注射液联用低分子肝素钙后人参皂苷Rb1血药浓度显著升高(P<0.01)。人参皂苷Rb1的Ke降低,MRT延长,CL降低,t1/2延长,AUC(0-144)和AUC(0-∞)均显著升高(P<0.01)。
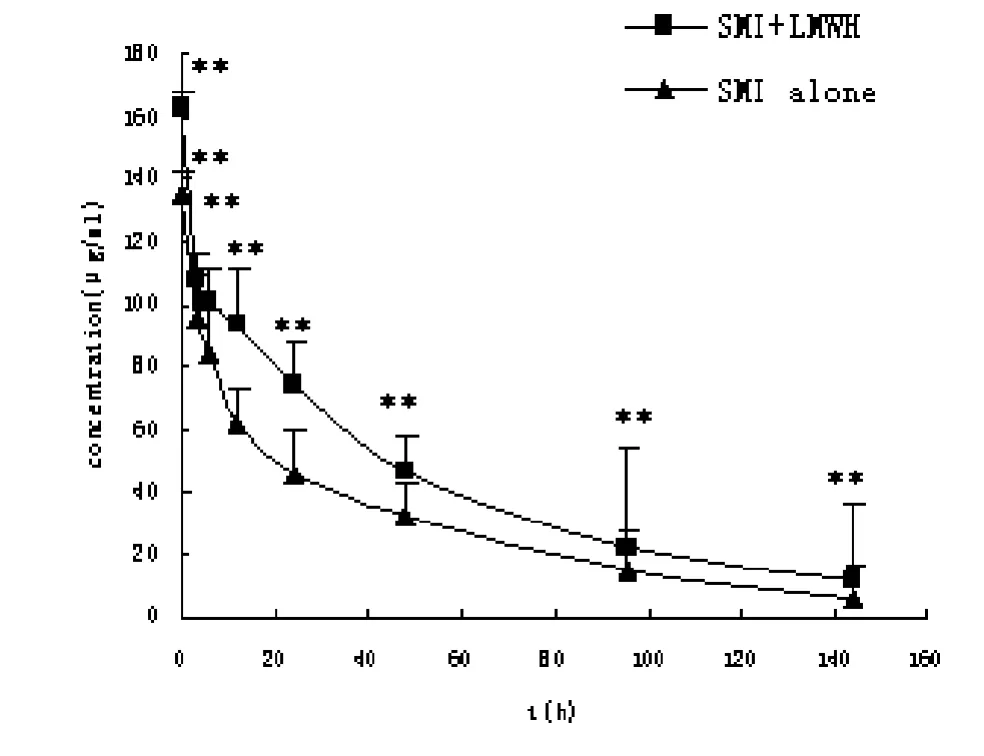
图4 单用及联用低分子肝素钙后人参皂苷Rb1在大鼠体内的血浆药-时曲线(n=6,)
表3 联合低分子肝素钙用药后人参皂苷Rb1在大鼠体内的药动学参数(n=6,)
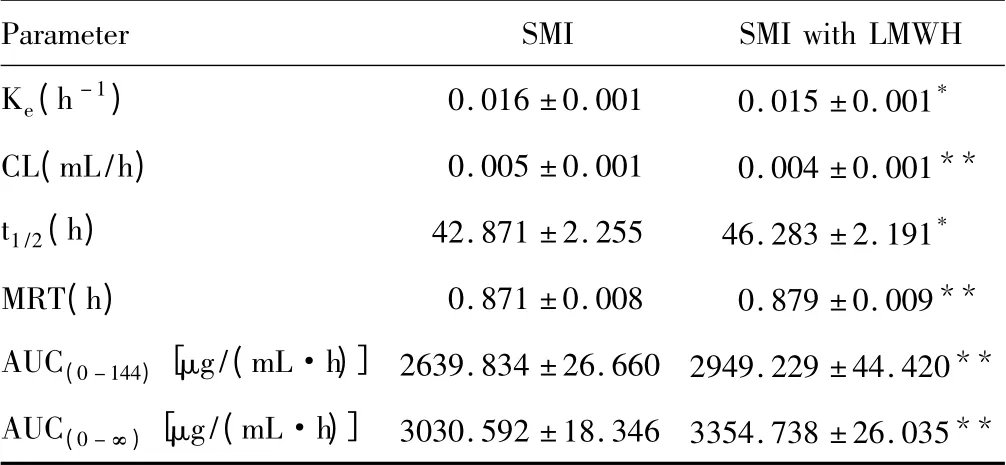
表3 联合低分子肝素钙用药后人参皂苷Rb1在大鼠体内的药动学参数(n=6,)
注:与单独给药组相比,*P<0.05,**P<0.01。
Parameter SMI SMIwith LMWH Ke(h-1) 0.016±0.001 0.015±0.001*CL(mL/h) 0.005±0.001 0.004±0.001**t1/2(h) 42.871±2.255 46.283±2.191*MRT(h) 0.871±0.008 0.879±0.009**AUC(0-144)[μg/(mL·h)]2639.834±26.660 2949.229±44.420**AUC(0-∞)[μg/(mL·h)]3030.592±18.346 3354.738±26.035**
3 讨论
本实验通过研究低分子肝素钙对参麦注射液在大鼠体内过程的影响,从药动学角度探讨中西药联合使用时西药对中药体内过程的影响。与低分子肝素钙联合用药后,人参皂苷Rg1和人参皂苷Rb1的血药浓度均显著升高,且显著影响了其MRT、CL、AUC(0-144)、AUC(0-∞)等药动学参数。据报道参麦注射液与低分子肝素钙联用对不稳定性心绞痛、肺源性心脏病心力衰竭等心血管疾病产生了较好的治疗效果[10-14]。可能与低分子肝素钙明显增加了人参皂苷Rg1和Rb1在大鼠体内的血药浓度,延长药物在体内停留时间,降低其清除率,提高药物体内含量,增强了人参皂苷Rg1和Rb1对心血管的有关药理作用[15],从而药物联用后药效增强。
本研究建立了同时测定大鼠血浆中人参皂苷Rg1、Re、Rb1的HPLC法,经方法学考察表明,本测定方法线性关系良好,样品测定不受内源性物质干扰。特异性、灵敏度、精密度、回收率、稳定性均符合生物样品分析方法指导原则要求,本方法可满足对人参皂苷Rg1、Re、Rb1的药动学进行研究的检测方法要求。首次探明低分子肝素钙对参麦注射液体内药动学的影响,从药动学角度验证了临床上药物合用疗效增加的结果,为临床上中西药更广泛更合理的联用奠定坚实的理论基础,使中西药联用发挥更可靠更有效的治疗效果。
[1]Junhua Zhang,Hongcai Shang,Wenke Zheng,et al.Systematic review on the compatibility of Shuanghuanglian injection combined with western medical injections[J].Journal of Evidence-Based Medicine,2010,3(1):27-36.
[2]Shi S,Klotz U.Drug interactions with herbal medicines[J].Clin Pharmacokinet,2012,51(2):77-104.
[3]运乃茹.参麦注射液药理及临床研究进展[J].河北中医,2011,33(8):1253-1255.
[4]吕伍文.参麦注射液治疗冠心病稳定型心绞痛70例疗效观察[J].中医药信息,2011,28(1):68-69.
[5]孙静,张茗.参麦注射液治疗慢性充血性心力衰竭50例[J].中医药信息,2005,22(4):50-51.
[6]Angeloa Izzo,Edzard Ernst.Interactiona between herbal medicines and prescribed drugs[J].Drugs,2001,61(15):2163.
[7]王荣田,王芝兰.关于中西医结合的几点思考[J].中医药信息,2004,21(6):1-3.
[8]Adriane Fugh-Berman.Herb-drug interaction[J].The Lancet,2000,355(2):1341.
[9]黄震洲,张旭.中西医结合治疗肺癌的研究进展[J].中医药信息,2012,29(3):129-132.
[10]马强,朱建俊.低分子肝素钙联合参麦注射液治疗慢性肺源性心脏病心力衰竭疗效观察[J].现代中西医结合杂志,2007,16(13):1758-1759.
[11]周学华,姚春杨.参麦注射液联合缬沙坦治疗慢性肾衰竭维持性血透并心力衰竭疗效观察[J].海峡药学,2010,22(12):144-145.
[12]蒋天如.参麦注射液联合纳洛酮治疗低血容量休克临床观察[J].东南国防医药,2005,7(5):364.
[13]王师菡,刘莉,尤延军.参麦注射液联合可达龙治疗心房纤颤临床观察[J].中医药信息,2004,21(1):19-20.
[14]文兰淑.低分子肝素联合参麦注射液治疗不稳定性心绞痛64例的疗效观察[J].中国实用医药,2010,5(30):138.
[15]贾继明,王宗权,吴立军,等.人身皂苷Rb1的药理活性研究进展[J].中国中药杂志,2008,33(12):1371-1377.
