大黄鱼cyp19a/b基因的克隆与表达分析
2015-03-09张子平谢芳靖蔡明夷王艺磊
陈 芸, 周 鹏, 张子平, 谢芳靖, 蔡明夷,王艺磊
(集美大学水产学院,福建 厦门 361021)
大黄鱼cyp19a/b基因的克隆与表达分析
陈芸, 周鹏, 张子平, 谢芳靖, 蔡明夷,王艺磊
(集美大学水产学院,福建 厦门 361021)
[摘要]克隆得到了调节雌雄激素平衡的大黄鱼cyp19a/b基因,cyp19a基因cDNA全长1805 bp(NCBI登录号:FJ800566),其中开放阅读框1557 bp,编码518个氨基酸;cyp19b基因cDNA全长2268 bp(NCBI登录号:FJ800567),其中开放阅读框1503 bp,编码500个氨基酸.荧光定量PCR分析显示cyp19a基因在性腺中有明显的表达,且在卵巢中的表达量极显著且高于精巢;在肌肉、脑、肝脏、肾脏、脾脏等组织器官中基本不表达.而cyp19b基因在脑、脾脏和肝脏中有较高表达,在性腺和其他器官中基本不表达.
[关键词]cyp19a/b基因;芳香化酶;性腺;表达差异
0引言
大黄鱼(Larimichthys crocea)是我国重要的海水养殖鱼类之一,在福建省的养殖规模和产量巨大.但是目前大黄鱼每年的产量和质量不稳定,主要是因为其抗病力较差、性成熟偏早等问题困扰养殖产业,极大影响了种鱼的种质和成鱼的质量.有研究表明,大黄鱼体长生长速度随年龄增大而递减并逐渐趋于零,性成熟过程中的体长生长速度显著降低[1].而在人工养殖大黄鱼中,大黄鱼体重增长速度以2龄鱼生长最快,1龄鱼一般50~100 g,2龄则可达300~500 g.因此人工养殖大黄鱼以养殖1~2年为最佳养殖期[2].而目前人工养殖大黄鱼的性成熟年龄也在1~2龄间,生长期与大黄鱼性成熟期的重叠在一定程度上可能会影响大黄鱼的体重增长.因此,研究大黄鱼性腺发育及性成熟的分子机制,有助于在生产实践中筛选出具有优良性状的大黄鱼.
芳香化酶P450在脊椎动物的性激素形成中有重要作用.雄激素和雌激素在体内相关酶的作用下可相互转化,两者的平衡直接影响动物性腺的正常发育.由cyp19基因编码的芳香化酶p450是雄激素转化生成雌激素的主要限速酶,是维持上述平衡的关键因子[3].在大部分硬骨鱼类中存在两种芳香化酶,一种是由cyp19a基因编码的性腺型芳香化酶,该基因主要在卵子的类固醇生成鞘和颗粒细胞层表达;另一种是由cyp19b基因编码的脑型芳香化酶,该基因主要在脑中表达[3].这两种酶都可以使雄激素睾酮转化成雌激素17b-雌二醇,内源性导致性别逆转[3],因此推测cyp19基因与鱼类的性别分化有关[3].研究发现,在黄颡鱼中cyp19a基因主要在卵巢中表达[4];在日本比目鱼中的研究表明芳香化酶的低水平表达是精巢发育所必需的[5-6].用芳香化酶抑制剂可诱导鱼类发生性逆转,主要是因为该抑制剂抑制了cyp19基因的表达,破坏了雄激素向雌激素的转化,导致雌激素量减少[5-6].目前,相关研究在大黄鱼中还未见报道.
本研究拟克隆大黄鱼的cyp19a/b基因,并分析它们在大黄鱼不同组织中的表达,研究它们在大黄鱼性腺发育及成熟中可能具有的功能奠定基础.
1材料与方法
1.1 实验动物
实验大黄鱼体重500 g左右.取精巢、卵巢、肌肉、端脑、中脑、延脑、下丘脑、肝脏、肾脏、脾脏、前肾等组织,提取总RNA备用.
1.2 总RNA的抽提及基因全长的获取
各组织总RNA的提取根据本实验室改良的RDP方法[7-8].根据已知的cyp19a/b 基因的核苷酸序列,设计正反向引物,扩增获得cDNA片段,并克隆测序.然后根据获得的基因片段设计3′和5′RACE所需特异引物GSP1和GSP2,用SMART-RACE法扩增获得3′和5′端片段.所有获得的cDNA片段均与pMD18-T质粒连接后转化成大肠杆菌JM109感受态细胞,并筛选阳性克隆测序.所有自行设计的引物(见表1)合成及序列测序均由上海捷瑞生物工程有限公司完成.
1.3 目的基因的生物信息学分析
本文中核苷酸、氨基酸序列的同源性比对在http://blast.ncbi.nlm.nih.gov/Blast.cgi上进行;蛋白质分子量和等电点预测采用pl/Mw tool;信号肽查找在http://www.cbs.dtu.dk/services/SignalP/进行;跨膜区查找采用TMHMM-2.0;磷酸化位点查找采用NetPhos2.0 Server;糖基化位点查找采用NetNGlyc 1.0 Serve;氨基酸结构域分析采用InterProScan;系统发育树构建采用MEGA4.
1.4 荧光定量PCR分析目的基因在各器官的表达
根据拼接的cyp19a/b的全长cDNA序列,设计cyp19a、cyp19b、β-actin基因的荧光定量PCR引物(见表1).以cDNA第一条链为模板,β-actin为内标基因,各基因特异性引物和SYBR Green进行定量PCR扩增.每个反应的体系如下:10 μL SYBR Green Real time PCR Master Mix,0.5 μL正向、反向基因特异引物,1 μL cDNA第一条链及8 μL无RNase水.反应条件为:95 ℃变性10 min后,进行如下40个循环:95 ℃变性15 s,60 ℃退火1 min.雌雄大黄鱼的每种器官各4个样品,每个样品进行3次重复.用SPSS 15.0统计软件对样本进行one way ANOVA方差分析,以P<0.05为显著水平,P<0.01为极显著水平.
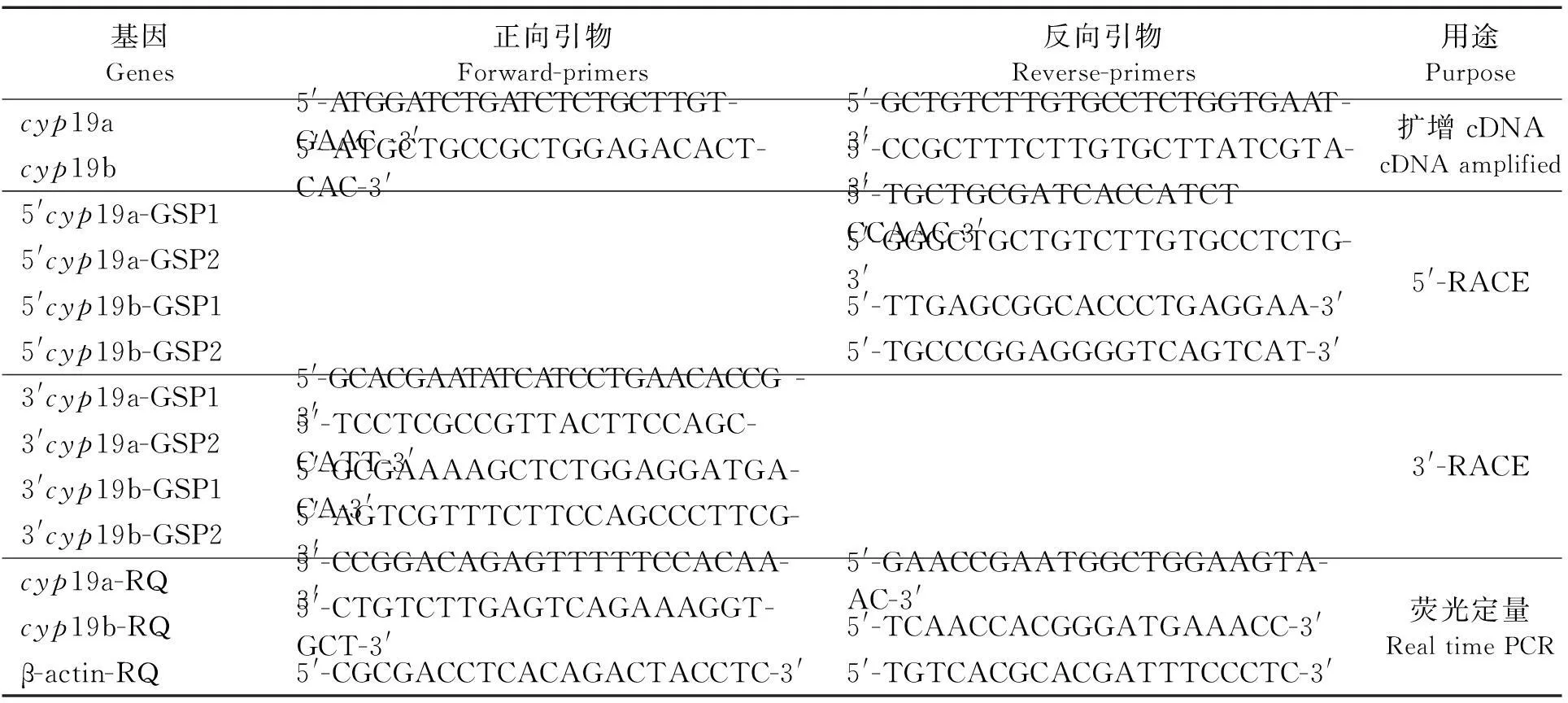
表1 实验中所用的引物
2结果与分析
2.1 cyp19a基因序列特征
cyp19a基因cDNA序列全长1805 bp(见图1,NCBI登录号:FJ800566),其中3′UTR(去除polyA部分)长229 bp,开放阅读框(Open reading frame,ORF)长1557 bp.cyp19a cDNA可编码518个氨基酸,预测其分子质量约为58.7 ku,等电点约为6.68.该序列在T59-D60有一个信号肽酶切位点,在V32-A55和S67-A90位置分别具有一个由23个氨基酸组成的跨膜区.磷酸化位点(Phosphorylation sites)分析显示有9个丝氨酸(Ser)磷酸化位点,3个苏氨酸(Thr)磷酸化位点和3个酪氨酸(Tyr)磷酸化位点;糖基化位点(N-x-S/T)在N145区域.进一步用InterProScan分析发现cyp19a有一个半胱氨酸铁-血红素配体特征区序列,即[FW]-[SGNH]-x--{F}-[RKHPT]-{P}-C-[LIVMFAP]-[GAD] (此序列位于442-451氨基酸之间,为FGSGPRSCVG),该区是对芳香化酶活性起关键作用的保守区Ⅲ(血红素结合区).此外,对芳香化酶活性起关键作用的保守区Ⅰ(Ⅰ-螺旋区)、Ⅱ(P450arom特异保守区)也被发现.
2.2 cyp19b基因序列特征
cyp19b基因cDNA序列全长2268bp(NCBI:FJ800567) (见图2).其中3′UTR(去除polyA部分)长748bp;ORF长1503bp.
cyp19bcDNA编码500个氨基酸,预测其分子质量约为56.7ku,等电点约为7.12.该序列在S36-R37有一个信号肽酶切位点.在Q10-F32和G45-G67区域分别有一个由22个氨基酸组成的跨膜区.磷酸化位点预测显示有7个丝氨酸磷酸化位点,4个苏氨酸磷酸化位点和3个酪氨磷酸化位点;糖基化位点预测显示有两个位点分别是在N9和N39.与cyp19a类似,与芳香化酶活性有关的保守区I、II、III(位于426-435氨基酸之间,为FGCGPCSCVG)均被发现.
2.3 cyp19a同源性分析
本文选作同源性比对的GenBank上已注册的cyp19a氨基酸序列有:
大黄鱼(Larimichthyscrocea)ACO35041.1、真鲷(Pagrusmajor)BAB82524.1
点带石斑鱼(Epinepheluscoioides)AAR97601.1、平鲷(Rhabdosargussarba)ABC70869.1
金头鲷(Sparusaurata)AAL27699.1、细须石首鱼(Micropogoniasundulatus)ABA26927.1
日本拟隆头鱼(Pseudolabrusjaponicus)ABB96485.1、鲻鱼(Mugilcephalus)AAW72732.1


花溪鳉(Kryptolebiasmarmoratus)ABC68614.1、鳕鱼(Gadusmorhua)ADM15036.1
青鳉(Oryziaslatipes)Q92087.1、绿鳍马面鲀(Thamnaconusseptentrionalis)AFM35729.1
虹鳟(Oncorhynchusmykiss)1806325A、细棘海猪鱼(Halichoerestenuispinis)AAR37048.1
泥鳅(Misgurnusanguillicaudatus)BAJ19136.1、金鱼(Carassiusauratus)AAC14013.1
鲤鱼(Cyprinuscarpio)ACB13197.1、斑马鱼(Daniorerio)AAK00643.1

鸡(Gallusgallus)NP_001001761.1、大鼠(Rattusnorvegicus)NP_058781.2
人(Homosapiens)P11511.3.
结果表明,大黄鱼cyp19a的氨基酸序列与其他鱼类的氨基酸序列同源性较高.其与细须石首鱼的同源性为96%;与点带石斑鱼的同源性为95%;与真鲷、斑马鱼、金鱼的同源性分别是94%、80%和80%;与非洲爪蟾和人类的同源性分别是74%和49%.
2.4 cyp19b基因同源性分析
同源性比对选用GenBank上已注册的cyp19b的氨基酸序列有:
大黄鱼ACO35042.1、平鲷ABC70868.1、日本拟隆头鱼ABB96486.1、鲤鱼ACB13198.1
细棘海猪鱼AAR37047.1、大西洋庸鲽(Hippoglossushippoglossus)Q4VC53
三星攀鲈(Trichogastertrichopterus)ABR66863.1、鲻鱼AAW72730.1、金鱼AAB39408.1

底鳉(Fundulusheteroclitus)AAS76199.1、花溪鳉ABC68613.1、斑马鱼AAV41033.1
虹鳟鱼cyp19b-ICAC84574.1、虹鳟鱼cyp19b-IICAC84575.1、南方鲇AAP83132.1
鸡AAA48738.1、家鼠(Mus musculus)BAA00551.1、人 :P11511.3.
结果表明,大黄鱼cyp19b氨基酸序列与平鲷同源性最高,为86%;与大西洋鳙鲽、鲻鱼、斑马鱼、金鱼的同源性分别是85%、81%、65%和65%;与家鼠、人的同源性分别只有51%、17%.
2.5 cyp19a/b基因在大黄鱼各器官中的表达
大黄鱼cyp19a/b基因在各器官的表达情况见图3、图4.

经统计学分析,cyp19a在卵巢中表达量最高,显著高于精巢.该基因在雌雄肝脏、肌肉、端脑,以及雌性脾脏中表达量比较低,而在其他各器官基本不表达.大黄鱼cyp19b在中脑、端脑、下丘脑、脾脏和肝脏中有较高表达量,在性腺和其他器官中基本不表达.
2.6 cyp19a/b基因系统发育分析
采用MEGA4.0软件,以邻位相连法构建系统进化树(见图5).


3讨论
在哺乳动物中只有一种芳香化酶,该酶通过中枢神经系统调节作用,影响动物的神经内分泌、繁殖及性行为[9-10],并参与调控哺乳动物性腺的分化[11].在硬骨鱼类中,目前发现金鱼由一个cyp19基因编码脑芳香化酶;而斑马鱼由两个基因cyp19(cyp19a/b)编码芳香化酶[12];虹鳟中则发现有两种类型的P450aromB,可能由一个或两个cyp19基因编码[13].部分鱼类中cyp19a基因在卵子发生期间的卵黄卵泡中有表达,这与鱼类卵巢发育期间对雌激素的需求相一致;而在脑部,雄激素芳香化变成雌激素是调节生理和行为的一个基本步骤,此时cyp19b基因的正常表达至关重要[14-15].
Chiang[16]研究认为斑马鱼cyp19a基因在卵黄发生期间主要在滤泡中表达,其功能可能是参与卵巢中卵泡形成过程的卵黄发生,cyp19b主要在丘脑下部、端脑、嗅球中表达,对神经系统的功能、性行为、性别决定产生影响.本研究中大黄鱼cyp19a基因主要在性腺中表达,在脑部基本没有表达(见图2);cyp19b主要在脑部(中脑、端脑、下丘脑)、脾脏、肝脏表达,在性腺中基本没有表达(见图3),这与斑马鱼、金鱼的研究结果相似[16-17].对虹鳟[14]、石斑鱼[18]的研究表明cyp19b主要在脑和垂体中表达,有明显的雌、雄差异;cyp19a主要在性腺和垂体表达,且性腺表达量远高于垂体,无雌雄差异.另外不同鱼类的cyp19a/b在脾脏、肾脏、肝脏、腮中有时也有表达,但可能研究鱼的种类、年龄、所处发育状态及研究方法不同,表达模式各有不同[11,14,18-19].但一致的是cyp19a和cyp19b在性腺和脑的表达存在明显的组织特异性[20].斑马鱼中有两种芳香化酶氨基酸具有60%的同源性,编码它们的两个基因是直系同源基因,由同一祖先基因复制而产生[16].根据复制—退化—互补模型[21],如果基因被相互退化的基本的组织特异性调控因子所调节,两个复制的基因的功能都会被保留下来.因此,脑型的cyp19b不能补偿卵巢型cyp19a的功能,雌性如果缺乏卵巢型cyp19a就会不育,这在人类和小鼠中已经被证实[22-23].本研究中大黄鱼两种芳香化酶的氨基酸同源性达63%,进一步同源比较发现,大黄鱼芳香化酶氨基酸序列与鲈形目鱼类相似性高达85%以上,与鲤形目、鲶形目相似性高达65%以上(见图4).这表明大黄鱼两种芳香化酶基因在进化上保守性较高,但在功能上却又各自独立,不可互相替代.cyp19a 和cyp19b表达模式的不同表明它们具有不同的生理功能,也说明在进化过程中这两个基因在两种不同组织中的重要性.
[参考文献]
[1]徐开达,刘子藩.东海区大黄鱼渔业资源及资源衰退原因分析[J].大连水产学院学报,2007,22(5):392-396.
[2]张彩兰,刘家富,李雅璀,等.福建省大黄鱼养殖现状分析与对策[J].上海水产大学学报,2002,11(1):77-83.
[3]VON HOFSTEN J,OLSSON P E.Zebrafish sex determination and differentiation:involvement of FTZ-F1 genes[J].Reproductive Biology and Endocrinology,2005,3(1):63-73.
[4]徐跑,俞菊华,唐永凯,等.黄颡鱼卵巢P-450arom基因的克隆及器官表达[J].中国水产科学,2005,12(5):541-548.
[5]KITANO T,TAKAMUNE K,KOBAYASHI T,et al.Suppression of P450 aromatase gene expression in sex reversed males produced by rearing genetically female larvae at a high water temperature during a period of sex differentiation in the Japanese flounder(Paralichthys olivaceus)[J].Journal of Molecular Endocrinology,1999,23(2):167-176.
[6]KITANO T,TAKAMUNE K,NAGAHAMA Y,et al.Aromatase inhibitor and 17alpha methyltestost- erone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder(Paralichthys olivaceus)[J].Molecular Reproduction and Development,2000,56(1):1-5.
[7]CHOMCZYNSKI P.A reagent for the single-step simultaneous isolation of RNA,DNA and proteins from cell and tissue samples[J].Biotechniques,1993,15(3):532-537.
[8]ZHANG Z P,SHEN B L,WANG Y L,et al. Differential expression of proliferating cell nuclear antigen in the developing ovary and testis of penaeid shrimp Marsupenaeus japonicus[J].DNA and Cell Biology,2010,29(4):163-170.
[9]SIMPSON E R,MAHENDROO M S, MEANS G D,et al.Aromatase cytochrome P450, the enzyme responsible for estrogen biosynthesis[J].Endocrine reviews,1994,15(3):342-355.
[10]LEPHART E D.A review of brain aromatase cytochrome P450[J].Brain Research Reviews,1996,22(1):1-26.
[11]PIFERRER F,ZANUY S,CARRILLO M,et al.Brief treatment with an aromatase inhibitor during sex differentiation causes chromosomally female salmon to develop as normal,functional males[J].Journal of experimental zoology,1994,270(3):255-262.
[12]CALLARD G V,TCHOUDAKOVA A V,KISHIDA M,et al. Differential tissue distribution,developmental programming,estrogen regulation and promoter characteristics ofcyp19 genes in teleost fish[J].Journal of Steroid Biochemistry and Molecular Biology,2001, 79(1/5):305-314.
[13]VALLE L D,RAMINA A,VIANELLO S,et al.Cloning of two mRNA variants of brain aromatase cytochrome P450 in rainbow trout(Oncorhynchus mykissWalbaum)[J].TheJournalofSteroidBiochemistryandMolecularBiology,2002,82(1):19-32.
[14]TANAKA M,TELECKY T M,FUKADA S,et al.Cloning and sequence analysis of the cDNA encoding P450 aromatase (P450arom) from a rainbow trout(Oncorhynchus mykiss)ovary;relationship between the amount of P450arom mRNA and the production of oestradiol-17β in the ovary[J].Journal of Molecular Endocrinology,1992,8(1):53-61.
[15]TANAKA M,FUKADA S,MATSUYAMA M,et al.Structure and promoter analysis of the cytochrome P450 aromatase gene of the teleost fish,medaka(Oryzias latipes)[J].The Journal of Biochemistry,1995,117(4):719-725.
[16]CHIANG E F,YAN Y L,GUIGUEN Y,et al.Twocyp19 (P450 aromatase) genes on duplicated zebrafish chromosomes are expressed in ovary or brain[J].Molecular Biology and Evolution,2001,18(4):542-550.
[17]GELINAS D,PITOC G A,CALLARD G V.Isolation of a goldfish brain cytochrome P450 aromatase cDNA:mRNA expression during the seasonal cycle and after steroid treatment[J].Molecular and Cellular Endocrinology,1998,138(1/2):81-93.
[18]李广丽,刘晓春,张勇,等.赤点石斑鱼两种芳香化酶 cDNA 的克隆及其表达的器官特异性[J].动物学报,2004,50(5):791-799.
[19]KISHIDA M,CALLARD G V.Distinct cytochrome P450 aromatase isoforms in zebrafish(Danio rerio) brain and ovary are differentially programmed and estrogen regulated during early development[J].Endocrinology,2001,142(2):740-750.
[20]TCHOUDAKOVA A,CALLARD G V.Identification of multiplecyp19 genes encoding different cytochrome P450 Aromatase isozymes in brain and ovary[J].Endocrinology,1998,139(4):2179-2189.
[21]FORCE A,LYNCH M,PICKETT F B,et al.Preservation of duplicate genes by complementary,degenerative mutations[J].Genetics,1999,151(4):1531-1545.
[22]SHOZU M,AKASOFU K,HARADA T,et al.A new cause of female pseudohermaphroditism:placental aromatase deficiency[J].The Journal of Clinical Endocrinology & Metabolism,1991,72(3):560-566.
[23]FISHER C R,GRAVES K H,PARLOW A F,et al.Characterization of mice deficient in aromatase(arko) because of targeted disruption of thecyp19 gene[J].Proceedings of the National Academy of Sciences of the United States of America(PNAS),1998,95(2):6965-6970.
(责任编辑朱雪莲英文审校张子平)
Cloning and Expression ofcyp19a/b Gene inLarge Yellow Croaker Larimichthys croceaCHEN Yun, ZHOU Peng, ZHANG Zi-ping,XIE Fang-jing, CAI Ming-yi, WANG Yi-lei
(Fisheries College,Jimei University,Xiamen 361021,China)
Abstract:Gonad development is dependent on balance between estrogen and androgen,which is regulated by expression of the cyp19 gene and its product aromatase cytochrome P450.Two cyp19 genes named as cyp19a and cyp19b have been identified in fish. In this study,both the cyp19a and cyp19b have been cloned from Larimichthys crocea.The cDNA of cyp19a gene is 1805bp in length (NCBI:FJ800566),including the 1557bp open reading frame (ORF) which codes a polypeptide of 518 amino-acid.The cDNA of cyp19b gene is 2268bp in length (NCBI:FJ800567),including the 1503bp ORF which codes a polypeptide of 500 amino-acid.Real-time PCR results show that the expression level of cyp19a in ovary is significantly higher than in testis.And the expression level of cyp19a in gonad is higher than other tissues.The expression level of cyp19b gene in brain,spleen and liver is higher than in gonad,muscle,and kidney.
Key words:cyp19a/b gene;aromatase;gonad;gene expression
[文献标志码]A
[中图分类号]Q 343.1+5
[文章编号]1007-7405(2015)02-0081-09
[作者简介]陈芸(1978—),女,讲师,博士,主要从事分子遗传学研究.通讯作者:王艺磊(1963—),女,教授,博士,E-mail:ylwang@jmu.edu.cn.
[基金项目]国家自然科学基金资助项目(31272653);福建省自然科学基金资助项目(2011J05082);集美大学创新团队基金资助项目(2010A001)
[收稿日期]2014-03-10[修回日期]2014-06-26
