犬副流感病毒CC-14 株全基因组测序及分析
2015-03-09高菽蔓靳红亮张守峰扈荣良
高菽蔓,靳红亮,2,张守峰,刘 晔,扈荣良*
(1.军事医学科学院 军事兽医研究所,吉林 长春 130122;2.吉林农业大学 动物科学技术学院,吉林 长春 130118)
犬副流感病毒(Canine parainfluenza virus,CPIV)又称副流感病毒5 型(Parainfluenza Virus 5,PIV5),为单股负链不分节段RNA 病毒,属于副黏病毒科(Paramyxoviridae),副黏病毒亚科(Paramyxovirinae),腮腺炎病毒属(Rubulavirus),与同属的猴病毒5 型(Simian virus 5,SV5)[1]、人SV5 分离株及人副流感病毒II 型(Human paramyxovirus type 2,hPIV2)抗原性密切相关,性质相似[2]。各年龄段的犬均可以感染,是犬窝咳的主要病原之一[3],幼犬对该病毒最易感,并且发病急,传播快,病毒呈世界性分布,猫、仓鼠、豚鼠、猪均有感染报道[4]。
随着反向遗传学技术的发展,众多病毒基因组成为具有巨大开发潜力的病毒活载体工具。研究表明,PIV5 极具作为开发新型疫苗的候选病毒载体[5]。PIV5 基因组大小为15 246 nt,从3' 端到5' 端编码产生7~8 种常见结构蛋白,包括核衣壳蛋白(NP)、V 蛋白(V)、磷酸化蛋白(P)、膜基质蛋白(M)、融合蛋白(F)、小疏水性蛋白(SH,该蛋白在某些副流感病毒5 型中不存在[6])、血凝素-神经氨酸酶(HN)、聚合酶蛋白(L),其中NP 基因高度保守[7]。
本研究对本实验室保存的CPIV CC-14 株进行了全基因组的克隆、测序与NP 基因编码区序列分析,充实了我国PIV5 基因组数据信息,为以PIV5 为载体的相关研究奠定了基础。
1 材料和方法
1.1 主要实验材料 CPIV CC-14 株和MDCK 细胞均由军事兽医研究所流行病学实验室保存。Simply P 总RNA 提取试剂盒购自BioFlux 公司;胶回收试剂盒购自Axygen 公司;pMD18-T 载体购自TaKaRa公司。
1.2 引物设计及合成 参照SV5 全基因组序列,设计覆盖CPIV CC-14 株基因组全长的14 对引物(表1),引物由金唯智生物技术有限公司合成。

表1 CPIV 全基因组克隆引物Table 1 The primers of complete genome of CPIV
1.3 病毒全基因组的扩增及克隆 按照Simply P总RNA 提取试剂盒说明书方法提取CPIV 细胞毒的总RNA,以各片段上游引物进行反转录制备cDNA,以其为模板进行各基因片段的扩增。扩增产物分别克隆于pMD18-T 载体中,构建14 个重组质粒。
1.4 DNA 序列的测定和分析 重组质粒由吉林省库美生物科技有限公司进行测序,测序结果与Gen-Bank 中登录的其他PIV5 序列进行比对分析,利用DNAStar 软件完成序列拼接并基于NP 基因编码区核苷酸序列及其推导氨基酸序列进行同源比对分析,采用MEGA 5.2 软件绘制系统发生进化树进行系统发生分析。
2 结果与讨论
2.1 CPIV CC-14 株全基因组克隆及序列分析 采用设计的14 对引物PCR 扩增CPIV 各片段,并分别克隆于pMD18-T 载体中,构建14 个重组质粒。对其进行测序、拼接及分析,结果显示CPIV CC-14株全基因组序列长度为15 246 nt(KP893891)。这是国内首次完成对CPIV 全基因组的克隆测序。
CPIV CC-14 株基因组具有PIV5 典型组成结构,包括3' 引导序列(Leader sequence,即3'-UTR)、编码7 个结构蛋白(NP、V、M、F、HN、L)的6 段基因(表2)以及5' 末端序列(Tailer sequence,即5'-UTR)。其中3'-UTR 长55 bp,位于1 nt~55 nt,5'-UTR 长31 bp,位于15 216 nt~15 246 nt。该病毒每个基因均具有保守的转录起始信号和转录终止信号序列,这些保守序列参与mRNA 的起始和终止,是重要的转录调控信号。各基因间均由基因间隔序列隔开,间隔序列较为保守,并且不构成mRNA 成分。
据报道,SH 蛋白能够抑制TNF-α 介导的细胞凋亡过程[8],某些犬源和猪源的PIV5 SH 基因发生变异,无法编码SH 基因,即不能产生小疏水蛋白,因此该蛋白对于病毒感染犬和猪是非必需的[6]。本研究对CPIV CC-14 株进行全基因组测序,结果显示该病毒不编码SH 基因,该基因的缺失是否影响病毒与宿主之间相互作用等还有待进一步研究。
CPIV CC-14 株的NP 基因长度为1 530 nt,位于全基因组的152 nt~1 681 nt,编码NP 蛋白,为病毒核糖核蛋白体(Ribonucleoproteins,RNPs)的组成部分之一。有研究表明,副黏病毒科N 蛋白含有一个高度保守的中间区域F-X4-Y-X3-φ-S-φ-A-M,其中X 表示任意氨基酸残基,φ 表示芳香族氨基酸,该区域与N-N 自我组装以及N-RNA 相互作用有关。本研究CPIV CC-14 株恰好具有323FAAANYPLLY SYAM336氨基酸序列特征,与其相符合。
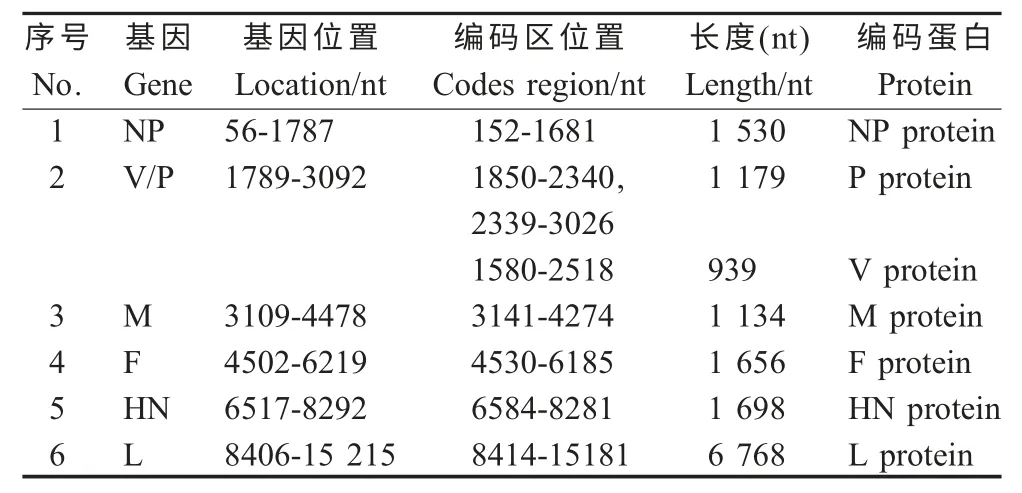
表2 CPIV CC-14 株基因组编码蛋白Table 2 The encoding proteins of CPIV strain CC-14
2.2 基于NP 基因系统发生分析 本研究将CPIV CC-14 株与GenBank 中登录的17 株PIV5 NP 基因编码区序列进行同源比对和系统发生分析。结果显示,CPIV CC-14 株与GenBank 登录的其他17 株PIV5 参考病毒株NP 基因核苷酸同源性为97.25 %~99.80 %,其中与英国猪源SER 株及长春牛源PV5-BC14 株同源性相同且最高,为99.80 %;与韩国犬源D277 株核苷酸同源性最低,为97.25 %。氨基酸同源性比较结果显示,CPIV CC-14 株与17 株PIV5 参考病毒株NP 基因氨基酸同源性为98.62 %~99.80 %,与长春牛源PV5-BC14、美国猴源SV5、英国恒河猴源W3A、英国犬源CPI+及CPI-同源性相同且最高,为99.80 %;与韩国2 株犬源PIV5(D277 和08-1990)氨基酸同源性最低,为98.62 %。
利用MEGA 5.2 软件基于NP 基因构建并绘制系统发生进化树,分析结果显示,CPIV CC-14 株与长春牛源PV5-BC14 株同属一个分支,亲缘关系最近;与韩国2 株犬源PIV5(D277 和08-1990)亲缘关系最远(图1)。
本研究单独对NP 基因进行RT-PCR 扩增后,结果显示,不同批次间NP 基因扩增产物测序结果之间存在个别碱基突变,甚至提前出现终止密码子,造成个别氨基酸突变等,这些氨基酸突变是否影响病毒包装和复制等,还有待进一步研究。
本研究明确了CPIV CC-14 株的全基因背景,为以该病毒株为载体进行重组疫苗的研究奠定了基础。
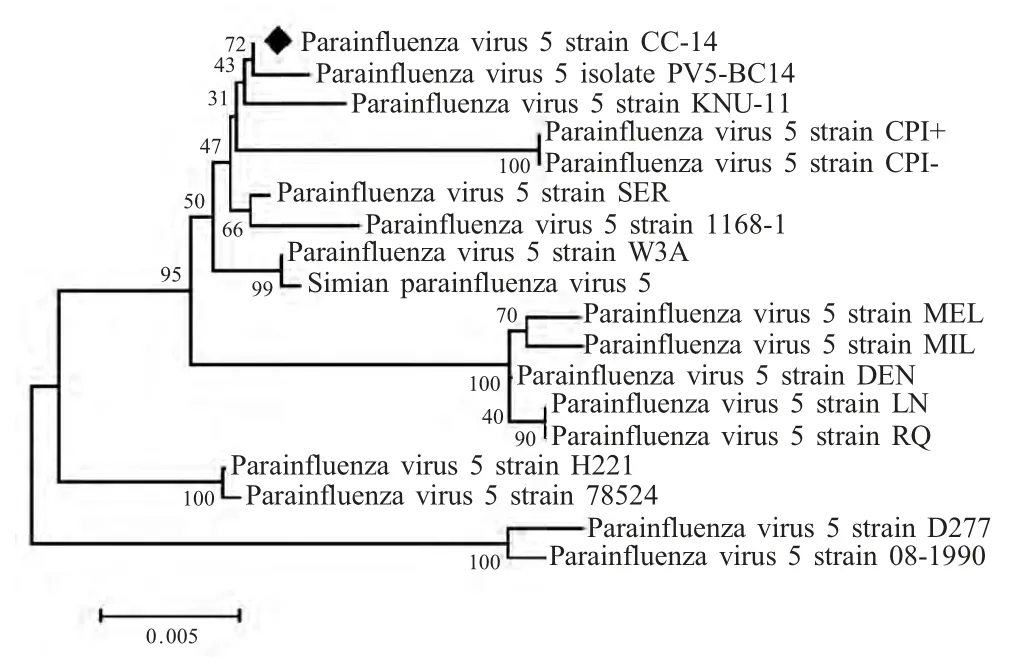
图1 基于PIV5 NP 基因的系统发生进化树Fig.1 Phylogenetic tree of NP gene of PIV5 constructed with Neighbor Joining method
[1]He B,Paterson R G,Ward C D,et al.Recovery of infectious SV5 from cloned DNA and expression of a foreign gene[J].Virology,1997,237(2):249-260.
[2]Southern J A,Young D F,Heaney F,et al.Identification of an epitope on the P and V proteins of simian virus 5 that distinguishes between two isolates with different biological characteristics[J].J Gen Virol,1991,72(Pt 7):1551-1557.
[3]McCandlish I A,Thompson H,Cornwell H J,et al.A study of dogs with kennel cough[J].Vet Rec,1978,102(14):293-301.
[4]Chatziandreou N,Stock N,Young D,et al.Relationships and host range of human,canine,simian and porcine isolates of simian virus 5(parainfluenza virus 5)[J].J Gen Virol,2004,85(10):3007-3016.
[5]Tompkins S M,Lin Yuan,Leser G P,et al.Recombinant parainfluenza virus 5(PIV5)expressing the influenza A virus hemagglutinin provides immunity in mice to influenza A virus challenge[J].Virology,2007,362(1):139-150.
[6]师新川.牛副流感病毒3 型NM09 株反向遗传系统的建立[D].北京:中国农业科学院,2011.
[7]Lin Yuan,Bright A C,Rothermel T A,et al.Induction of apoptosis by paramyxovirus simian virus 5 lacking a small hydrophobic gene[J].J Virol,2003,77(6):3371-3383.
[8]Wilson R L,Fuentes S M.Function of small hydrophobic proteins of paramyxovirus[J].J Virol,2006,80(4):1700-1709.
