伪狂犬病毒人工感染小鼠模型的建立
2015-03-09臧素芳黄嘉妮胡守萍张交儿何希君
臧素芳,黄嘉妮,胡守萍,张 卓,张交儿,祝 瑶,何希君*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001;2.东北农业大学 动物医学学院,黑龙江 哈尔滨 150030)
伪狂犬病主要为生殖系统性及神经系统性疾病,通常对猫、犬、小鼠、家兔及新生仔猪等感染动物具有致命性。伪狂犬病毒(Pseudorabies virus,PRV)属于疱诊病毒科,为双链DNA 病毒,有包膜,其包膜蛋白可介导病毒的结合,内化,细胞相关扩散等,并且可以诱导宿主的保护性免疫反应。PRV 宿主呈世界性广泛分布,可以侵入宿主的主要器官引起伪狂犬病[1-3]。PRV 入侵仔猪及牛、羊、狗、啮齿类动物等非天然宿主后,可导致严重的瘙痒等症状以及造成高死亡率[4]。PRV 可以在感染部位附近的神经元内复制,并且可以从外周神经系统(PNS)迁移入中枢神经系统(CNS)。PRV 强毒株由PNS 迁移入CNS 可以通过顺行(从突触前到突触后神经元)或逆行(从突触后到突触前神经元)途径,而PRV 弱毒株只能通过逆行途径[4-5]。
PRV 进入宿主脑组织后,可以造成脑部病变,引起脑部先天免疫应答[6]。目前对于PRV 的研究主要集中在其移行、复制及包膜蛋白功能等方面,很少有关于PRV 感染后脑组织先天免疫细胞变化的研究。本实验主要建立PRV 感染小鼠引起脑部病变的模型,为进一步研究PRV 感染引起的小鼠先天免疫应答机制奠定基础。
1 材料和方法
1.1 主要实验材料 实验用PRV 强毒株由中国农业科学院哈尔滨兽医研究所王靖飞研究员提供;PRV-Bartha K61 疫苗株由本实验室保存。6 周龄~8周龄SPF 级BALB/c 小鼠购自辽宁长生生物技术有限公司。兔抗PRV 抗体(IgG)购自美国USBiological公司;HRP 标记山羊抗兔IgG(IgG-HRP)和DAB 显色试剂购自Sigma 公司。
1.2 小鼠感染模型的建立 病毒经PK15 细胞扩毒,并于96 孔培养板中测定病毒TCID50。取PRV强毒株1×105TCID50剂量经皮下注射接种猪、羊及小鼠,取疫苗株1×105TCID50剂量皮下接种小鼠,对比不同动物人工感染PRV 之后病变程度及强毒株、疫苗株接种小鼠后病变差异。之后分别取不同剂量强毒株及疫苗株经皮下注射或滴鼻人工感染小鼠,通过统计小鼠存活率及存活时间,筛选最佳感染剂量,最终建立最佳小鼠感染模型。
1.3 感染小鼠脑组织病理学观察 取人工感染动物脑组织经10 %甲醛溶液固定后,按常规包埋,制备石蜡切片,HE 染色后进行光学显微镜观察。
1.4 感染小鼠脑组织免疫组化染色 脑组织经石蜡切片后进行免疫组化染色。将组织切片进行脱蜡处理,以柠檬酸-柠檬酸钠缓冲液为高压缓冲液经高压进行抗原修复。组织冷却后经甲醇及0.3%H2O2增加组织通透性及去除内源性过氧化物酶。8 %脱脂乳进行抗原封闭,加兔抗PRV IgG 于4 ℃冰箱中过夜孵育。第2 d TBS 洗去残余一抗,加山羊抗兔IgG-HRP 进行孵育,之后于含H2O2的DAB 显色液中显色,进行光学显微镜观察。
2 结果
2.1 实验动物接种PRV 后脑组织病理学观察 各实验动物经人工感染PRV 后,出现程度不同的病理学变化。PRV 强毒株感染猪,其脑组织血管周围有少量炎性细胞浸润,小胶质细胞增殖(图1A),病变程度较轻;羊人工感染强毒株后,脑组织出现明显血管套现象,并且小胶质细胞大量增殖(图1B);小鼠接种强毒株后,脑组织内出现炎性浸润灶(图1C),而接种疫苗株后,其脑组织出现明显的血管套现象,小胶质细胞大量增殖(图1D)。试验结果显示除强毒株人工感染小鼠出现炎性浸润灶外,其他接种感染动物均出现不同程度的血管套现象及小胶质细胞增殖。

图1 不同实验动物接种PRV 强毒株、疫苗株后脑部HE 染色结果Fig.1 Histopathologic lesions in cerebral tissue of different animals inoculated by PRV virulent strain or vaccine strain
2.2 小鼠接种不同剂量PRV 强毒株后存活率检测以1×102TCID50~7.5×103TCID50不同剂量PRV 强毒株滴鼻接种小鼠,结果显示,1×102TCID50接种剂量下,小鼠未出现死亡;在2.5×103TCID50~7.5×103TCID50接种剂量间,小鼠出现死亡,并且随着感染时间增加,小鼠存活率差异明显,在人工感染后第4 d 存活率差异最明显(图2A)。表明按照上述不同剂量PRV 强毒株滴鼻接种小鼠其存活率存在明显差异。以不同剂量PRV 强毒株经皮下注射感染小鼠,结果显示,2.5×102TCID50~7.5×102TCID50接种剂量下小鼠未出现死亡;1×103TCID50接种剂量下小鼠出现一定的死亡,并且随着感染时间延长小鼠能保持50% 以上存活率;1×104TCID50~4.5×104TCID50接种剂量下,小鼠在感染后第3 d 出现死亡,第4 d全部死亡(图2B)。表明不同剂量强毒株经皮下注射感染小鼠其存活率也存在明显差异。PRV 强毒株人工感染小鼠后,其出现死亡时间早,病程短且存活率低,不适合后续实验研究。

图2 小鼠在PRV 强毒株不同感染剂量及感染方式下的存活率Fig.2 The mice survival rates of PRV virulent strain in different infection doses and routes
2.3 小鼠接种不同剂量PRV 疫苗株后存活率PRV 强毒株皮下接种和滴鼻感染小鼠比较表明,皮下接种后小鼠出现病变及其存活率更为稳定。所以疫苗株采用皮下接种途径感染小鼠。在6×104TCID50接种剂量下,小鼠存活率能够达到80 %以上,而在1×105TCID50~2.7×105TCID50接种剂量下,小鼠存活率能够达到50%以上,并且各剂量感染小鼠均在感染后6 d 出现死亡(图3)。1×104TCID50~7.5×104TCID50剂量滴鼻接种小鼠未出现死亡(结果未显示)。该结果显示,1×105TCID50剂量接种小鼠后,其存活率较高,高于60 %,并且具有一定程度的死亡率,适合做后续实验用接种剂量。
2.4 疫苗株感染小鼠6 d 后免疫组化染色 采用PRV 抗体进行免疫组化标记病毒粒子。结果显示,PRV 感染到小鼠脑内,并且出现在神经细胞及小胶质细胞中,如图箭头所示(图4)。
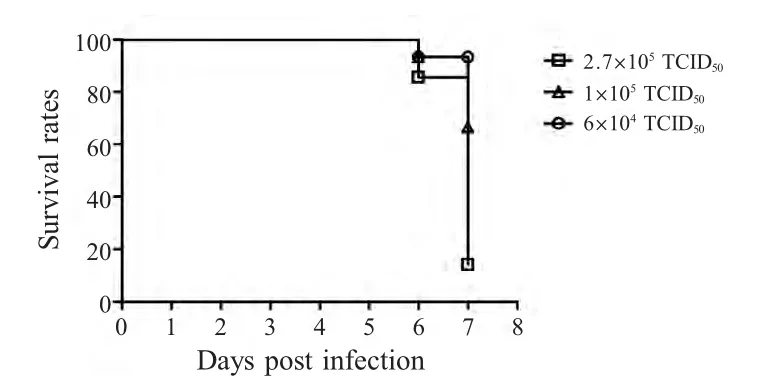
图3 PRV 疫苗株皮下注射感染小鼠存活率Fig.3 The mice survival rates of vaccine strain in different doses infection subcutaneously
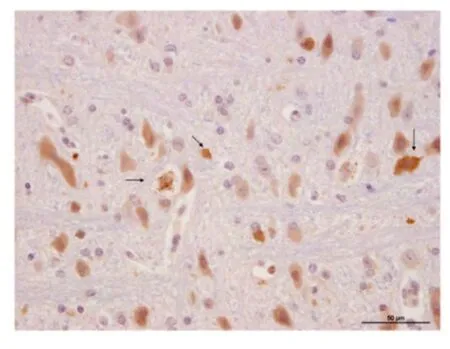
图4 PRV 抗体免疫组化染色Fig.4 Detection of PRV in mouse cerebral tissue by immunohistochemical staining
3 讨论
PRV 具有神经侵染性,从感染部位经神经突触移行可以进入CNS。病毒入侵到感染动物脑组织需要一定时间,本实验研究发现,在不同剂量感染下,小鼠均在感染3 d 后开始出现体重减轻、被毛凌乱等临床现象。在感染5 d 后,小鼠开始出现精神亢奋等症状。各种临床症状表明小鼠感染PRV后,病毒逐渐移行入脑组织,引起神经病变。不同动物在PRV 感染后,其脑组织均出现不同程度的小胶质细胞增多及血管周围炎性细胞浸润现象。PRV感染下,猪、羊及小鼠组织病理学病变相似,但病变程度不同。小鼠感染PRV 强毒株及疫苗株后病理变化明显,综合小鼠感染PRV 后的临床症状及病理学变化,小鼠可以作为PRV 感染研究的实验动物。
实验结果表明,在不同剂量及不同途径PRV 强毒株感染下,小鼠在感染后第3 d 即出现死亡现象,感染后第4 d 死亡率增加,即强毒株感染小鼠整体表现为病程短、死亡率高。而疫苗株感染的小鼠,相同剂量感染后,在第6 d 才开始出现死亡,并且1×105TCID50剂量感染下,小鼠既具有一定的死亡率又具有较高的存活率,达60 %以上,其脑部病变也比较明显,所以本研究最终选用PRV 疫苗株在1×105TCID50剂量下,以皮下注射方式感染小鼠,选取感染后6 d 为最佳时间点进行后续实验。
免疫组化结果表明PRV 感染脑组织后出现在神经细胞内,同时感染细胞周围的小胶质细胞内也出现病毒粒子。小胶质细胞在PRV 感染后增殖且发挥吞噬作用。PRV 感染引起的天然免疫应答机制有待进一步研究。
[1]Reiner G,Melchinger E,Kramarova M,et al.Detection of quantitative trait loci for resistance/susceptibility to pseudorabies virus in swine[J].J Virol,2002,83:167-172.
[2]Klopfleisch R,Teifke J P Mettenleiter T C.Influence of tegument proteins of pseudorabies virus on neuroinvasion and transneuronal spread in the nervous system of adult mice after intranasal inoculation[J].Virol,2004,78(6):2956-2966.
[3]Nauwynck H,Glorieux S,Favoreel H,et al.Cell biological and molecular characteristics of pseudorabies virus infections in cell cultures and in pigs with emphasis on the respiratory tract[J].Vet Res,2007,38:229-241.
[4]Brittle E E,Reynolds A E,Enquist L W.Two modes of pseudorabies virus neuroinvasion and lethality in mice[J].J Virol,2004,12:12951-12963.
[5]Rassnick S,Enquist L W,Sved A F,et al.Pseudorabies virusinduced leukocyte trafficking into the rat central nervous system[J].J Virol,1998,11:9181-9191.
[6]Dénes A,Boldogkoi Z,Hornyák A,et al.Attenuated pseudorabies virus-evoked rapid innate immune response in the rat brain[J].J Neuroimmunol,2006,180(1-2):88-103.
