6-DMAP和低渗诱导长牡蛎“海大2号”三倍体的研究❋
2023-02-21徐成勋李永国
程 庚, 徐成勋, 李永国, 李 琪,2❋❋
(1. 海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003;2. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
长牡蛎(Crassostreagigas)作为中国北方牡蛎主要养殖品种在海水养殖中占有重要地位。为提高长牡蛎的生产性能,国内外相继开展了遗传改良工作。选择育种作为水产养殖贝类品种改良的一种常用育种方法,能够改良生产性状,在世界范围内长牡蛎家系选育和群体选育均取得了成功[1]。在国内,通过家系选育和群体选育培育出外壳和外套膜均为金黄色、生长快速的长牡蛎“海大2号”[2]。然而,同普通二倍体牡蛎一样,因夏季性腺发育和产卵导致其存在口感差、夏季不能上市、产卵后死亡率高等问题[3],这阻碍了长牡蛎“海大2号”的市场全年供给。与二倍体相比,三倍体牡蛎由于其高度不育可全年上市,这填补二倍体牡蛎的夏季市场空缺。同时,利用其性腺不育性可以有效保护新品种的知识产权[4-8]。
使用牡蛎四倍体与二倍体杂交可获得100%三倍体牡蛎[9],但四倍体牡蛎的获得需要三倍体牡蛎作为基础[10]。因此,由二倍体诱导三倍体仍然是获取三倍体的重要途径。利用贝类卵子发育成熟后在第一次减数分裂中期的停滞期[11],以物理或化学刺激手段抑制其极体排放,可实现增加一套染色体的目的[8]。其中,化学方法为通过细胞松弛素B(CB)、6-二甲基氨基嘌呤(6-DMAP)、咖啡因等化学药物处理[12-13]影响微丝、微管的正常活动,干扰极体的正常排出;物理方法则是通过盐度胁迫、温度休克、静水压等处理[14-16]达到增加染色体数目的目的。两种方式各有优劣,化学法三倍体诱导率高但幼虫成活率低且试剂昂贵[17-18],物理法成本低但诱导率不稳定[15,19]。因此,将物理法和化学法相结合有望在保证三倍体诱导率的同时提高幼虫成活率。
目前,在牡蛎三倍体诱导优化方面进行了大量研究,但是不同物种以及同一物种不同品系或群体的最佳诱导条件仍存在一定差异[12,20]。本研究以长牡蛎“海大2号”为实验材料,将化学法(6-DMAP)与物理法(低渗)相结合来诱导牡蛎三倍体,旨在得到诱导率高且幼虫成活率稳定的三倍体诱导方法,为培育长牡蛎“海大2号”三倍体提供参考资料。
1 材料与方法
1.1 实验材料
2021年5月自山东荣成桑沟湾养殖海区取2龄长牡蛎“海大2号”二倍体,转移至烟台莱州育苗场进行暂养。促熟期间每日投喂足量等鞭金藻(Isochrysisgalbana)。2周后挑选外壳无损伤的个体作为实验亲贝。
1.2 精卵获取与授精
通过人工解剖获取牡蛎精卵,显微镜下辨别雌雄并观察精卵成熟度。挑选卵子呈卵圆形且卵质均匀的个体为母本,精子活力高的个体为父本。使用300目筛绢过滤卵子去除组织块及杂质,随后置于砂滤海水中熟化1 h,精子于授精前5 min挤出备用。授精前镜检卵子是否污染,水温严格控制在(25±0.5) ℃。
1.3 三倍体诱导实验设计
1.3.1 低渗诱导三倍体 参考于瑞海[21]等方法,确定低渗诱导三倍体最佳条件组合。授精后,在显微镜下不断取样观察,当受精卵第一极体(PB1)出现30%、40%和50%时,分别于盐度为8、10和12的低渗海水中持续处理15 min (共9组),然后转移到正常海水中孵化。
1.3.2 6-DMAP诱导三倍体 参考Gérard等[12]方法,确定6-DMAP诱导三倍体最佳条件组合。当 PB1出现30%、40%和50%时,分别采用浓度为50、75和100 mg/L的6-DMAP持续处理15 min后(共9组)进行洗卵,并转移到正常海水中孵化。
1.3.3 低渗与6-DMAP配合使用诱导三倍体 当PB1出现30%、40%和50%时,在盐度为8、10和12的低渗海水中分别采用浓度为50、75和100 mg/L的6-DMAP持续处理15 min后(共27组)。以上每组实验均重复3次,同时设置二倍体对照组。
1.4 幼虫培养
授精24 h后进行选幼,每日投喂等鞭金藻3次,每日换水1/3,持续充氧,幼虫培养至第8天。
1.5 数据测量与分析
测量各实验组的卵裂率、孵化率、三倍体率、幼虫成活率和综合评价指数等指标。卵裂率为受精后4 h卵裂数占总卵数的百分比,孵化率为受精后24 h D形幼虫占总受精卵数量的百分比。综合评价指数为孵化率与三倍体率的乘积。分别在第2天和第8天取各组幼虫进行三倍体率及幼虫成活率测定。三倍体率利用流式细胞仪进行测定。采用SPSS 24.0进行实验数据的分析,显著性水平设为0.05。
2 结果
2.1 低渗诱导效果
随着盐度的增加,各组的卵裂率和孵化率逐渐增加,而三倍体率逐渐降低。随着起始处理时间点的后移,各组卵裂率、孵化率、三倍体率呈先增加后降低的趋势。海水盐度为8、40% PB1出现时(以下简称“8%+40% PB1”组)开始进行低渗处理获得的幼虫三倍体率最高,达到73.77%±1.89%,且显著高于其他处理组(P<0.05),综合评价指数最大,为34.33%(见图1(a))。8日龄时,低渗处理组的三倍体率和存活率与2日龄相比均有不同幅度的降低。随着盐度的增加,各组三倍体率的下降幅度呈减小趋势,“8+40% PB1”组三倍体率为50.65%±4.89%,下降幅度最大,为23.12%。“8+40% PB1”组三倍体率与“10+40% PB1”组(48.47%±5.58%)差异不显著,但显著高于其他处理组(P<0.05)。随着盐度的增加,2日龄幼虫存活率无显著差异(P>0.05),8日龄幼虫存活率逐渐增加(见图1(b))。综合比较以上结果,海水盐度为8、40% PB1出现时开始处理是诱导三倍体的最佳条件。
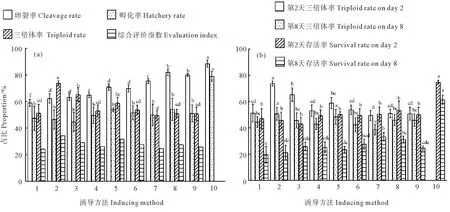
(1. 8+30% PB1, 2. 8+40% PB1, 3. 8+50% PB1, 4. 10+30% PB1, 5. 10+40% PB1, 6. 10+50% PB1, 7. 12+30% PB1, 8. 12+40% PB1, 9. 12+50% PB1, 10. 对照组。不同上标表示差异显著(P<0.05),下同。1. 8+30% PB1, 2. 8+40% PB1, 3. 8+50% PB1, 4. 10+30% PB1, 5. 10+40% PB1, 6. 10+50% PB1, 7. 12+30% PB1, 8. 12+40% PB1, 9. 12+50% PB1, 10. Control. The different letter indicates signifi-cant difference(P<0.05), The same below.)
2.2 6-DMAP诱导效果
随着6-DMAP浓度增加,各组的卵裂率和孵化率逐渐降低,三倍体率逐渐增加。随着起始处理时间点的变化,各组的卵裂率和孵化率无显著差异。6-DMAP浓度为100 mg/L、40% PB1出现时(以下简称“100 mg/L+40% PB1”组)开始处理三倍体率最高,为77.75%±1.85%,与“75 mg/L+40% PB1”组(74.81%±0.68%)、“100 mg/L+30% PB1”组(74.05%±3.28%)、“100 mg/L+50% PB1”组(71.17%±5.17%)差异不显著(P>0.05)。“75 mg/L+40% PB1”组综合评价指数最大,为36.53%(见图2(a))。8日龄时,“75 mg/L+40% PB1”组三倍体率最高(60.37%±0.61%),与“100 mg/L+40% PB1”组(60.22%±2.94%)和“100 mg/L+50% PB1”组(58.13%±2.59%)差异不显著(P>0.05)。8日龄幼虫“50 mg/L+40% PB1”组的成活率最高(41.85%±3.68%),与“50 mg/L+50% PB1”组(39.10%±3.52%)、“75 mg/L+40% PB1”组(30.25%±2.85%)差异不显著,但显著高于其他处理组(P<0.05)(见图2(b))。因此,6-DMAP浓度为75 mg/L、第一机体出现40%时开始处理是诱导三倍体最佳条件。
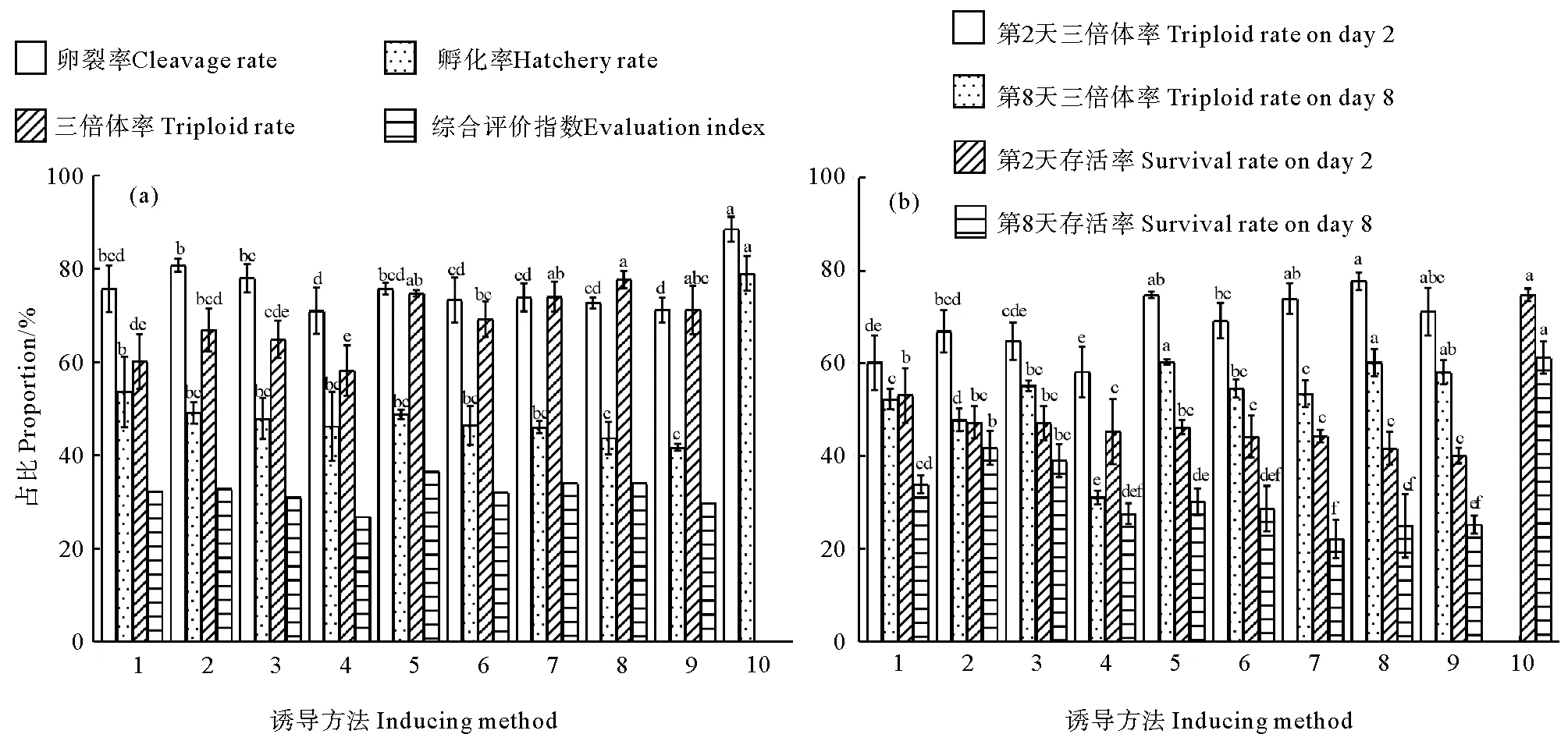
(1. 50 mg/L+30% PB1, 2. 50 mg/L+40% PB1, 3. 50 mg/L+50% PB1, 4. 75 mg/L+30% PB1, 5. 75 mg/L+40% PB1, 6. 75 mg/L+50% PB1, 7. 100 mg/L+30% PB1, 8. 100 mg/L+40% PB1, 9. 100 mg/L+50% PB1, 10. 对照组。1. 50 mg/L+30% PB1, 2. 50 mg/L+40% PB1, 3. 50 mg/L+50% PB1, 4. 75 mg/L+30% PB1, 5. 75 mg/L+40% PB1, 6. 75 mg/L+50% PB1,7. 100 mg/L+30% PB1, 8. 100 mg/L+40% PB1, 9. 100 mg/L+50% PB1, 10. Control.)
2.3 低渗与6-DMAP配合使用诱导效果
2.3.1 盐度为8时6-DMAP诱导效果 盐度为8时,随着6-DMAP浓度的增加,处理组的卵裂率和孵化率逐渐降低,各处理组间无显著差异,但显著低于对照组(P<0.05)。“50 mg/L+50% PB1”组三倍体率和综合评价指数最高,分别为54.58%±3.87%和24.96%(见图3(a))。8日龄时处理组仅“50 mg/L+30% PB1”组和“50 mg/L+40% PB1”组和“50 mg/L+50% PB1”组幼虫存活,其他处理组幼虫大量死亡。“50 mg/L+40% PB1”组三倍体率最高(43.82%±2.16%),“50 mg/L+50% PB1”组存活率最高(19.07%)(见图3(b))。

(1. 50 mg/L+30% PB1, 2. 50 mg/L+40% PB1, 3. 50 mg/L+50% PB1, 4. 75 mg/L+30% PB1, 5. 75 mg/L+40% PB1, 6. 75 mg/L+50% PB1, 7. 100 mg/L+30% PB1, 8. 100 mg/L+40% PB1, 9. 100 mg/L+50% PB1, 10. 对照组。图中(a)和(b)盐度条件为8,(c)和(d)盐度条件为10,(e)和(f)盐度条件为12。 1. 50 mg/L+30% PB1, 2. 50 mg/L+40% PB1, 3. 50 mg/L+50% PB1, 4. 75 mg/L+30% PB1, 5. 75 mg/L+40% PB1, 6. 75 mg/L+50% PB1, 7. 100 mg/L+30% PB1, 8. 100 mg/L+40% PB1, 9. 100 mg/L+50% PB1, 10. Control. (In the figure, the salinity in (a) and (b) is 8,the salinity in (c) and (d) is 10,the salinity in (e) and (f) is 12.)
2.3.2 盐度为10时6-DMAP诱导效果 盐度为10时,“50 mg/L+50% PB1”组三倍体率最高(56.28%±2.13%),与“50 mg/L+40% PB1”组(51.25%±4.50%)、“75 mg/L+40% PB1”组(52.55%±2.67%)差异不显著,但显著高于其他处理组(P<0.05)。“50 mg/L+50% PB1”综合评价指数最高(26.40%)(见图3(c))。8日龄时,“50 mg/L+50% PB1”组三倍体率最高(50.33%±1.30%),显著高于其他处理组(P<0.05)。“75 mg/L+50% PB1”组存活率最高(29.53%±3.45%),与其他各组无显著差异 (见图3(d))。
2.3.3 盐度为12时6-DMAP诱导效果 盐度为12时,“50 mg/L+40%PB1”组三倍体率最高(74.34%±3.49%),与“50 mg/L+50% PB1”组(68.90%±4.17%)差异不显著, 但显著高于其他处理组(P<0.05)。“50 mg/L+50% PB1”组综合评价指数最高,为36.18%(见图3(e))。8日龄时“50 mg/L+40% PB1”组三倍体率最高(68.23%±2.52%),与“50 mg/L+50% PB1”组(62.77%±6.04%)差异不显著,但显著高于其他处理组(P<0.05)。“50 mg/L+40% PB1”组存活率最高(40.42%±4.30%)(见图3(f))。因此,海水盐度为12、6-DMAP浓度为50 mg/L、第一机体出现40%时开始处理是诱导三倍体的最佳条件。
2.3.4 三种方法对比结果 6-DMAP处理组中,通过75 mg/L的6-DMAP在40% PB1出现时开始处理综合评价指数最高(36.52%),略高于低渗处理组中最高值(34.33%,盐度为8、40% PB1出现时)和配合组中最高值(36.18%,盐度为12、6-DMAP浓度为50 mg/L、40% PB1出现时)。三种方法之间无明显差异。通过进一步比较3种方法的8日龄幼虫三倍体率和存活率发现,配合组8日龄三倍体率和存活率最高(68.23%±2.52%,40.42%±4.30%),远大于低渗处理组(50.65%±4.89%,21.17%±5.54%)和6-DMAP处理组(60.37%±0.61%,30.25%±2.85%)。因此,当受精卵PB1出现40%时,相比低渗或6-DMAP单独处理,配合使用盐度12的海水和50 mg/L 6-DMAP处理受精卵来诱导三倍体,会使三倍体倍率更稳定、幼虫存活率更高,这是诱导三倍体的最佳处理组合。
3 讨论
3.1 三种诱导方法诱导三倍体的原理分析
6-DMAP是一种蛋白质磷酸化抑制剂,能够抑制微管生长,阻止极体排除,且阻碍作用可逆,去除后允许细胞继续发育[22]。6-DMAP诱导多倍体效果稳定,已在多种贝类中得以证实[17,23-24]。低渗诱导三倍体原理可能是低渗使受精卵受氧化胁迫而导致糖代谢或渗透调节受阻,因此发生了染色体异常分离[25]。而根据本实验结果显示,在同等强度处理下,相比于低渗组和6-DMAP处理组,配合组的三倍体率和幼虫成活率在8日龄时均有不同程度提升。说明通过合理调整6-DMAP浓度和海水盐度,同时对受精卵施加物理处理和化学药物处理两方面的作用,同样能够起到提高三倍体率的效果,且比同等强度刺激下6-DMAP和低渗单独作用效果更好。孔静等发现受精卵卵径随着盐度的降低逐渐增大[19],在低渗条件下,一方面低渗处理本身能够干扰受精卵的正常生理活动导致染色体异常分离,另一方面,低渗处理使得受精卵卵径增大,导致受精卵与诱导剂相接触的表面积增加,从而6-DMAP能够更好地进入受精卵内部发挥作用。
3.2 三倍体率的影响因素
诱导剂类型、处理浓度、诱导时机及持续时间等因素都会影响三倍体诱导率[6,12,17]。Qin等[26]发现海水温度会影响卵子生发泡破裂时间和极体排出时间,同时生发泡破裂比例也会影响极体排出时间,而极体排出比例正是诱导处理的关键节点[27]。此外,水温、卵子来源、不同繁育批次以及同一批次不同个体性腺成熟度也会有很大差异,这些均会造成卵子发育不同步,从而降低三倍体诱导率。因此,为提高三倍体诱导率,本研究中采用同批次繁育的长牡蛎“海大2号”群体作为亲本,镜检并选择性腺发育饱满的个体进行实验,受精前将卵子充分熟化至生发泡破裂,并控制水温为(25.0±0.5) ℃,最大程度保证卵子发育的同步性。尽管如此,本实验通过低渗法诱导三倍体率最高仅为73.77%,与孔静等相同诱导方法获得的89.13%三倍体率仍有差异。除上述因素外,孵化时海水盐度不同也可能是差异产生的原因[28]。
3.3 三倍体率与幼虫成活率
在幼虫培养阶段,各处理组的幼虫存活率和三倍体率均呈不断下降的趋势。6-DMAP和低渗环境阻碍了受精卵的正常生理发育过程[22,25],这可能是导致培养期间幼虫成活率和三倍体率降低的原因之一。同时,Nell等[29]通过6-DMAP诱导悉尼岩牡蛎(Saccostreacommercialis)三倍体时发现幼虫群体中存在1%~11%的非整倍体。而非整倍体存活能力低,也会导致诱导群体存活率下降[30]。本研究表明,通过增大药物浓度或降低海水盐度来提高受精卵处理强度,有利于提高三倍体诱导率。然而,这不可避免地增加了对受精卵的损伤,导致卵裂率、孵化率和成活率下降。因此,需要探索一种在保证幼虫成活率的前提下能够最大限度地提高三倍体诱导率的方法。本研究发现6-DMAP和低渗配合比两者单独使用诱导效果更好、三倍体率更稳定、幼虫成活率更高且降低了诱导成本。这一研究结果为长牡蛎“海大2号”三倍体的培育提供了基础资料。
4 结语
本研究在不同诱导时机和诱导强度下综合比较了三种处理方式(低渗处理、6-DMAP处理以及6-DMAP和低渗配合处理)诱导长牡蛎“海大2号”三倍体的效果。通过分析综合评价指数和8日龄幼虫的三倍体率、存活率,发现当受精卵PB1出现40%时,相比低渗或6-DMAP单独处理,配合使用盐度12的海水和50 mg/L 6-DMAP处理受精卵来诱导三倍体,会使三倍体倍率更稳定、幼虫存活率更高,这是诱导长牡蛎“海大2号”三倍体的最佳处理组合。研究结果为长牡蛎“海大2号”三倍体的培育提供了基础资料。
