葡萄糖和盐度对卤虫生长、养殖系统生物絮团形成及其微生物多样性的影响*
2015-03-08马灌楠邓元告隋丽英
王 娇 马灌楠 邓元告 隋丽英
(天津科技大学 天津市海洋资源与化学重点实验室 天津 300456)
生物絮团(Biofloc)是以异养微生物为主体, 经生物絮凝作用结合水体中颗粒有机物、原生动物和藻类等形成的絮状物(Avnimelech, 1999; Hargreaves,2006)。生物絮团技术(Biofloc techniques, BFT)通过调节搅拌强度、溶解氧、pH、温度、有机碳和有机物负荷率等, 促进养殖体系中排泄物及残饵吸收和转化, 减少水中氮含量, 并将其转化为微生物蛋白供养殖动物摄食, 使饵料得以循环利用(De Schryver et al, 2008; Crab et al, 2012)。在养殖水体中添加碳源, 通过有效提高水中碳氮比, 使其中以自养细菌为主的微生物区系转变为以异养细菌为主的区系。而异养细菌数量的提高, 有利于生物絮团的形成(Avnimelech, 1999; Wilén et al, 2003; Schneider et al,2005)。研究表明, 采用生物絮团技术可显著促进杂交罗非鱼(Avnimelech, 2006; Crab et al, 2009)、日本囊对虾Marsupenaeus japonicus(Zhao et al, 2012)、凡纳滨对虾Litopenaeus vannamei(Burford et al, 2003; Hari et al, 2004, 2006; Schveitzer et al, 2013)和巴西褐对虾Farfantepenaeus brasiliensis(Emerenciano et al, 2012)等水产动物的生长, 提高产量, 减少饲料投入。
卤虫(Artemia)广泛分布于内陆盐湖和日晒盐场蒸发池中, 是盐田生态系统中的主要消费者和生态调节者, 也是水产苗种极佳的鲜活饵料(Sorgeloos et al, 2001)。作为非选择性滤食性动物, 卤虫一般摄食小于50µm的食物颗粒(D’Agostino, 1980)。与海水和淡水养殖环境相比, 针对高盐环境下生物絮团的形成及其在卤虫养殖中应用的相关研究较少。Ronald等(2013)和 Sui等(2013)通过向养殖水体中添加木薯粉、鸡粪和米糠等, 显著提高了卤虫成虫和卤虫卵产量。Toi等(2013)通过向养殖水体中添加蔗糖和淀粉,显著降低了单胞藻投喂量, 同位素标记结果显示, 添加的碳源可被卤虫利用。
本研究在高盐环境下, 研究碳源添加和不同盐度对卤虫生长、卤水中生物絮团形成、水质及其细菌多样性的影响, 为生物絮团技术在高盐养殖环境下水产养殖中的应用提供理论依据, 为其在卤虫养殖和盐田生态调控中的应用提供数据支撑。
1 材料与方法
1.1 实验材料
养殖用水取自天津汉沽盐场结晶池, 卤水盐度250, 经过消毒和过滤后, 用自来水稀释到所需盐度。实验所用卤虫品系为Artemia franciscana (VinhChau strain)。卤虫卵于盐度30海水中孵化20h, 孵化温度(27±0.5)°C, 光照强度 1000lx, 适量充气。收集初孵卤虫无节幼体, 在盐度50和(24±0.5)°C条件下暂养5d,适量充气。每天早晚投喂适量浓缩杜氏藻 Dunaliella viridis。大量培养的D. viridis采用高速冷冻离心机浓缩(6000r/min, 4°C, 10min, Beckman), 浓缩藻液在4°C下保存。
1.2 实验设计
本研究以葡萄糖为碳源。考虑到卤虫在盐田中的适宜生长盐度, 实验组盐度设定为50、100和150, 分别表示为“50+Glu”、“100+Glu”和“150+Glu”, 对照组(Control)不添加葡萄糖且盐度为50, 每组三个平行。单位养殖体系为 1L锥形塑料瓶, 卤虫起始密度约为1200ind/L。实验养殖条件与卤虫暂养条件相同, 实验周期为20天。每天向养殖水体中补充一次蒸馏水, 以维持盐度稳定。
D. viridis投喂量及葡萄糖添加量见表1, 碳氮比(C/N)设定为20。D. viridis投喂量为Vanhaecke等(1984)建议的最适投喂量的60%, 葡萄糖添加量参考Avnimelech(1999)提出的计算方法, 即
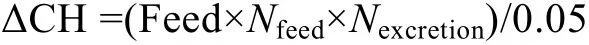
式中, ΔCH为系统中碳水化合物的添加量; Feed为饲料投喂量; Nfeed为饲料中氮含量(40%); Nexcretion为养殖动物排氮量占饲料含氮量的比例(一般为50%); 0.05为常数。
1.3 指标测定
养殖过程中每天测定水体pH (Mettler Toledo FE20)和溶解氧(YSI DO200)。实验结束时用100目滤网收集卤虫, 除去杂质, 用蒸馏水洗净虫体表面盐分, 用滤纸吸去外部水分, 称取卤虫总生物量。将卤虫冷冻干燥, 用于生化组分的测定。将收获卤虫后的养殖水体沉降4h, 倾掉上清, 将沉积物转入Imhoff管中, 再沉降 24h, 测定生物絮团体积(Biofloc volume, BFV)(Avnimelech, 2012)。从上清中取水50mL, 分别采用重氮-偶氮法、锌镉还原法、次溴酸钠氧化法和过硫酸钾氧化法测定水体中亚硝酸盐、硝酸盐、铵盐和总氮浓度(GB/T12763.4-200X)。
卤虫总蛋白采用凯氏定氮法测定(GB 5009.5-2010)。卤虫脂肪酸的测定采用内标法, 内标脂肪酸为C2:2 n-6。总脂肪抽提和脂肪酸甲酯化采用Lepage等(1984)提出的方法, 甲酯化脂肪酸(FAME)组成和含量用气相色谱测定(Shimatzu)。色谱条件: 毛细柱(CBP20-25-50, 50m×0.25mm×0.2µm), 载气为高纯氮气, 程序升温初始180°C, 以6°C/min速率升至240°C保持 20min; 气化室温度 280°C; FID 检测器, 温度280°C; 柱压 182.2kPa; 分配比率 20∶1。
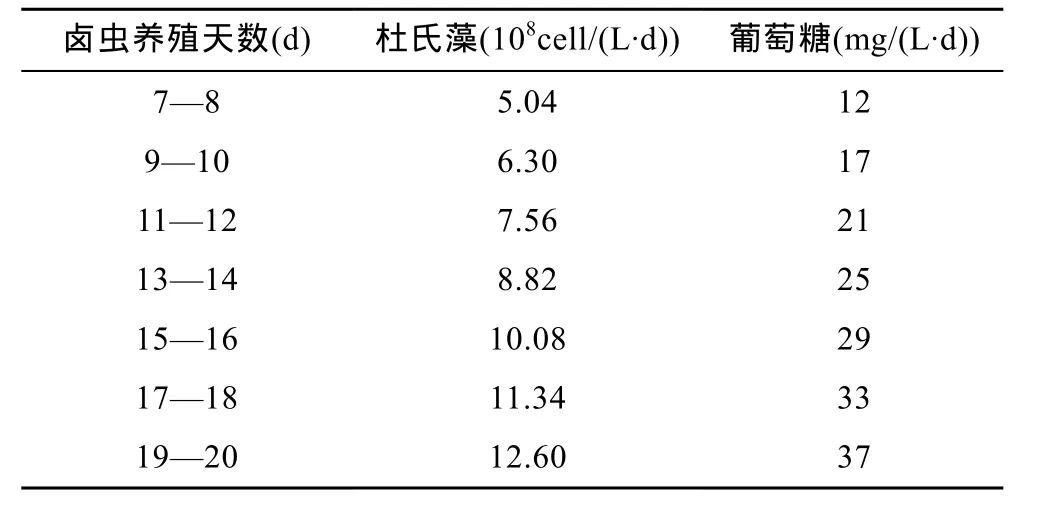
表1 单胞藻Dunaliella viridis投喂量及葡萄糖添加量Tab.1 The feeding schedules of Dunaliella viridis and the amount of glucose addition
1.4 变性梯度凝胶电泳(DGGE)
实验结束后在无菌条件下采集生物絮团, 置于-20°C保存。取500μL絮团样本, 8000r离心10min, 用DNA提取试剂盒(Promega)提取基因组DNA, 对细菌V3区域进行16S rDNA特异性扩增(Yu et al, 2004)。PCR扩增引物338F-GC: 5′-CGCCCGCCGCGCCCCG CGCCCGTCCCGCCGCCCCCGCCCGCCTACGGGAG GCAGCAG-3′, 534R: 5′-ATTACCGCGGCTGCTGG-3′(Muyzer et al, 1993)。PCR 反应体系为: 10μL 10× PCR缓冲液 (不含 MgCl2), 1.5mmol/L MgCl2, 200μmol/L dNTP, 2.5U Taq DNA聚合酶(Promega), 双向引物0.5μmol/L, 400ng/μL 牛血清蛋白(Promega), 100ng DNA模板, 加PCR水(Sigma)至50μL。
PCR扩增程序为: 94°C预变性5min, 变性1min,53°C退火 1min, 72°C 延伸1min, 30个循环, 72°C 延伸10min。使用Bio-Rad DCodeTM系统(Hercules)对扩增产物进行变性梯度凝胶电泳(DGGE) (Boon et al,2002), 将 PCR产物上样在变性梯度 45%—60%的变性凝胶孔内, 变性凝胶浓度为8%(w/v)。电泳16h, 温度60°C, 电压38V。电泳结束后用1× Gel Red核酸染液(1:10000稀释) (FMC)染色 20min。采用 Bio-Rad ChemiDoc MP成像系统(Hercules)获得DGGE图谱。
1.5 条带回收与序列比对
从DGGE 凝胶上切下差异条带于无菌PCR水中捣碎, -20°C过夜。使用无GC夹的338F和518R扩增引物对上清液进行16S rDNA-PCR扩增。PCR 扩增程序为94°C预变性5min, 94°C变性1min, 53°C退火1min,72°C延伸1min, 25个循环, 72°C延伸10min (Boon et al,2002)。用1.5% 琼脂糖凝胶以DNA marker DL-2000为标准观察扩增片段所在位置。PCR产物若被确认为在DGGE凝胶的相同位置, 则进行测序(华大基因公司),测序结果参照GenBank 进行序列BLAST比对。
1.6 数据分析
采用SPSS19.0软件对数据进行统计分析。统计分析前, 采用 Levene法进行方差齐性检验, 当不满足齐性方差时, 对数据进行反正弦或平方根处理。采用单因子方差分析(One way ANOVA)对实验结果进行分析, 用Tukey法进行多重比较(P<0.05)。
DGGE条带多样性用加权丰富度指数(Rangeweighted richness, Rr)描述: Rr=(N2×Dg)
式中, N为DGGE图谱中总条带数, Dg为图谱第一条与最后一个条带之间的变性梯度(Marzorati et al, 2008)。
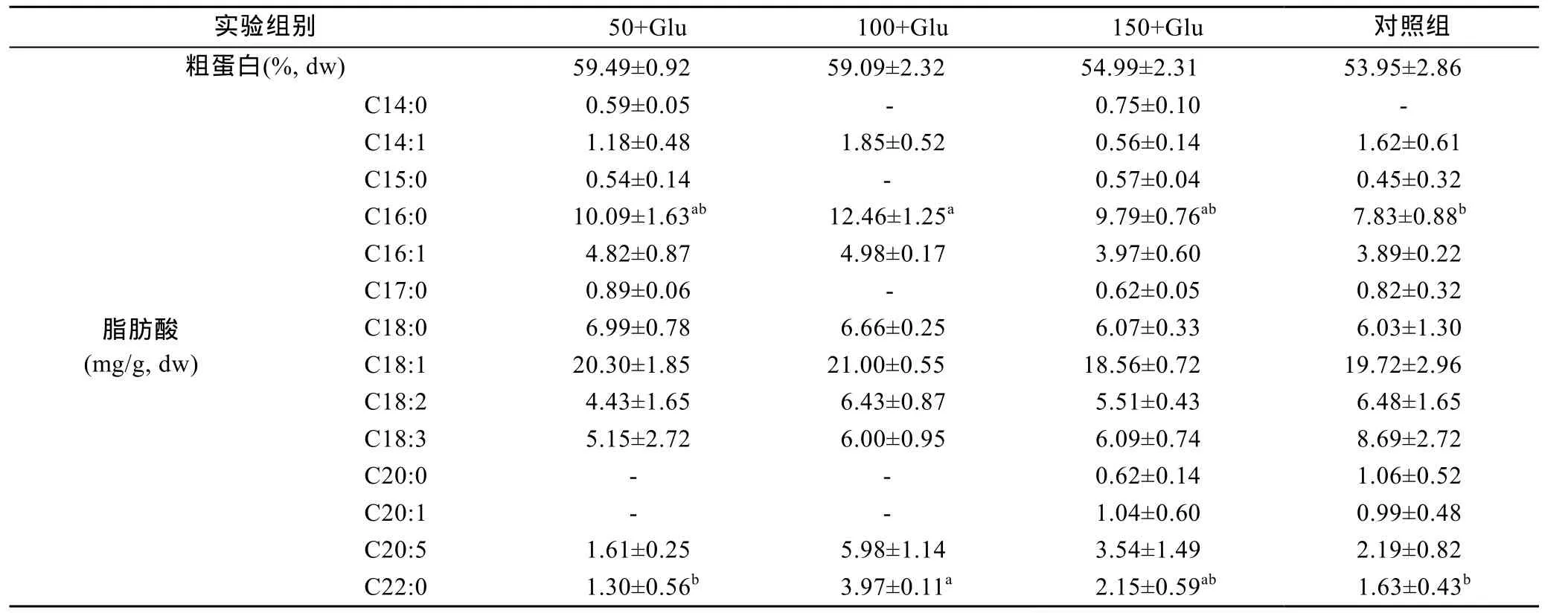
表2 添加葡萄糖和盐度50, 100和150条件下卤虫粗蛋白含量和脂肪酸组成Tab.2 Protein content and fatty acid profile of Artemia cultured with glucose enrichment at salinities 50, 100, and 150
2 结果
2.1 添加葡萄糖和不同盐度对卤虫生物量的影响
添加葡萄糖对卤虫总生物量具有显著促进作用(图1), 50+Glu组卤虫生物量显著高于对照组, 分别为682.5mg和228.4mg (P<0.05)。随盐度的升高, 卤虫生物量显著减少, 50+Glu组卤虫生物量显著高于100+Glu和150+Glu, 分别为297.9mg和271.5mg (P<0.05)。
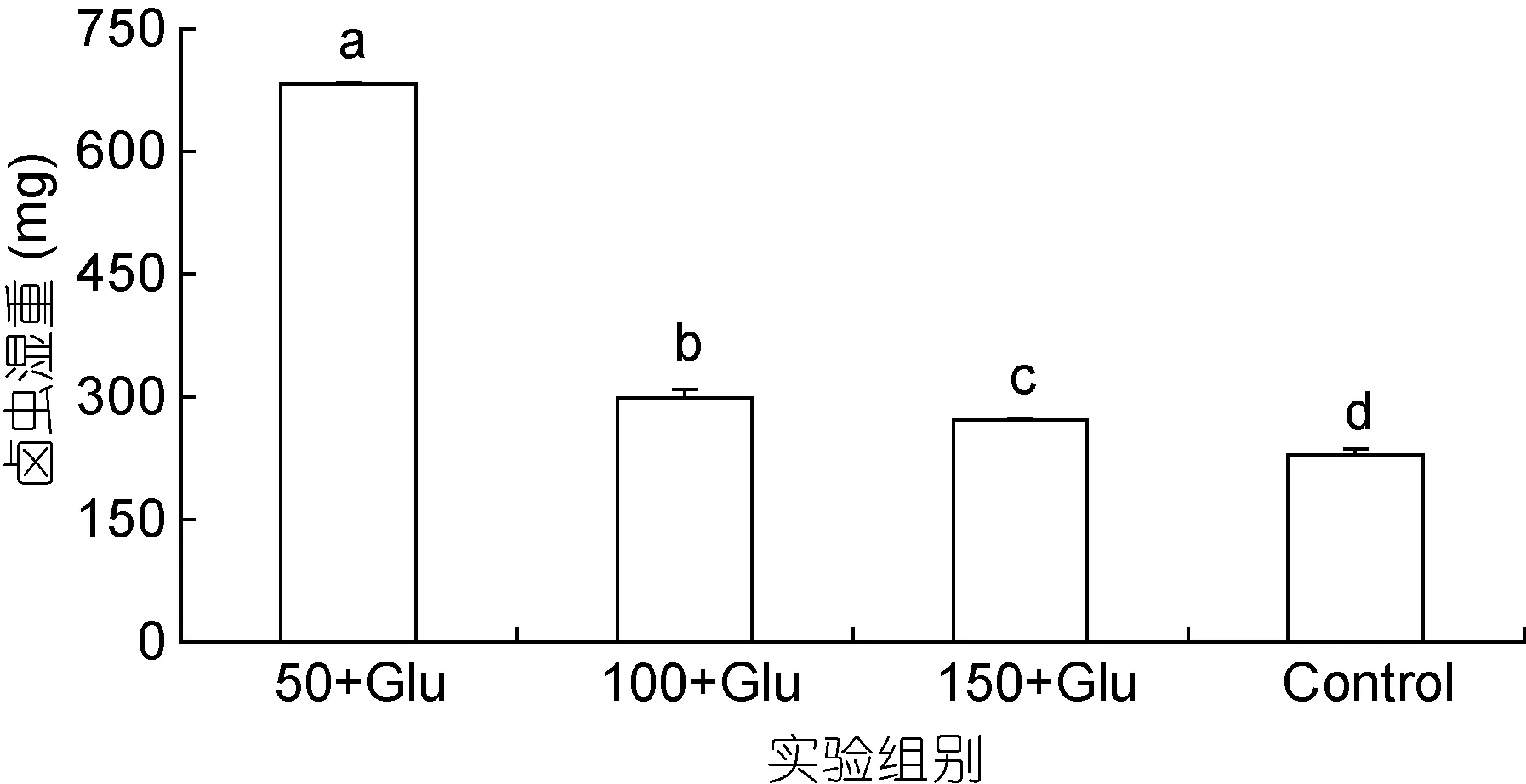
图1 添加葡萄糖和盐度50, 100和150条件下卤虫总生物量Fig.1 Total biomass of Artemia cultured with glucose enrichment at salinities 50, 100, and 150
2.2 添加葡萄糖和不同盐度对卤虫粗蛋白含量和脂肪酸组成的影响
添加葡萄糖和养殖盐度对卤虫成虫粗蛋白含量无显著影响(P>0.05, 表2)。除C16:0含量明显高于对照组(P<0.05)外, 添加葡萄糖对其它饱和及不饱和脂肪酸含量无显著影响(P>0.05)。除 100+Glu组 C22:0显著高于其它组别外, 盐度变化对卤虫脂肪酸含量均无显著影响(P>0.05)。
2.3 添加葡萄糖和不同盐度对养殖系统中生物絮团体积的影响
添加葡萄糖对生物絮团形成有明显促进作用(图2), 50+Glu组絮团体积(BFV)显著高于对照组, 分别为6.3mL和4.8mL (P<0.05)。随盐度升高, BFV无显著差异, 100+Glu组为6.7mL, 150+Glu组为7.0mL(P>0.05)。
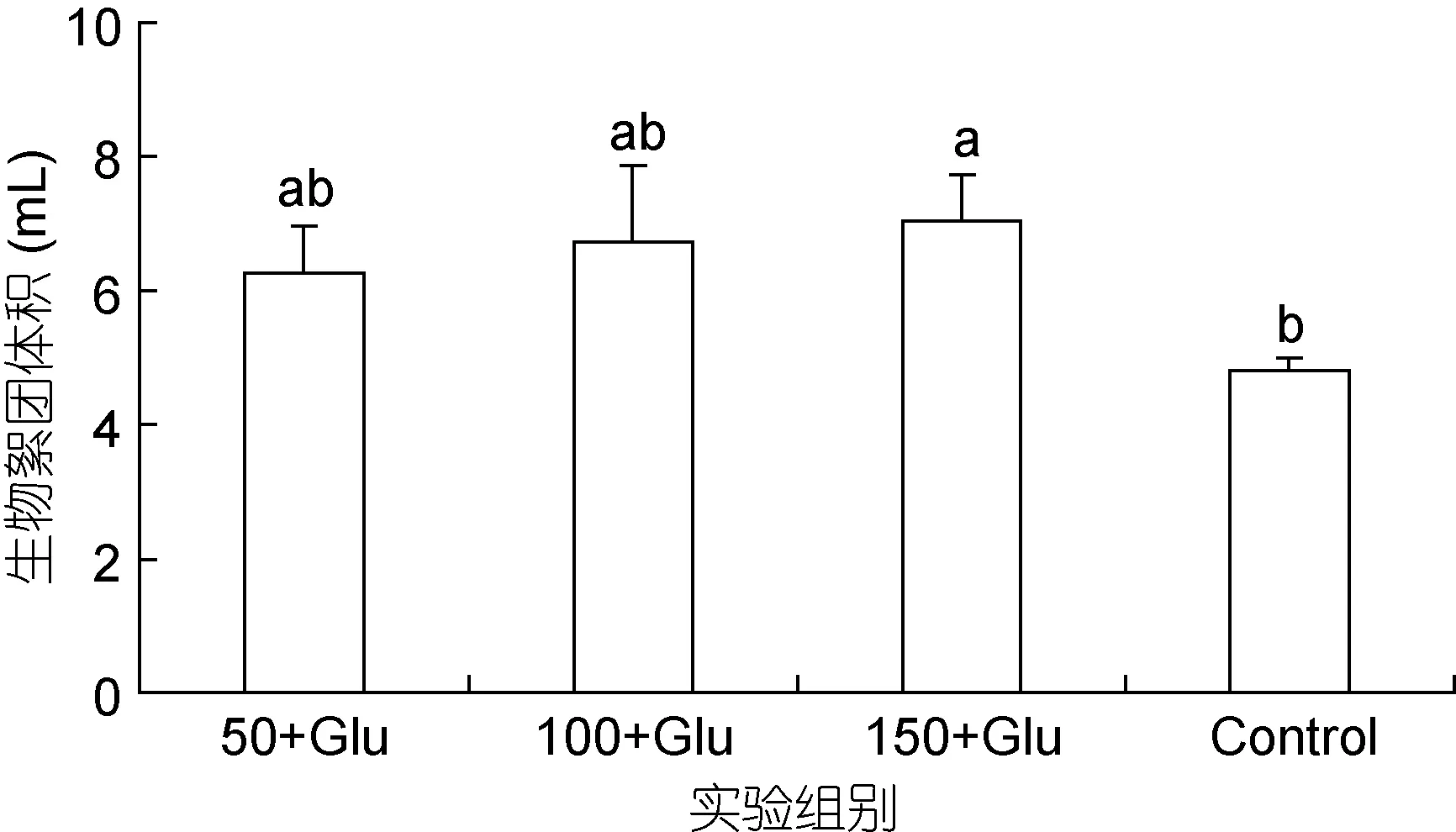
图2 添加葡萄糖和盐度50, 100和150条件下生物絮团体积Fig.2 Biofloc volume in the culture medium enriched with glucose at salinities 50, 100 and 150
2.4 添加葡萄糖和不同盐度对养殖系统中水质的影响
养殖过程中水体pH稳定在7.86—8.03之间, 溶解氧稳定在6.6—7.1mg/L之间。添加葡萄糖明显降低水中亚硝酸盐浓度(图3a), 50+Glu组亚硝酸盐浓度为12.47μmol/L, 明显低于对照组 23.66μmol/L (P<0.05)。随盐度升高亚硝酸盐浓度升高, 50+Glu组最低,100+Glu和150+Glu组分别为20.02μmol/L和25.62μmol/L,但差异不显著(P>0.05)。
添加葡萄糖明显降低水中硝酸盐浓度(图 3b),50+Glu组硝酸盐浓度为87.47μmol/L, 明显低于对照组117.59μmol/L (P<0.05)。硝酸盐浓度随着盐度升高有降低趋势, 50+Glu最高, 100+Glu和150+Glu组分别为 77.42μmol/L 和 67.97μmol/L, 但差异不显著(P>0.05)。
添加葡萄糖降低水中铵盐浓度(图3c), 50+Glu组铵盐浓度为32.72μmol/L, 低于对照组38.46μmol/L。铵盐浓度随盐度升高而降低, 50+Glu组铵盐浓度最高, 100+Glu和 150+Glu组分别为 17.14μmol/L和14.58μmol/L, 但差异不显著(P>0.05)。
添加葡萄糖明显降低水中总氮浓度(图 3d), 50+Glu组总氮浓度为 232.26μmol/L, 明显低于对照组629.89μmol/L (P<0.05)。总氮浓度随着盐度升高而升高, 50+Glu最低, 100+Glu和 150+Glu组分别为313.55μmol/L 和 412.85μmol/L, 差异显著(P<0.05)。
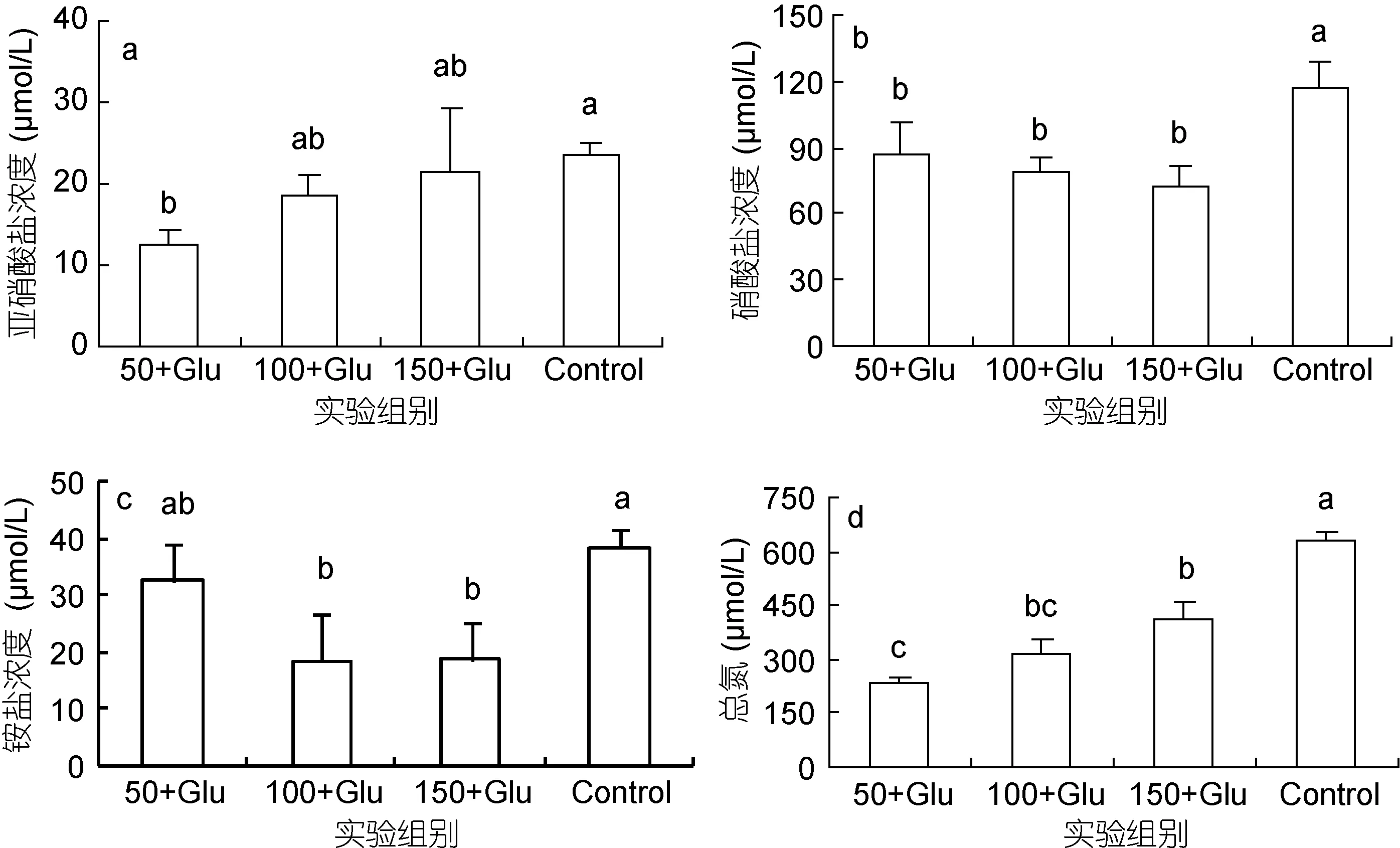
图3 添加葡萄糖和盐度50, 100和150条件下水体中亚硝酸盐(图3a)、硝酸盐(图3b)、铵盐(图3c)及总氮浓度(图3d)Fig.3 Concentrations of nitrite (a), nitrate (b), ammonium (c), and total nitrogen (d) in the culture volume enriched with glucose at salinities 50, 100, and 150
2.5 添加葡萄糖和不同盐度对生物絮团细菌多样性的影响
生物絮团基因组16S rDNA PCR-DGGE条带聚类分析表明, 同一实验组别平行样分别聚在一起, 相似度>85%。不同实验组别生物絮团的细菌组成分为两大类别, 分别是较高盐度(100和 150)与较低盐度(50)的养殖体系, 相似性仅为42%(见图4)。其中盐度100与150的养殖体系相似性为69%, 盐度50养殖体系中对照组与添加葡萄糖组的相似性为60%。说明葡萄糖添加和盐度对生物絮团微生物区系均有影响,但盐度的影响较为显著。
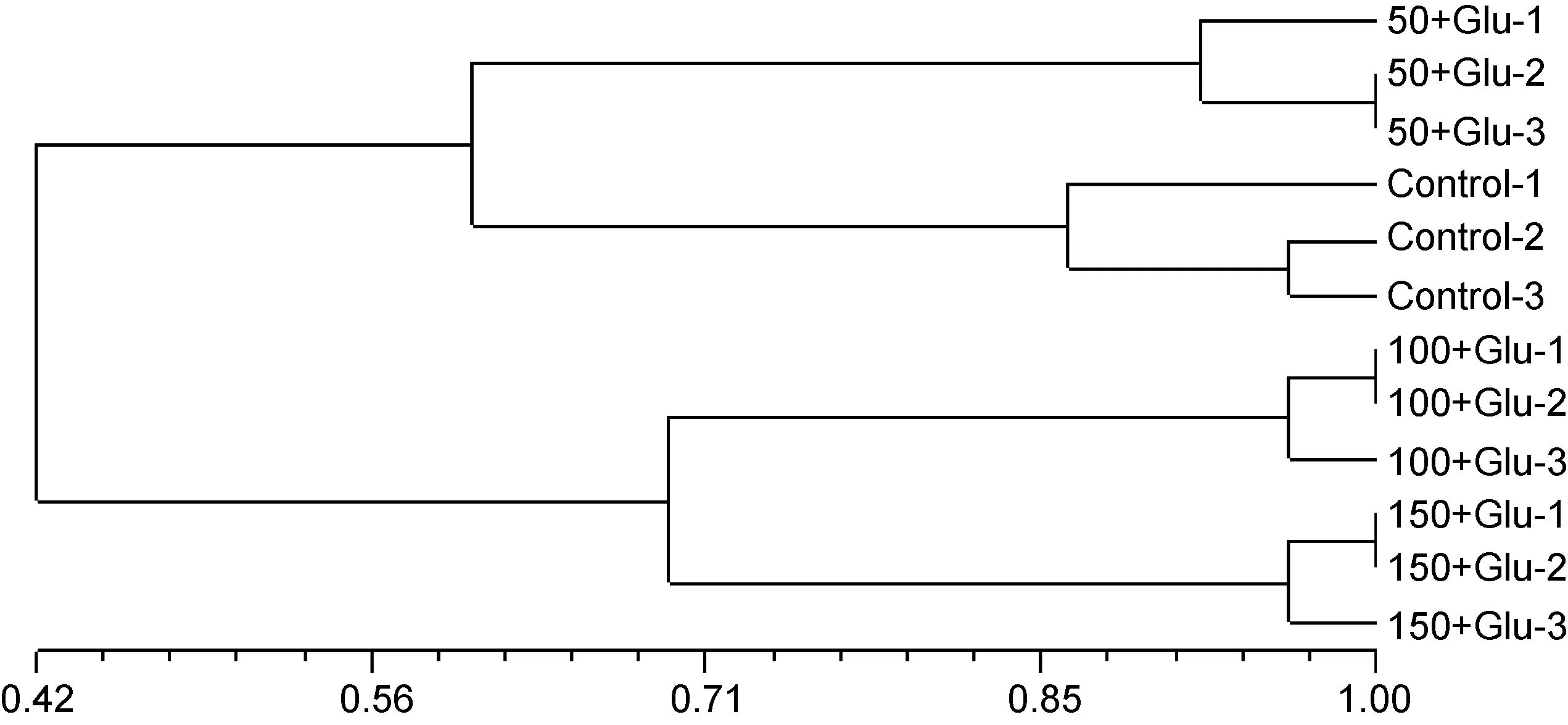
图4 添加葡萄糖和盐度50, 100和150条件下基因组16S rDNA PCR-DGGE条带聚类分析Fig.4 16S rRNA PCR-DGGE clustering analysis on bioflocs with glucose enrichment at salinities 50, 100, and 150
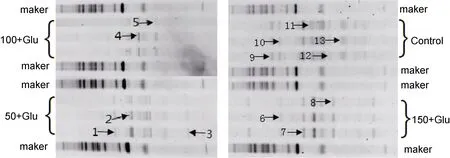
图5 DGGE凝胶割胶回收条带Fig.5 Bands recovered from the DGGE gels
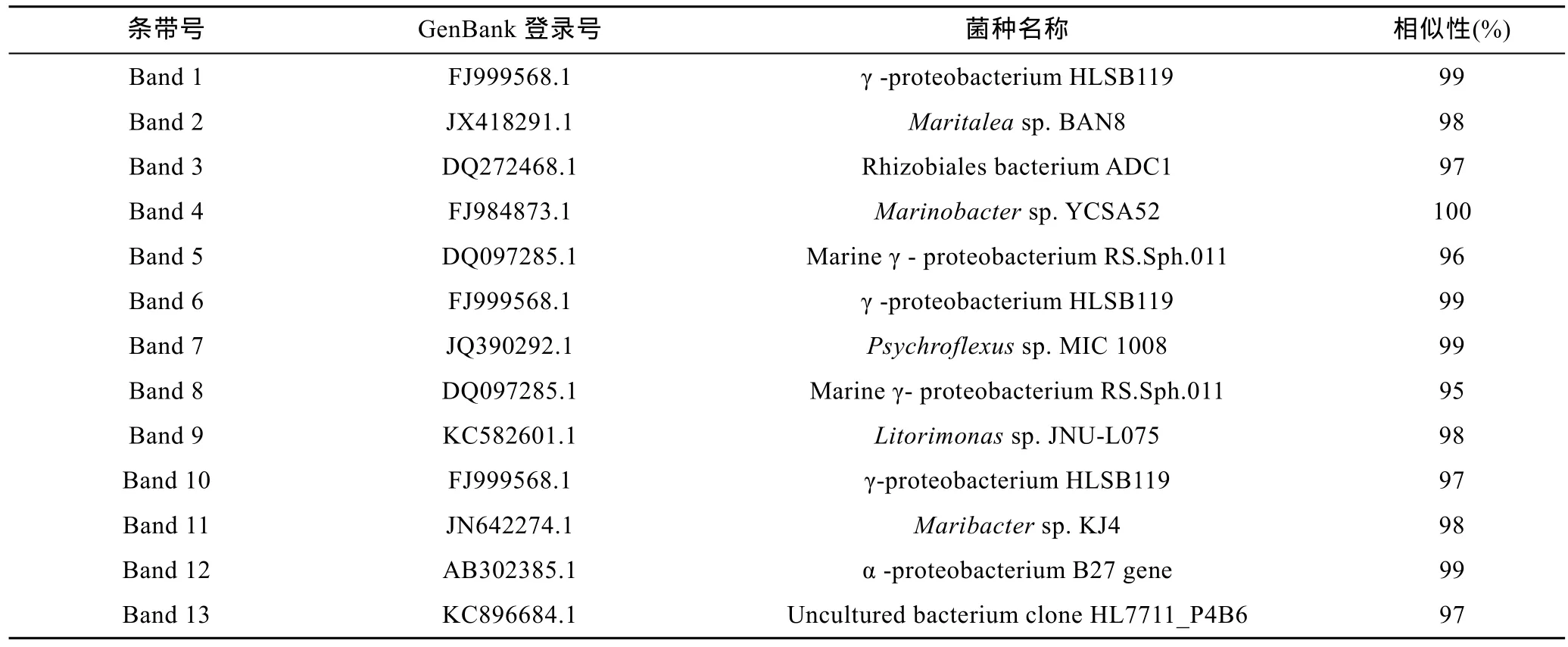
表3 DGGE 凝胶割胶回收条带16S rDNA-V3序列与GenBank中最相近菌种的序列相似性比对Tab.3 Similarity of 16S rDNA-V3 sequence recovered from the respective bands in DGGE gels to the closest relatives in GenBank database
DGGE目的条带基因片段的切割和序列比对结果见图5和表3。BLAST结果显示, 对照组的特异性条带较多。所有实验组别中 γ-变形菌纲细菌(γ-proteobacterium)为优势菌群, 条带 1、6 和 10 均为γ-proteobacterium, 相似性为 97%—99%(Liu et al,2010); 条带5和8为海洋γ-proteobacterium, 相似性分别为96%和95% (Ben-Dov et al, 2009), 存在于较高盐度实验组中。条带12为α-变形菌纲(α-proteobacterium),相似性为99% (Harwati et al, 2007)。条带2、3、4、7、9和11分别为海栖杆菌属Maritalea, 根瘤菌属Rhizobiales,海杆菌属 Marinobacter, 冷弯菌属 Psychroflexus, 海岸单胞菌属 Litorimonas和 Maribacter。条带13为不能培养的细菌克隆, 存在于酸性泥炭地中(Chen et al, 2008)。
根据DGGE图谱计算的细菌菌群丰富度指数(Rr)见图 6。不添加碳源对照组 Rr最高为 15.38, 添加葡萄糖的实验组中随盐度升高而显著降低, 分别为10.10, 7.09 和 2.04(P<0.05)。
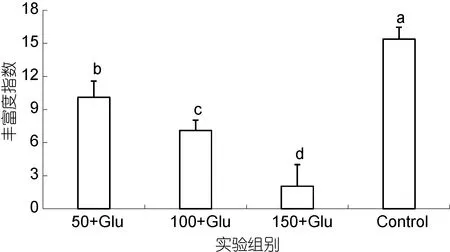
图6 添加葡萄糖和盐度50, 100和150条件下生物絮团中细菌菌群的加权丰富度指数(P<0.05)Fig.6 Range-weighted richness of bioflocs with glucose enrichment at salinities 50, 100, and 150 (P<0.05)
3 讨论
3.1 碳源对生物絮团的形成和卤虫生长的影响
生物絮团对水体中的氮转化和利用起到至关重要的作用。在碳氮平衡的条件下, 源自养殖动物排泄物及残饵的氨氮的转化可通过藻类的光能自养、自养微生物的硝化作用和异养微生物的同化作用等途径实现(Hargreaves, 2006)。碳源过剩时(C/N>10), 异养细菌对氨氮的固定能力是自养微生物的 10倍, 因此添加碳水化合物或直接投放高碳饲料可促进异养细菌的生长, 将水体中更多的铵氮转化为微生物蛋白,大大降低水中氨氮的浓度(Avnimelech, 1999; Wilén et al, 2003; Schneider et al, 2005)。碳源种类在很大程度上决定生物絮团的结构和稳定性(Oehmen et al, 2005),同时碳源的成本也决定着生物絮团的利用价值。实验室研究常用乙酸、甘油、葡萄糖、蔗糖、淀粉等作为碳源(Schneider et al, 2005; Crab et al, 2009; 邓应能等, 2012), 而糖浆、木薯粉、麦麸、玉米粉和高粱粉等廉价农业副产品是规模化养殖的首选(Crab et al,2009; Emerenciano et al, 2012)。本研究中向卤虫养殖系统中添加葡萄糖, 与对照组相比, 显著提高了卤虫生物量和BFV, 降低了水中无机氮和总氮水平, 说明添加葡萄糖有利于水中异养微生物大量繁殖, 将氨氮转化为微生物蛋白, 为卤虫提供充足的食物, 促进了卤虫的生长。该结果与前人针对罗非鱼(Crab et al,2009), 凡纳滨对虾(Xu et al, 2012)和日本囊对虾(赵培, 2011)的研究结果一致。
3.2 盐度对生物絮团形成和卤虫生长的影响
盐度作为主要环境生态因子对水生生物的生长有重要影响。高盐环境中藻类数量及种类减少, 同时卤虫需要消耗能量泵出细胞中的钠离子以保持体内恒定的渗透压, 不利于卤虫的生长和存活(Triantaphyllidis et al, 1995; 王婧等, 2012; 隋丽英等, 2013)。微生物在高盐环境中为平衡自身渗透压消耗大量能量, 新陈代谢速度降低, 生长缓慢, 对底物利用率降低(崔有为等, 2004; Crump et al, 2004)。本研究中随盐度升高, 卤虫总生物量减少, 主要与盐度对卤虫生长和存活的胁迫作用有关。另外盐度升高使异养细菌生长缓慢, 对卤虫排泄物的分解和利用降低; 同时高盐条件下卤虫摄食量降低, 致使BFV增加。
盐度对水中氮浓度的影响与养殖动物的代谢及水中异养细菌有关。盐度升高, 卤虫生长缓慢, 新陈代谢下降, 水中无机氮水平较低。本研究中盐度升高,总氮浓度升高, 但对无机氮水平的影响无明显差异,可能由于异养细菌利用无机氮与卤虫排泄无机氮水平的能力相近, 但机理需作进一步研究。
黄凯等(2004)指出, 随着盐度升高, 凡纳滨对虾要失去一部分水分来平衡体内渗透压, 虾体蛋白质明显增加。而作为细胞膜磷脂双分子层的主要组成部分, 多不饱和脂肪酸(PUFA)和高不饱和脂肪酸(HUFA)的增加, 有利于鱼类和对虾细胞膜的柔韧性和渗透压调节(Watanabe, 1993; Palacio et al, 2004)。本研究中不同盐度下, 卤虫虫体粗蛋白含量、PUFA和HUFA组成变化不明显, 可能与卤虫作为广盐性甲壳动物本身具有较好的渗透压调节能力有关。细菌中缺乏PUFA和HUFA, 16:1 n-7和18:1 n-7为细菌主要的脂肪酸成分(Intriago et al, 1993)。本研究中虽然没有显著差异, 但添加碳源和较低盐度条件下培养的卤虫中两种脂肪酸的含量均比对照和“Glu+150”组有所提高, 说明卤虫摄食和利用了生物絮团中的细菌(Toi et al, 2013)。
3.3 碳源和盐度对生物絮团细菌多样性的影响
Marzorati等(2008)指出, 加权丰富度指数 Rr反映环境中菌群丰富度和环境的承载力(Carrying capacity)。Rr<10表明菌群丰富度低, 环境承载力差, 如污染的土壤或深海热泉生态系统; 10<Rr<30表明菌群丰富度和环境承载力处于中等水平; Rr>30则表明菌群丰富度高, 环境承载力大, 如活性污泥或种植土壤生态系统。本研究中碳源和盐度对絮团微生物多样性均有显著影响, Rr随着碳源的添加和盐度的升高而降低, 葡萄糖的添加有利于利用这种碳源的细菌生长, 而且较高盐度进对耐盐和嗜盐细菌的生长有利, 因此菌群丰富度逐渐降低, 系统承载力减弱。
部分特异性DGGE条带割胶回收测序结果表明,变形菌门细菌γ-proteobacterium在各实验组中均为优势菌群。Zhao等(2012)和夏耘等(2012)针对日本囊对虾和草鱼的研究均发现变形菌门细菌在生物絮团中占优势, 但ɑ-proteobacterium高于γ-proteobacterium。变形菌门细菌的主要功能是清除污水中的有机物(Wanger et al, 1995; Witzig et al, 2002)。本研究中γ-proteobacterium 占优势, 表明该条件下形成的生物絮团对卤虫养殖水体具有有效的调节作用。
4 结语
综上所述, 在零换水卤虫养殖系统中, 添加葡萄糖可显著促进生物絮团的形成, 提高卤虫生物量, 减低水体中的氮浓度。盐度升高, 卤虫生物量降低, 生物絮团体积显著增加, 亚硝酸盐和总氮水平升高。添加碳源和不同盐度对卤虫的粗蛋白和脂肪酸含量无显著影响。生物絮团中以γ-变形菌纲细菌为优势菌群,添加碳源和升高盐度显著降低细菌菌群的加权丰富度指数(Rr)。今后可针对不同碳源和采用异养细菌调控等方面, 深入研究高盐条件下生物絮团的形成机制。考虑到生产实际, 应进一步实验农业和食品工业的副产品等低成本碳源在卤虫养殖中的应用前景。
致谢本研究中生物絮团 DGGE分析在比利时根特大学Laboratory of Aquaculture & Artemia Reference Center进行, 得到Prof. Gilbert van Stappen, Prof. Peter Bossier, Dr. Peter de Schryver和 Dr. Yufeng Niu的大力支持, 天津农学院、天津市水产生态及养殖重点实验室王晓梅教授和天津科技大学王静副教授在DGGE条件摸索和数据处理等方面提供帮助, 谨致谢忱。
王 婧, 隋丽英, 贺 华等, 2012. 山东埕口盐场海欣分场卤虫种群生态调查. 生态学杂志, 31(11): 2848—2854
邓应能, 赵 培, 孙运忠等, 2012. 生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果. 渔业科学进展,33(2): 69—75
赵 培, 2011. 生物絮团技术在海水养殖中的研究与应用. 上海: 上海海洋大学博士学位论文
夏 耘, 郁二蒙, 谢 骏等, 2012. 基于PCR-DGGE技术分析生物絮团的细菌群落结构. 水产学报, 36(10): 1563—1571
黄 凯, 王 武, 卢 洁等, 2004. 盐度对南美白对虾的生长及生化成分的影响. 海洋科学, 28(9): 20—25
崔有为, 王淑莹, 宋学起等, 2004. NaCl盐度对活性污泥处理系统的影响. 环境工程, 22(1): 19—21
隋丽英, 王 婧, 贺 华等, 2013. 盐度对不同卤虫品系存活和生殖性能的影响. 海洋科学, 37(11): 41—47
Avnimelech Y, 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture, 176(3—4): 227—235
Avnimelech Y, 2006. Bio-filters: the need for an new comprehensive approach. Aquaculture Engineering, 34(3):172—178
Avnimelech Y, 2012. Biofloc Technology. Baton Rouge, LA:World Aquaculture Society, 48
Ben-Dov E, Kramarsky-Winter E, Kushmaro A, 2009. An in situ method for cultivating microorganisms using a double encapsulation technique. FEMS Microbiology Ecology,68(3): 363—371
Boon N, De Windt W, Verstraete W et al, 2002. Evaluation of nested PCR-DGGE (denaturing gradient gel electrophoresis)with group-specific 16S rRNA primers for the analysis of bacterial communities from different wastewater treatment plants. FEMS Microbiology Ecology, 39(2): 101—112
Burford M A, Thompson P J, McIntosh R P et al, 2003. Nutrient and microbial dynamics in high-intensity, zero-exchange shrimp ponds in Belize. Aquaculture, 219(1—4): 393—411
Chen Y, Dumont M G, Neufeld J D et al, 2008. Revealing the uncultivated majority: combining DNA stable-isotope probing, multiple displacement amplification and metagenomic analyses of uncultivated Methylocystis in acidic peatlands. Environmental Microbiology, 10(10):2609—2622
Crab R, Defoirdt T, Bossier P et al, 2012. Biofloc technology in aquaculture: beneficial effects and future challenges.Aquaculture, 356—357: 351—356
Crab R, Kochva M, Verstraete W et al, 2009. Bio-flocs technology application in over-wintering of tilapia.Aquaculture Engineering, 40(3): 105—112
Crump B C, Hopkinson C S, Sogin M L et al, 2004. Microbial biogeography along an estuarine salinity gradient: combined influences of bacterial growth and residence time. Applied and Environmental Microbiology, 70(3): 1494—1505
D'agostino A S, 1980. The vital requirements of Artemia:physiology and nutrition. In: Persoon G, Sorgeloos P, Roels O et al eds. The Brine Shrimp Artemia. Vol 2, Physiology,Biochemistry, Molecular Biology. Wetteren: Universa Press,55—82
De Schryver P, Crab R, Defoirdt T et al, 2008. The basics of bio-flocs technology: the added value for aquaculture.Aquaculture, 277(3—4): 125—137
Emerenciano M, Ballester E L C, Cavalli1 R O et al, 2012.Biofloc technology application as a food source in a limited water exchange nursery system for pink shrimp Farfantepenaeus brasiliensis (Latreille, 1817). Aquaculture Research, 43(3): 447—457
Hargreaves J A, 2006. Photosynthetic suspended-growth systems in aquaculture. Aquaculture Engineering, 34(3): 344—363
Hari B, Madhusoodana K B, Varghese J T et al, 2004. Effects of carbohydrate addition on production in extensive shrimp culture systems. Aquaculture, 241(1—4): 179—194
Hari B, Madhusoodana K B, Varghese J T et al, 2006. The effect of carbohydrate addition on water quality and the nitrogen budget in extensive shrimp culture systems. Aquaculture,252(2—4): 248—263
Harwati T U, Kasai Y K, Susilaningsih D et al, 2007.Characterization of diverse hydrocarbon-degrading bacteria isolated from Indonesian Seawater. Microbes and Environments, 22(4): 412—415
Intriago P, Jones D A, 1993. Bacteria as food for Artemia.Aquaculture, 113(1—2): 248—263
Lepage G, Roy C C, 1984. Improved recovery of fatty acid through direct transesterification without prior extraction or purification. Journal of Lipid Research, 25(12): 1391—1396
Liu W C, Li C Q, Zhu P et al, 2010. Phylogenetic diversity of culturable fungi associated with two marine sponges:Haliclona simulans and Gelliodes carnosa, collected from the Hainan Island coastal waters of the South China Sea.Fungal Diversity, 42(1): 1—15
Marzorati M, Wittebolle L, Boon N et al, 2008. How to get more out of molecular fingerprints: practical tools for microbial ecology. Environmental Microbiology, 10(6): 1571—1581
Muyzer G, De Waal E C, Uitterlinden A G, 1993. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Applied and Environmental Microbiology, 59(3): 695—700
Oehmen A, Yuan Z, Blackall L L et al, 2005. Comparison of acetate and propionate uptake by polyphosphate accumulating organisms and glycogen accumulating organisms. Biotechnology and Bioengineering, 91(2): 162—168
Palacios E, Bonilla A, Pérez A et al, 2004. Influence of highly unsaturated fatty acids on the responses of white shrimp(Litopenaeus vannamei) postlarvae to low salinity. Journal of Experimental Marine Biology and Ecology, 299(2):24—215
Ronald L, Van Stappen G, Van Hoa N et al, 2013. Effect of carbon/nitrogen ratio manipulation in feed supplements on Artemia production and water quality in solar salt ponds in the Mekong Delta, Vietnam. Aquaculture Research, 45(12):1906—1912, http://dx.doi.org./ 10.1111/are.12135
Schneider O, Sereti V, Eding E H et al, 2005. Analysis of nutrient flows in integrated intensive aquaculture systems.Aquaculture Engineering, 32(3—4): 379—401
Schveitzer R, Arantes R, Costódio P F S et al, 2013. Effect of different biofloc levels on microbial activity, water quality and performance of Litopenaeus vannamei in a tank system operated with no water exchange. Aquaculture Engineering,56: 59—70
Sorgeloos P, Dhert P, Candreva P, 2001. Use of the brine shrimp Artemia spp., in marine fish larviculture. Aquaculture, 200(1—2): 147—159
Sui L Y, Wang J, Nguyen V H et al, 2013. Increased carbon and nitrogen supplementation in Artemia culture ponds results in higher cyst yields. Aquaculture International, 21(6): 1343—1354
Toi H T, Boeckx P, Sorgeloos P et al, 2013. Bacteria contribute to Artemia nutrition in algae-limited conditions: A laboratory study. Aquaculture, 388—391: 1—7
Triantaphyllidis G V, Poulopoulou K, Abatzopoulos T J et al,1995. International study on Artemia XLIX. Salinity effects on survival, maturity, growth, biometrics, reproductive and lifespan characteristics of a bisexual and a parthenogenetic population of Artemia. Hydrobiologia, 302(3): 215—227
Vanhaecke P, Siddall S E, Sorgeloos P, 1984. International study on Artemia XXXII. Combined effects of temperature and salinity on the survival of Artemia of various geographical origin. Journal of Experimental Marine Biology and Ecology,80(3): 259—275
Wanger M, Erhart R, Amann R et al, 1995. In situ identification of ammonia-oxidizing bacteria. Systematic and Applied Microbiology, 18(2): 251—264
Watanabe T, 1993. Importance of docosahexaenoic acid in marine larval fish. Journal of the World Aquaculture Society, 24(2):152—161
Wilén B M, Jin B, Lant P, 2003. The influence of key chemical constituents in activated sludge on surface and flocculating properties. Water Research, 37(9): 2127—2139
Witzig R, Manz W, Rosenberger S et al, 2002. Microbiological aspects of a bioreactor with submerged membranes for aerobic treatment of municipal wastewater. Water Research,36(2): 394—402
Xu W J, Pan L Q, 2012. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed. Aquaculture, 356—357: 147—152
Yu Z T, Morrison M, 2004. Comparisons of different hypervariable regions of rrs Genes for use in fingerprinting of microbial communities by PCR-Denaturing Gradient Gel Electrophoresis. Applied and Environmental Microbiology,70(8): 4800—4806
Zhao P, Huang J, Wang X H et al, 2012. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus. Aquaculture,354—355: 97—106
