鲍内脏肽粉的抗氧化活性研究
2015-03-08吴靖娜
吴靖娜
(1.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;
2.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013)
鲍内脏肽粉的抗氧化活性研究
吴靖娜1,2
(1.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;
2.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013)
摘要:建立了酒精诱导的氧化应激小鼠模型,通过检测模型组、对照组和各给药组的小鼠血清和肝脏组织中的丙二醛(MDA)、蛋白质羰基含量(PCO)、总超氧化物歧化酶(T-SOD)、总抗氧化能力(T-AOC)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-PX)的变化来评价鲍内脏肽粉(AVPP)的抗氧化活性.结果表明,长期低浓度的酒精摄入可显著提高小鼠的MDA和PCO含量,降低T-SOD和T-AOC活力(P<0.05),对小鼠具有一定的氧化损伤作用,建模方式可行.AVPP可显著降低模型小鼠的MDA和PCO含量,提高T-SOD、T-AOC、GSH和GSH-PX活力,对小鼠的氧化损伤可起到保护作用,具有较好的抗氧化活性.
关键词:鲍内脏肽粉; 抗氧化; 小鼠; 酒精
氧化应激源自内源性抗氧化物防御体系与生成自由基间的不平衡,在正常生理状态下,机体具有纠正这种不平衡的能力[1],然而衰老及不利的环境因素会引起这种代谢失衡,导致自由基的积累,破坏生物大分子的结构和功能,从而引起一系列的病理过程[2-3].随着人们生活水平的提高,抗氧化与抗衰老问题越来越受到人们的关注,目前临床证实有效且应用较多的外源性抗氧化活性物质有维生素C、维生素E、D-甘露醇等[4].近年来,随着海洋生物资源开发的研究不断深入,通过补充源于海洋生物的抗氧化活性因子来调整自由基的平衡已成为机体氧化损伤修复的研究热点[5-6].鲍内脏含有丰富的蛋白质、维生素等营养成分及一些生物活性物质,鉴此,为了进一步验证其抗氧化功效,本项目组对鲍内脏抗氧化活性肽制备工艺进行了研究,并通过体外化学和细胞试验证明其具有较好的抗氧化功效,因此,本文期望通过体内实验对其抗氧化功效进行进一步验证,从而为鲍内脏多肽功能产品的开发提供理论支持.
建立具代表性的和可靠的氧化应激动物模型是进行体内评价的重要前提,目前的制模方式主要有外源性(给予受试动物D-半乳糖、四氯化碳等)和内源性(基因改良型模型)两种制模方式[7],但是它们主要是局部氧化应激模型,而对于更具意义的系统性氧化应激模型的研究却仍然较少.酒精是一种具有高渗透性的氧化应激源,研究表明,酒精经醇脱氢酶(ADH)、微粒体酒精氧化系统(MEOS)、过氧化氢酶(Catalase)催化代谢[8]后,会产生过量的活性氧自由基(reactive oxygen species, ROS)、活性氮自由基(reactive nitrogen species, RNS)以及导致体内不利微环境的形成[9],如组织缺氧、细胞因子释放等,酒精所诱发的损伤可以波及机体的各个组织器官[10],它是诱导组织氧化应激的方式之一.本研究采用长期摄入低浓度酒精的方式来建立小鼠氧化应激模型,并在试验过程中分不同时期给予不同剂量的鲍内脏肽粉,借此来对其抗氧化活性进行评价.
1材料与方法
1.1材料与仪器鲍内脏肽粉(AVPP):福建省水产研究所研制;SPF级8周龄KM雄性小鼠,体重(25±5)g:购自上海斯莱克动物有限公司;抗坏血酸(分析纯):购于西陇化工股份有限公司;无水乙醇(分析纯):购于国药集团化学试剂有限公司;生理盐水(0.9%):购于福州海王福药制药有限公司.
丙二醛(malonic dialdehyde, MDA)、总超氧化物歧化酶(total superoxide dismutase, T-SOD)、总抗氧化能力(total antioxidant capacity, T-AOC)、谷胱甘肽(glutathione ,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase ,GSH-Px)、蛋白质羰基含量(protein carbonyl content, PCO)、蛋白定量测试盒均购于南京建成生物制品研究所.
UV-3200紫外可见分光光度计:上海美谱达; HH-6小型三用恒温水浴箱:国华电器有限公司;5810R台式高速大容量冷冻离心机:德国Eppendorf 公司;BS124S型分析天平:赛多利亚科学仪器(北京)有限公司;JXFSTPRP系列F6/10手持式高速显匀浆机:上海净信实业发展有限公司.
1.2方法试验
1.2.1动物试验设计72只KM小鼠在温度(21±2)℃,相对湿度(65±10)%的动物房适应1周后,按体重随机将其分为6组,每组12只,第Ⅰ组:正常对照组;第Ⅱ组:酒精模型组;第Ⅲ组:VC阳性对照组(200 mg/kg·wb);第Ⅳ~Ⅵ组:AVPP低(100 mg/kg·wb)、中(200 mg/kg·wb)、高(300 mg/kg·wb)剂量组.
每隔7 d称1次小鼠体重,实验期共持续5周:预防性干预期(第1周),第Ⅰ组与第Ⅱ组以0.3 mL生理盐水灌胃;第Ⅲ组给予0.3 mL VC溶液灌胃;第Ⅳ、Ⅴ、Ⅵ各组按比例给予0.3 mL(低、中、高浓度) AVPP水溶液灌胃.试验期(第2周~第5周),第Ⅰ组每天给予0.3 mL生理盐水灌胃;第Ⅱ组每天给予0.3 mLφ=25 %的酒精灌胃;第Ⅲ组给予0.3 mLφ=25 % 的酒精与VC(200 mg/kg·wb)的混合液灌胃;第Ⅳ、Ⅴ、Ⅵ组分别给予0.3 mLφ=25 % 的酒精与100 mg/kg·wb、200 mg/kg·wb、300 mg/kg·wb相应剂量AVPP混合液灌胃[11].所有小鼠自由摄食饮水,试验结束后,动物禁食24 h后,经眼静脉取血,同时以颈椎脱臼法处死,取肝脏,用生理盐水洗净后,置于离心管中,于-80 ℃储存,待测.
1.2.2抗氧化功能指标测定 取血,静置10 h后,在4 ℃以 3 000 r·min-1离心10 min(制备血清),并按测试盒的说明分别测定血浆的MDA含量、T-SOD活性 和T-AOC活性.
取肝脏,1份用适量的w=0.9 %的生理盐水配成w=10 %的肝脏匀浆液,以2 500 r·min-1离心10 min,然后测定肝脏组织中的蛋白质含量、MDA含量、T-SOD活性、GSH和GSH-PX活性;1份用PCO测试剂的匀浆介质配成w=10 % 的肝脏匀浆液,并以2 500 r·min-1离心10 min,用以测定肝脏组织中的PCO.
1.3统计分析采用SPSS 16.0软件对数据进行处理,用单因子方差分析(One-way ANOVN, Duncan)进行差异显著性分析,数据以均值±标准差(X±SD)表示.
2结果与分析
2.1对小鼠体重的影响体重指标可以在一定程度上反应小鼠的生长发育情况.在整个饲养过程中,各组小鼠均活泼好动,食欲良好,皮毛顺滑有光泽.由表1可知,小鼠适应喂养1周后(第1天),各组小鼠体重均衡,无显著差异(P>0.05);随着喂养时间的增加,各组小鼠体重都有所增加,其中酒精模型组(Ⅱ)、Vc阳性对照组(Ⅲ)、低剂量AVPP(Ⅳ)组、高剂量AVPP (Ⅵ)组与正常对照组(Ⅰ)间无显著差异(P>0.05),说明灌胃酒精、VC、低剂量以及高剂量AVPP对小鼠的体重、生长发育未造成明显的影响;灌胃第7天开始,中剂量AVPP( Ⅴ)组的小鼠体重与正常对照组(Ⅰ)间有显著差异(P<0.05),说明中剂量AVPP灌胃对小鼠体重有一定的增长作用.
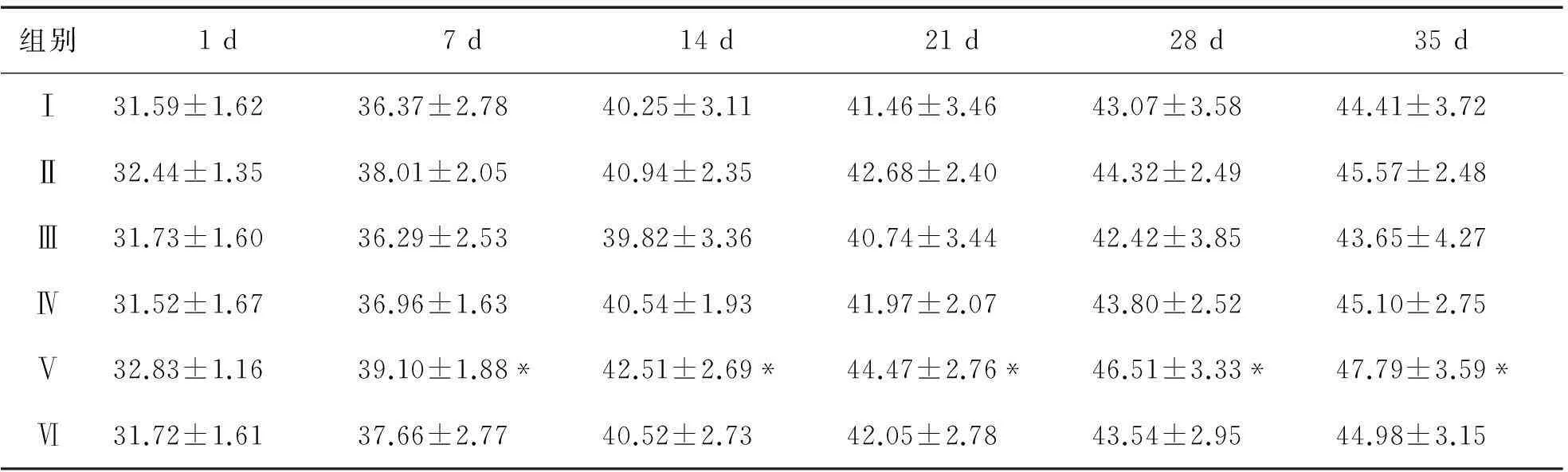
表1 实验期间各组小鼠的体重变化
注:Ⅰ—正常对照组;Ⅱ—酒精模型组;Ⅲ—Vc阳性对照组;Ⅳ—低剂量AVPP组;V—中剂量AVPP组;Ⅵ—高剂量AVPP组;*表示与Ⅰ组相比差异显著(P<0.05).
2.2对小鼠血清MDA含量、T-SOD活力和T-AOC活力的影响从图1-A可知,酒精模型组小鼠血清的MDA含量为10.06 nmol·mL-1,明显高于正常对照组(P<0.05),这表明长期的酒精摄入对小鼠造成了一定程度的脂质氧化损伤;VC、低、中、高AVPP剂量组的MDA含量比酒精模型组分别少了2.77,1.35,1.69,3.59 nmol·mL-1,其中,VC、高剂量AVPP组与酒精模型组的差异具有统计学意义(P<0.05),而与正常对照组的差异不显著(P>0.05).
经口灌胃35 d后(见图1-B),酒精模型组小鼠血清的T-SOD活力为248.36 U·mL-1,显著低于正常对照组的215.98 U·mL-1(P<0.05),表明长期的酒精灌胃对小鼠具有一定的氧化应激损伤作用;与酒精模型组相比,各组小鼠血清中 T-SOD活力均有所升高,VC、低、中、高AVPP剂量组的T-SOD活力分别升高了 17.59,9.72,32.74,29.54 U·mL-1,其中,中、高AVPP剂量组的T-SOD活力显著高于酒精模型组(P<0.05),与正常对照组无显著差异(P>0.05),这表明AVPP能显著提高血液中T-SOD的活力.
由图1-C发现,酒精模型组小鼠血清的T-AOC明显低于正常对照组(P<0.05),表明酒精对小鼠的健康状况造成了一定的影响,致使小鼠的总抗氧化能力减弱;各组小鼠血清的T-AOC均高于酒精模型组,分别高出4.52,7.11,8.30,9.62 U·mL-1,且差异均达到显著水平(P<0.05),表明Vc和AVPP对小鼠都有抗氧化保护作用,能增强小鼠的总抗氧化能力.
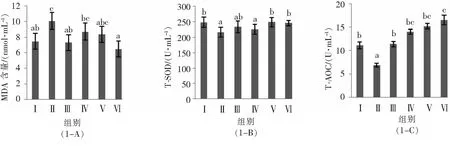
图1 对小鼠血清中MDA、T-SOD和T-AOC的影响
注:同列数值中标注不同字母表示对应组别间差异显著(P<0.05);反之,标注相同字母则表示对应组别间差异不显著(P>0.05);图2同
2.3对小鼠肝脏MDA、PCO、SOD、GSH和GSH-PX活性的影响如图2-A所示,酒精模型组小鼠肝脏的MDA含量均高于其他组,比正常、 VC、 低、 中、 高AVPP剂量组分别高出了 3.66,7.32,1.86,6.18,7.80 nmol·mg-1prot,但差异均不显著(P>0.05).经口灌胃35 d后(见图2-B),酒精模型组小鼠肝脏的PCO明显高于正常对照组的PCO(P<0.05),表明酒精对小鼠机体的蛋白质造成了氧化损伤;酒精模型组的PCO比VC、低、中、高AVPP剂量组分别高出了8.81,4.25,11.17,16.14 nmol·mg-1prot,其中与高AVPP剂量组的差异达到显著水平(P<0.05).
由图2-C可以看出,T-SOD活力指标的测定效果较明显,酒精模型组小鼠肝脏的T-SOD活力显著低于正常对照组(P<0.05),说明长期摄入低浓度酒精会引起肝脏组织的氧化损伤;Vc、低、中、高AVPP剂量组小鼠肝脏的T-SOD活力比酒精模型组分别高出33.05,39.86,43.30,81.43 U·mg-1prot,且均达到显著水平(P<0.05).经口灌胃35 d后(见图2-D),酒精模型组小鼠肝脏的GSH含量与正常对照组差异不显著(P>0.05),表明酒精造模对小鼠GSH含量影响不大;VC阳性对照组和高AVPP剂量组的GSH含量显著高于酒精模型组的GSH含量(P<0.05),分别高出4.97 U·mg-1prot和5.59 U·mg-1prot.同时,由图2-E可发现,正常对照组小鼠肝脏的GSH-PX活力虽然略高于酒精模型组小鼠肝脏的GSH-PX活力,但是差异没有显著性意义(P>0.05),表明酒精摄入对小鼠GSH-PX活力的影响不大;VC阳性对照组和中剂量AVPP组小鼠肝脏的GSH-PX活力显著高于酒精模型组(P<0.05),分别高出71.72、41.24 U·mg-1prot.
图2 对小鼠肝脏组织MDA、PCO、SOD、GSH和GSH-PX的影响
3讨论
MDA是细胞膜脂质过氧化产物之一,其可进一步与磷脂酰乙醇胺和蛋白质交联,使细胞脆性增加和变形性降低,从而导致生物膜结构和功能的改变[12].PCO是蛋白质分子被自由基氧化修饰的一个重要标志物,它产生于活性氧攻击氨基酸分子中的自由氨基或亚氨基后最终生成的NH3和相应的羰基衍生物[13].因此,测定MDA和PCO含量能间接反映氧化应激状态下机体受损伤的程度.T-SOD、GSH-PX和GSH是体内重要的抗氧化酶系.T-SOD可有效地清除自由基反应的启动因子(O2-),抑制和阻断自由基,降低自由基代谢产物的生成[14];GSH-PX可特异地催化还原型GSH对过氧化物的还原反应,阻断由过氧化物所引发的自由基对机体的损害,保护细胞膜免受过氧化的损伤,亦可催化对生物体有害的H2O2的分解,减少自由基和过氧化脂质的形成;而GSH含量的多少是衡量机体抗氧化能力大小的重要因素;机体防御体系的T-AOC能力强弱与健康程度存在着密切联系[15].
本研究以长期低浓度的酒精摄入的方式建立了系统性氧化应激小鼠模型,结果显示,酒精模型组小鼠血清的MDA含量高于正常对照组,T-SOD和T-AOC活力均低于正常对照组(P<0.05),酒精模型组小鼠肝脏的PCO高于正常对照组,T-SOD活力低于正常对照组(P<0.05);表明长期低浓度的酒精摄入对小鼠具有一定的氧化损伤作用,建模方式可行.然而,虽然酒精模型组中小鼠肝脏的MDA含量高于正常对照组,而GSH和GSH-PX活力低于正常对照组,但是其差异不显著(P>0.05),为此,在酒精剂量、持续灌胃周期的选择上仍需进一步优化.
在摄入酒精进行造模的基础上又给小鼠灌喂VC和低、中、高剂量的AVPP,各剂量组小鼠血清的MDA含量相对于酒精模型组均有降低,T-SOD和T-AOC活力均有所升高,其中,VC、高剂量AVPP组的MDA含量,中、高剂量AVPP组的T-SOD活力,VC和低、中、高剂量AVPP组的T-AOC活力与酒精模型组的差异均达到显著水平(P<0.05);各剂量组小鼠肝脏组织的MDA和PCO含量相对于酒精模型组均有下降,T-SOD、GSH和GSH-PX活力均有所提高,其中,高剂量AVPP组的MDA含量,VC、低、中、高AVPP剂量组的T-SOD活力,VC和高剂量AVPP组的GSH含量,VC和中剂量AVPP组的GSH-PX活力与酒精模型组的差异均具有统计学意义(P<0.05).根据试验结果可判断AVPP 可以有效降低模型鼠的氧化损伤程度,保护机体免受自由棊损伤.同时,由试验结果还可发现,AVPP的中剂量组的综合指标明显优于低、高剂量组,因此,推断AVPP在200 mg/kg·wb的剂量下可发挥良好的抗氧化功效.
4结论
综上所述,通过小鼠长期摄入低浓度酒精造成小鼠的氧化损伤,可达到酒精造模的目的.从鲍内脏提取的AVPP可有效地清除自由基,保护机体内氧化-抗氧化平衡状态;降低MDA和PCO含量,提高T-SOD、T-AOC、GSH和GSH-PX活力,减少机体的细胞损伤,具有一定的抗氧化能力.
参考文献:
[1] Koch O R, Pani G, BorrellO S, et al. Oxidative stress and antioxidant defenses in ethanol-induced cell injury[J]. Molecular Aspects of Medicine, 2004, 25(1): 191-198.
[2] Roberts C K, Sindhu K K. Oxidative stress and metabolic syndrome[J]. Life Sciences, 2009, 84(21): 705-712.
[3] Rao A V, Balachandran B. Role of oxidative stress and antioxidants in neurodegenerative diseases[J]. Nutritional Neuroscience, 2002, 5(5): 291-309.
[4] 张小强, 浦跃朴, 尹立红, 等. 冬虫夏草及人工虫草菌丝体对超氧阴离子自由基和羟自由基清除作用的实验研究[J]. 中国老年学杂志, 2004, 23(11): 773-775.
[5] Gimenez B, Aleman A, Montero P, et al. Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J]. Food Chemistry, 2009, 114(3): 976-983.
[6] Bougatef A, Nedjar-arrouime N, Manni L, et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle (Sardinellaaurita) by-products proteins[J]. Food Chemistry, 2010, 118(3): 559-565.
[7] 刘小兵.几种功能性食品活性因子抗氧化能力评价技术的研究 [D].北京:中国疾病预防控制中心,2009.
[8] Shanmugam K R, Ramakrishna C H, Mallikarjuna K, et al. Protective effect of ginger against alcohol-induced renal damage and antioxidant enzymes in male albino rats[J]. Indian Journal of Experimental Biology,2010,2(48):143-149.
[9] Das S K, Vasudevan D M. Alcohol-induced oxidative stress[J]. Life Sciences, 2007, 81(3): 177-187.
[10] Wu D, Zhai Q, Shi X. Alcohol-induced oxidative stress and cell responses[J]. Journal of Gastroenterology and Hepatology, 2006, 21(3): 26-29.
[11] 刘小兵, 朴建华, 黄振武, 等. 酒精诱导氧化应激小鼠模型建立及姜黄素抗氧化活性的初步研究[J]. 中国食品卫生杂志, 2010, 22(3): 258-261.
[12] 马朝阳, 马淑凤, 王芳, 等. 芦笋提取物的抗氧化作用的研究[J]. 食品工业科技, 2012, 33(22): 365-368.
[13] Raghavendra V, Kulkami S K. Possible antioxidant mechanism in melatonin reversal of aging and chronic ethanol-induced amnesia in plus-maze and passive avoidance memory tasks[J]. Free Radical Biology and Medicine, 2001, 30(6): 595-602.
[14] 葛霞, 陈婷婷, 蔡教英, 等. 青钱柳多糖抗氧化活性的研究[J]. 中国食品学报, 2011, 11(5): 59-64.
[15] 唐静.不同剂量川牛膝多糖对小鼠抗氧化活性的影响 [D].四川:四川农业大学,2013.
Antioxidant Activity of Abalone Viscera Polypeptide
Wu Jingna1,2
(1. Fisheries Reasearch Instiute of Fujian, Key Laboratory of Cultivation and High-value
Utilization of Marine Organisms in Fujian Province, Xiamen 361013,China;
2. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, Xiamen 361013,China)
Abstract:In the report, an alcohol-induced oxidative stress mice model was established, and the mice were divided into model group and control group, which are administrated with AVPP, and the changes of malonic dialdehyde (MDA), protein carbonyl content (PCO), total superoxide dismutase (T-SOD), total antioxidant capacity (T-AOC), glutathione (GSH), glutathion peroxidase (GSH-Px)in plasma and liver were detected to determine the antioxidant activity of abalone viscera polypeptide. The results indicated that the MDA in plasma and PCO in liver of model were significantly higher than that in the control group (P<0.05), the activity of T-AOC in plasma and the activity of SOD both in plasma and in liver of model were lower than that in the control group (P<0.05), which suggested that the oxidative stress model could be established by lower concentration of alcohol for a long time; the MDA in plasma and PCO in liver of AVPP group were significantly reduced (P<0.05), the activity of T-AOC in plasma and the activity of SOD, GSH, GSH-PX both in plasma and in liver of AVPP group were decreased (P<0.05), which suggested that the AVPP has significant antioxidant activityinvivo.
Keywords:alcohol; mice; Abalone viscera polypeptide; antioxidant
中图分类号:TS 254.9
文献标志码:ADOl:10.15886/j.cnki.hdxbzkb.2015.0028
文章编号:1004-1729(2015)02-0152-06
收稿日期:------------------------ 2015-01-19基金项目: 国家海洋公益性科研专项(201405016); 福建省科技重大专项(2014NZ0001-1);厦门市海洋经济发展专项(14CZP041HJ15);福建省海洋高新产业发展专项(2013)
作者简介:吴靖娜(1984-),女,福建南安,硕士,助理研究员,研究方向:水产品加工与综合利用研究, E-mail: 31301863@qq.com.
