正交试验法优化黄粉虫甲壳素提取新工艺
2015-03-08岁姗姗
岁姗姗,周 祥,周 楷
(海南大学 环植学院,海南 海口 570228)
正交试验法优化黄粉虫甲壳素提取新工艺
岁姗姗,周祥,周楷
(海南大学 环植学院,海南 海口 570228)
摘要:以黄粉虫为原料,用酶水解蛋白质,有机酸去除灰分,提取甲壳素.通过正交试验对酶水解条件和有机酸处理条件进行优化.结果表明:酶水解最佳的处理为胰蛋白酶和木瓜蛋白酶按1∶1组合、酶用量为1.0%、水解时间为7 h,水解温度为55 ℃;有机酸最佳的组合为苹果酸处理组合,其酸浓度为15%,处理时间为10 h,固液比为1∶50 (g·mL-1).在此条件下所得到的甲壳素,其蛋白质含量为3.39%,灰分含量为0.35%.
关键词:甲壳素; 蛋白酶; 有机酸; 正交试验
甲壳素又称壳多糖,是自然界中仅次于纤维素的第二大生物资源,被认为是继蛋白质、糖、脂肪、纤维素、矿物质之后的“第六生命要素”[1-2].目前,甲壳素及其衍生物在食品、医药、环保、功能材料的制作、农林业、轻纺工业等领域得到广泛应用,具有巨大的经济价值和广泛的应用前景[3-4].
用于制备甲壳素的原料主要是虾、蟹壳,但是近年来,随着昆虫资源的大量开发,利用昆虫生产甲壳素已经成为热点.王稳航等人利用盐场废弃物卤蝇蛆壳提取了甲壳素和壳聚糖[5].曹小红等人在利用蝇蛆提取甲壳素中确定了酸法脱灰分,碱法除蛋白质和脂肪的最佳工艺条件[6].詹永乐等人优化了利用蚕蛹皮制取甲壳素的工艺条件[7].王敦等人以金龟子为材料对甲壳素的提取进行了研究[8].另外,以松毛虫、蚂蚁、蝉等虫类为材料来提取甲壳素的报道已有不少.由于昆虫中钙物质的含量低,而甲壳素的含量却比虾蟹高出 5% ~10%,因此从昆虫中比从虾、蟹壳中可得到较多的甲壳素[9].在当前我国壳聚糖资源十分短缺的情况下,开发昆虫甲壳素资源无疑具有十分重要的意义.黄粉虫是一种仓储害虫,在室内容易饲养,其繁殖速度快、生产周期短、投资少[10].目前,以黄粉虫为原料来生产饲料添加剂、保健食品、营养液、焙烤食品的研究己取得了一些进展,然而,国内外对黄粉虫资源的开发多集中在对其蛋白质资源的利用上,而在黄粉虫甲壳素资源的开发利用方面还处于研究阶段,但是随着近年来黄粉虫产业的不断壮大,以黄粉虫作为甲壳素的提取原材料具有良好的开发利用价值.
目前,提取甲壳素最常用的方法是传统的酸碱法[11].其中,最核心的部分是利用强酸浸泡去除灰分和利用强碱浸泡去除蛋白质和脂类物质,但此法的酸碱耗量大、能耗高,且会产生大量的酸碱废液.近年来人们尝试对传统酸碱法做了很多改进,并取得了一定效果,如有机酸法、蛋白酶法、微生物发酵[12]等.鉴此,本试验利用黄粉虫资源,用酶水解蛋白质、以有机酸去除灰分来提取甲壳素,并按L9(34)正交表进行试验,旨在寻找以有机酸结合蛋白酶来提取黄粉虫甲壳素的最佳工艺条件,在不污染环境的前提下,为黄粉虫资源的综合利用提供基础的研究资料.利用有机酸结合蛋白酶法提取甲壳素不仅能避免传统酸碱法提取过程中因大量酸碱废弃液而造成的环境污染,而且还能将脱蛋白后的酶解液制成氨基氮(作为海鲜调味品),回收有机酸钙,实现资源的循环利用.
1材料与方法
1.1材料原料:黄粉虫(TenebriomolitorLinnaeus),常温下饲养,主要喂食麦麸,定期收集.
试剂:石油醚(沸程60~90 ℃)(广州化学试剂厂);胰蛋白酶、木瓜蛋白酶(上海佳和生物科技有限公司);醋酸柠、檬酸、苹果酸(食品级);盐酸(分析纯);硫酸钾、硫酸铜、硼酸、硫酸(分析纯);蒸馏水.
仪器:电热恒温鼓风干燥箱(上海-恒科学仪器有限公司);电子分析天平(BS-600L型 ,上海精密科学仪器有限公司);数显恒温水浴锅(常州澳华仪器有限公司);电子万用炉(220 V,1 000 w,天津市泰斯特仪器有限公司);电阻炉(220 V,1 500 w,上海-恒科学仪器有限公司);80-2B台式离心机;凯氏定氮装置;
1.2方法 收集黄粉虫,烘干,研碎,按1∶12的比例加入石油醚,60 ℃恒温水浴,制得脱脂虫粉后,选择几种最适温度为50~60 ℃范围内的酶[13]作为酶制剂,如胰蛋白酶、木瓜蛋白酶、复合酶(胰蛋白酶∶木瓜蛋白酶=1∶1)等,以酶制剂、酶用量、水解时间、水解温度为自变量,并以残余蛋白含量为指标,设计四因素三水平的正交试验,对蛋白质水解条件进行优化.以(柠檬酸、苹果酸、酸醋)有机酸、酸浓度、处理时间、固液比为自变量,以残余灰分为指标,设计正交试验,对去灰分条件进行优化,最终得到黄粉虫甲壳素提取的最佳工艺条件.
残余蛋白的测定:采用凯氏定氮法[14],计算公式为:
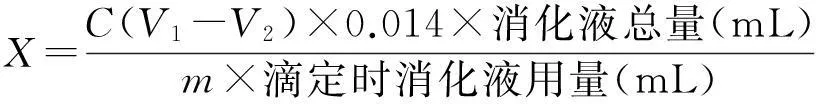
式中,X为样品中蛋白质的含量(%);C为标准盐酸溶液的浓度(mol·L-1);V1为滴定样品消耗的盐酸量(mL);V2为滴定空白消耗的盐酸量(mL);m为样品质量(g);
残余灰分的测定:参照卫生部GB/T5009.4—2010的方法[15]以及550 ℃灼烧法[16].计算公式为:灰分=[(Wt-W0)/(W-W0)]×100% ,式中,W0为空坩埚质量(g);Wt为灰化后坩埚+灰分的质量(g);W为空坩埚+样品的质量(g).
数据处理:利用SPSS16.0统计软件进行方差分析,Sig值小于0.05被认为因素之间有显著性差异,Sig值小于0.01被认为差异是极显著的.
2结果与分析
2.1蛋白质水解正交试验的结果分析
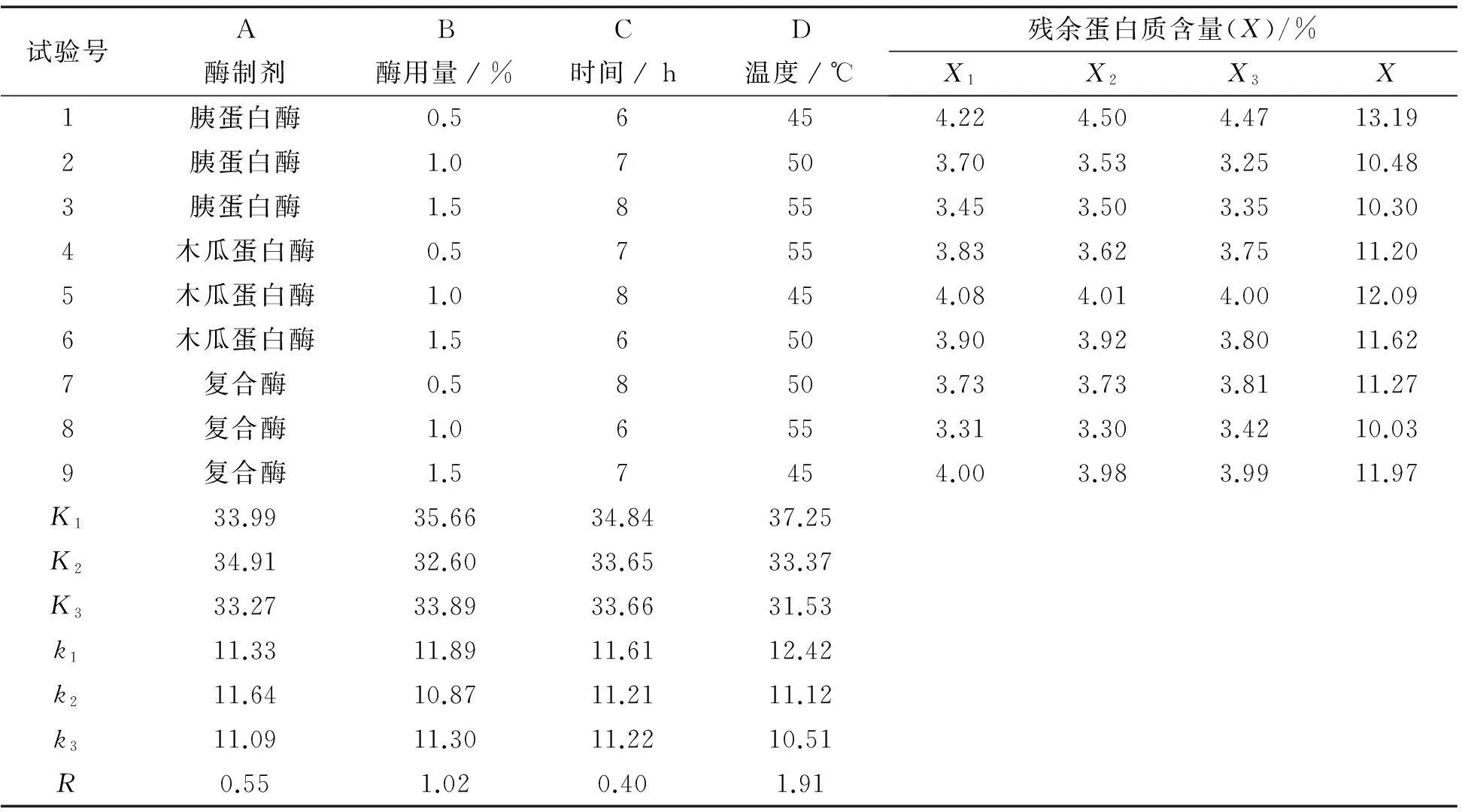
表1 蛋白质水解正交试验结果

表2 方差分析表
R方 = .927(调整R方 = .895)
蛋白质水解正交试验结果见表1,在蛋白质水解L9(34) 正交试验中,残余蛋白质含量为水解程度指标,通过比较k值可以看出,A3、B2、C2、D3为各因素水平最优.
表中R值反应各因素的主次,在表1中因素D的极差最大,说明水解温度为影响蛋白质水解的主要因素,其次是酶用量和酶制剂,处理时间是影响最小的因素.
从方差分析表2可以知道,在试验中A、B、C、D4个因素对试验的影响均显著,Sig值小于0.05,其中A、B、D3个因素对试验的影响是极显著的(Sig值小于0.01).比较F值可以得出,因素的主次顺序依次是D>B>A>C,与极差分析基本吻合.
经综合极差与方差分析确定,蛋白质水解的最优组合为D3B2A3C2,即胰蛋白酶和木瓜蛋白酶按1∶1组合、酶用量为1.0%、水解时间为7h,水解温度为55 ℃.
2.2有机酸去除灰分的正交试验结果分析
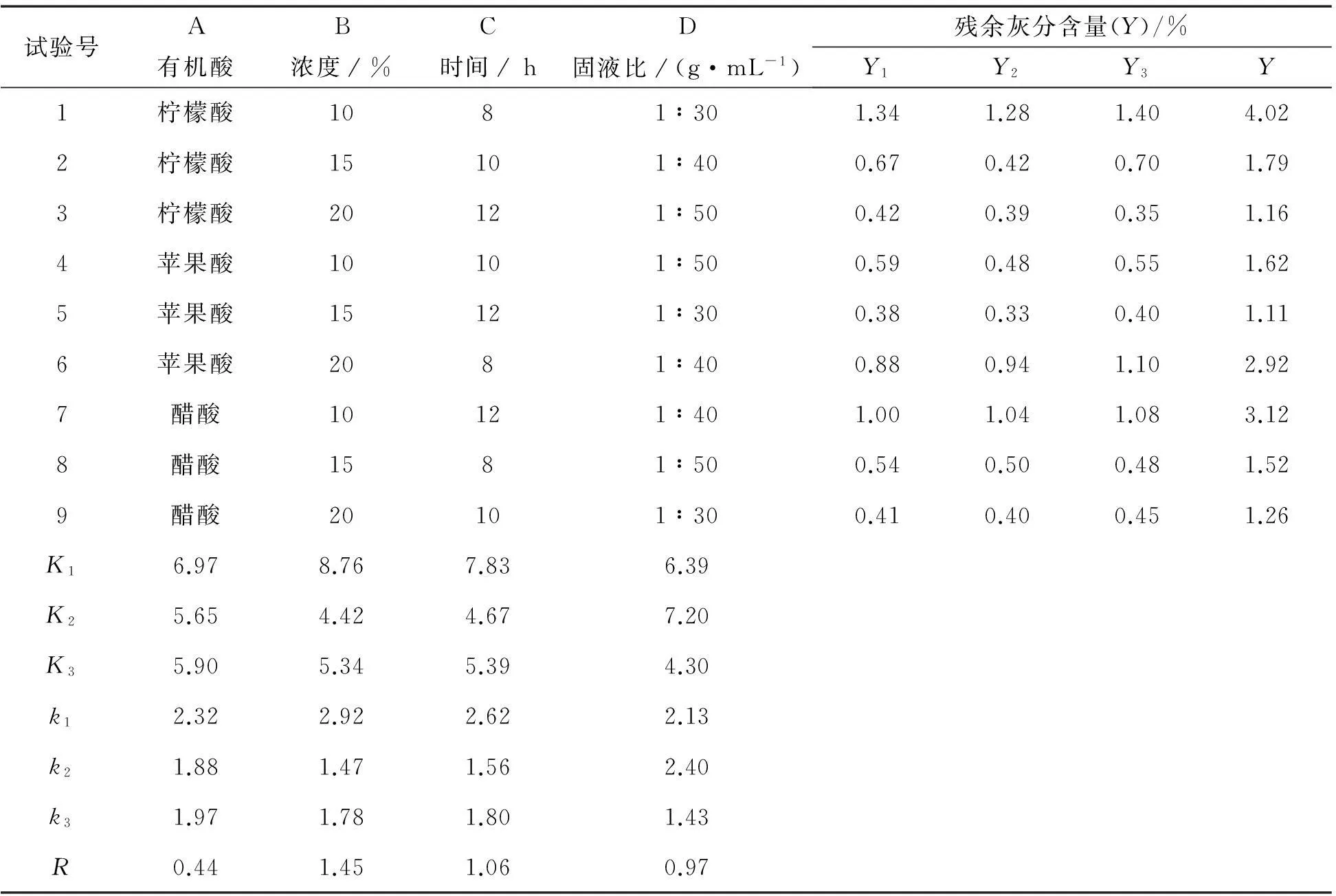
表3 有机酸去灰分的正交试验结果
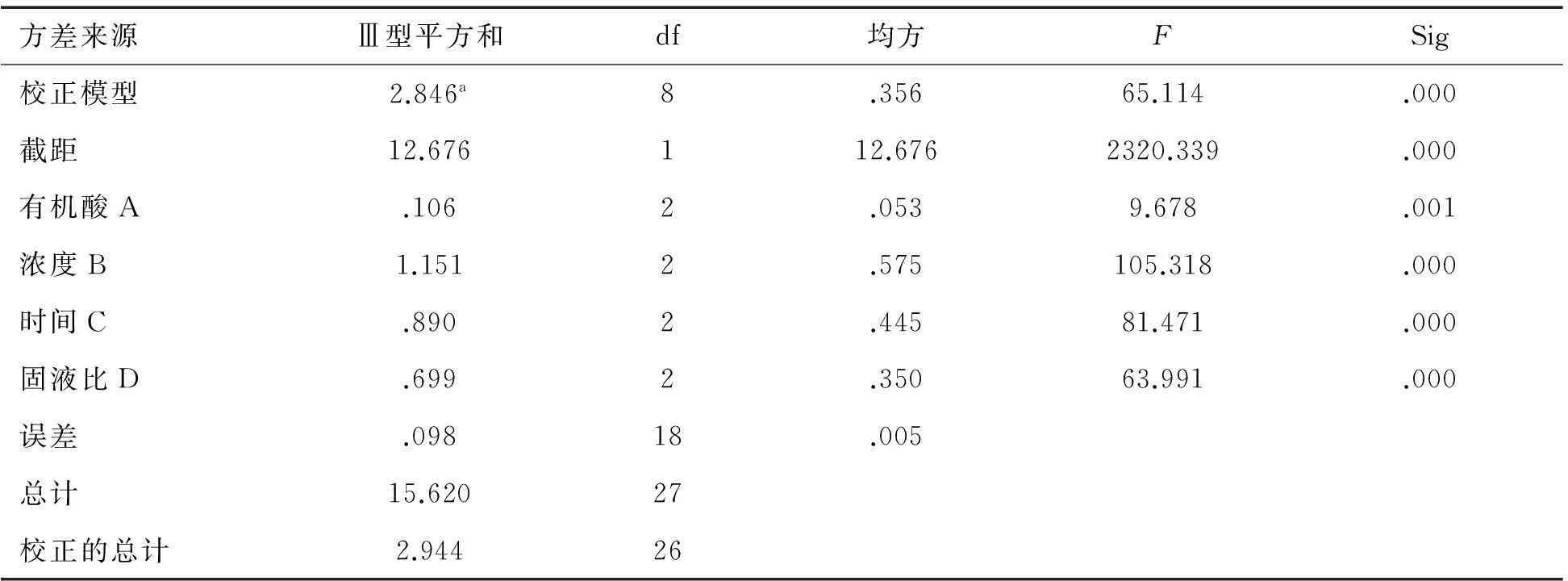
表4 方差分析表
R方 = .967(调整R方 = .952)
有机酸去除灰分正交试验结果见表3,通过比较k值可以确定,各因素的最优水平为A2、B2、C2、D3,从表3中的R值可以判断,各因素中,去除灰分的效果顺序依次是B>C>D>A,即酸浓度>处理时间>固液比>有机酸,由此可见,酸浓度对去除灰分的影响最大,其次是处理时间、固液比,而有机酸对去除灰分的影响最小.从表4的方差分析中可以看出,在去除灰分的正交试验中,4个因素对去除效果的影响均是极显著的Sig值皆小于0.01.综合表3和表4可以得出,去除灰分的最佳处理组合为B2C2D3A2,即苹果酸处理,酸浓度为15%,处理时间为10 h,固液比为1∶50.
2.3正交试验结果检验蛋白质水解的最优组合:胰蛋白酶和木瓜蛋白酶按 1∶1组合、酶用量为1.0%、水解时间为7 h、水解温度为55 ℃;去灰分的最佳组合:用苹果酸处理,酸浓度为15%,处理时间为10 h,固液比为1∶50.为了检验甲壳素中残余蛋白质与残余灰分的含量,在上述最优条件下,重复3次提取,甲壳素测定结果如表5所示,最终得到的甲壳素蛋白质含量为3.39%,灰分含量为0.35%.
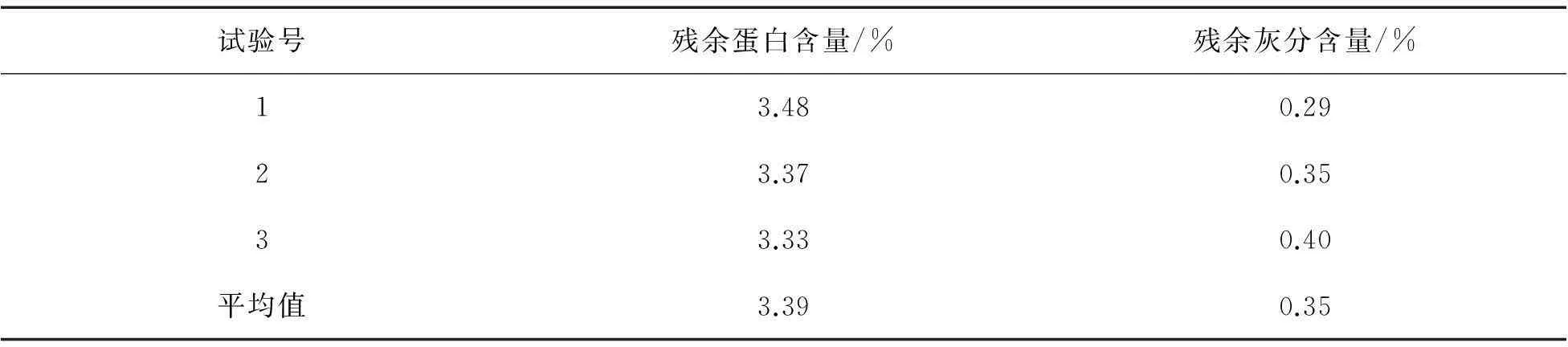
表5 正交试验结果的检验
3小结与讨论
本试验主要针对黄粉虫甲壳素提取过程中的两个主要阶段的多个影响因素,设置了4因素3水平的正交试验,选择L9(34)正交表,由于正交表各列因素已经排满,为了减小误差,在同一处理上重复了3次试验,增加了试验数据的可信度,得出酶水解最佳的处理组合为:胰蛋白酶和木瓜蛋白酶按1∶1组合、酶用量为1.0%、水解时间为7 h、水解温度为55 ℃,在4个影响因素中水解温度是影响蛋白质水解的主要因素,其次是酶用量、酶制剂,处理时间是影响最小的因素.有机酸处理组合为:苹果酸、酸浓度为15%、处理时间为10 h、固液比为1∶50.其中,酸浓度对灰分的去除影响最大,其次是处理时间、固液比,有机酸的影响最小.通过检验在此最佳提取条件下所得到甲壳素,其蛋白质含量为3.39%,灰分含量为0.35%.
甲壳素的提取大多采用传统酸碱法,即以强碱去蛋白质,以强酸去除灰分,虽然采用传统的酸碱法来提取甲壳素,其成本低,且工艺简单,但该法所耗的酸量较大、能耗较高,而且会产生大量的酸碱废弃液,并且在强酸条件下甲壳素容易降解.近年来,对传统法的改进层出不穷,如有微生物发酵法,此法的反应条件温和,能改善传统方法中的一些弊端,所得到的甲壳素分子量亦较高,且蛋白质等成分也能回收利用,但此法耗时较长,需要发酵罐等设备,工艺亦较为复杂,此外,此法还处于研究阶段.而本试验采用有机酸结合蛋白酶法来提取甲壳素,其工艺简单,不仅能在温和的条件下进行反应,而且能回收酶解液中的蛋白质等成分,解决了环境污染问题,此外,该法避免了因有机酸的酸性较低而致使甲壳素不易发生水解的问题,可得到高分子量的甲壳素,并且能获得高品质的甲壳素,可使甲壳素中残余灰分的含量小于1%.本试验通过正交试验方差分析确定了酶水解去除灰分的最佳条件,并且进行了试验验证,最终获得了有机酸结合蛋白酶法提取黄粉虫甲壳素的最佳工艺条件,这为今后大规模地生产甲壳素提供了理论依据以及技术参考.
参考文献:
[1] 蒋挺大.甲壳素[M].北京:化学工业出版社,2003.
[2] 张瑞娟.甲壳素及其衍生物的药理作用及研究进展[J].内蒙古中医药,2013,32(29):104-105.
[3] Dev Ashish, Mohan Jithin C, Sreeja V, et al. Novel carboxymethyl chitin nanoparticles for drug delivery applications [J].Carbohydrate Polymers, 2010,79(4):1073-1079.
[4] Majeti N V,Ravi K.A review of chitin and chitosan applications [J].Reactive & Functional Polymers,2000,46(1):1-27.
[5] 王稳航,刘安军,黄巍,等.卤蝇蛆壳甲壳素的提取及壳聚糖的制备工艺[J].食品与发酵工业,2003,29(6):18-22.
[6] 曹小红,陈一,张燕,等.蝇蛆中甲壳素与壳聚糖提取工艺的研究[J].食品工业科技,2003,24(5):82-86.
[7] 詹永乐,黄春芳,陈复生.家蚕蛹皮制取壳聚糖的最佳工艺条件[J].化学通报,2001(7):450-453.
[8] 王敦,胡景江,保从方.从金龟子体中提取甲壳素的初步研究[D].咸阳:西北林学院,2001.
[9] 吉惠杰,马艳丽.蚕蛹甲壳素提取工艺研究[J].吉林化工学院学报,2012,29(5):28-33.
[10] 白耀宇,程家安.我国黄粉虫的营养价值和饲养方法[J].昆虫知识, 2003,40(4):317-322.
[11] 向东升,李红梅.地产龙虾壳提取甲壳素及其废水的综合利用[J].食品与生物技术学报,2008,27(2):52-54.
[12] Cira L A, Huerta S,Hall G M, et al. Pilot scale lactic acid fermentation of shrimp wastes for chitin recovery: Process biacid fermentation of shrimp wastes for chitin recovery[J].Process Biochemistry,2002,37(12):1359-1366.
[13] 王文亮,孙爱东.提高黄粉虫蛋白质水解率的研究[J].食品与发酵工业,2006,32(3):145-146.
[14] 窦珍伟. 黄粉虫中油脂和壳聚糖的提取工艺研究[D].济南:山东大学,2009.
[15] 中华人民共和国卫生部.GB/T5009.4—2010.食品中灰分的测定[S].北京:中国标准出版社,2010.
[16] 逯亚飞.面粉灰分测定方法的一点改进[J].西部粮油科技,2010(4):79-79.
Optimization of the New Extraction Technology of Chitin fromTenebriomolitorby Orthogonal Test
Sui Shanshan, Zhou Xiang, Zhou Kai
(College of Environment and Plant Protection, Hainan University, Haikou 570228,China)
Abstract:In the report, the technique of protein hydrolyzed with protease was used to extract the chitin from theTenebriomolitor, and organic acid was used to remove ash, and the orthogonal test was performed to optimize the condition of enzymatic hydrolysis and organic acid treatment. The results showed that the best condition of enzymatic hydrolysis was trypsin and papain (1∶1), enzyme dosage was 1.0%, hydrolysis time was 7 h, hydrolysis temperature was 55 ℃; The best condition of organic acid treatment was malic acid, the concentration of acid was 15%, the time was 10h, the ratio of solid to liquid was 1∶50 (g/mL); under such conditions, the protein would be 3.39% and the ash would be 0.35% in chitin.
Keywords:chitin; protease; organic acids; orthogonal test
中图分类号:S 899.9
文献标志码:ADOl:10.15886/j.cnki.hdxbzkb.2015.0027
文章编号:1004-1729(2015)02-0147-05
收稿日期:------------------------ 2014-11-17基金项目: 海南大学与昌江校县合作项目(2012825)
作者简介:岁姗姗(1988-),女,云南大理人,2012级硕士研究生,研究方向:资源昆虫―黄粉虫资源的综合利用.通信作者: 周祥(1968-),男,海南海口人,副教授,研究方向:森林昆虫及害虫防治,E-mail:zhouxiangdc@yahoo.com.cn
