响应面设计法优选金蝉花麦角甾醇提取工艺
2015-03-07杨安伦李建生
杨安伦,陈 忠,李建生
响应面设计法优选金蝉花麦角甾醇提取工艺
杨安伦1*,陈 忠2,李建生3
目的 优选金蝉花中麦角甾醇的最佳提取工艺。方法 选择乙醇浓度、提取温度和提取时间为自变量,麦角甾醇提取量为因变量,在单因素试验基础上,采用星点设计-效应面法优选提取工艺,通过Design- Expert 8.0.6统计分析软件对试验数据进行多元线性模型和二次多项式模型拟合,并绘制效应面图和等高线图。结果 金蝉花中麦角甾醇的最佳提取工艺为以88%乙醇为提取溶剂,在74 ℃下提取38 min;麦角甾醇检测浓度在9.28~148.50 μg/mL范围内与其峰面积呈良好的线性关系,平均加样回收率为97.99%。结论 优化的条件简单、快速,可为金蝉花的进一步开发利用和有效性研究提供理论依据。
金蝉花;麦角甾醇;提取工艺;HPLC;星点设计-效应面法
0 引言
金蝉花[1](Cordyceps cicadae)又名蝉花、蝉茸、虫花、蝉虫草、蝉茸菌,为麦角菌科真菌大蝉草(Cordyceps cicadae Shing)寄生于蝉科昆虫的若虫上形成的虫菌复合体,其性味甘寒,具散风热、定惊镇痉、明目之功效,属于虫草类药材。金蝉花含有丰富的生物活性成分,如多糖[2]、多种生物碱、D-甘露醇[3]、虫草酸、核苷类成分[4-5]、多种必需氨基酸[6]等有效成分。现代药理研究表明,金蝉花具有抗衰竭[7]、降血糖[8]、改善贫血、调解免疫功能[9]、耐缺氧、延长寿命、促进巨噬细胞吞噬能力等作用。
麦角甾醇是真菌类特征甾醇[10],是一种重要的维生素D源。具有调节真菌细胞膜流动性的功能,确保细胞活力及物质运输[11],同时在抗肿瘤方面也发挥重要的作用[12]。本试验采用星点设计-效应面法优选金蝉花麦角甾醇的提取工艺,以麦角甾醇提取量为响应值,使用Design-Expert 8.0.6软件分析,优化提取溶剂乙醇的浓度,提取时间和提取温度。并通过适用性考察,确定HPLC检测的最佳色谱条件。
1 仪器与试药
1.1 仪器 Dionex UltiMate 3000高效液相色谱仪,配置包括四元梯度泵、在线真空脱气机、自动进样器、恒温柱温箱、DAD检测器,变色龙色谱数据工作站;Agilent Eclipse XDB-C18(4.6 mm×150 mm,5 μm)色谱柱;梅特勒XS-105电子分析天平(0.01 mg,METTLER TOLEDO,Switzerland);KS-80中草药粉碎机(天津泰斯特仪器有限公司);R-201恒温水浴锅(上海申生科技有限公司)。
1.2 试药 金蝉花(批号:20140501,产地:浙江)购自浙江中医药大学中药饮片有限公司;麦角甾醇对照品(批号:111845-201102,含量97.7%)购自中国药品生物制品检定所;无水乙醇为分析纯,流动相甲醇为色谱纯,水为娃哈哈纯净水。
2 金蝉花麦角甾醇提取方法考察
2.1 提取溶剂的选择 称取金蝉花粉末(过三号筛)约0.25 g,精密加入溶剂、水及20%、40%、60%、80%乙醇溶液和无水乙醇各50 mL,在80 ℃水浴锅中提取45 min,冷却,过滤,取续滤液进行含量分析。如图1可知,溶剂对金蝉花麦角甾醇提取有较大影响,其中水、20%和40%乙醇溶液提取未检测出麦角甾醇成分,而80%乙醇对麦角甾醇提取有最佳效果。

图1 乙醇浓度对金蝉花麦角甾醇提取量的影响
2.2 提取温度的选择 称取金蝉花粉末约0.25 g,精密加入80%乙醇溶液50 mL,50、60、70、80、90、100 ℃水浴锅中提取45 min,冷却,过滤,取续滤液进行含量分析。如图2可知,80 ℃条件下金蝉花麦角甾醇提取效果最佳。

图2 提取温度对金蝉花麦角甾醇提取量的影响
2.3 提取时间的选择 称取金蝉花粉末约0.25 g,精密加入80%乙醇溶液50 mL,在80 ℃水浴锅中分别提取15、30、45、60、75、90 min,冷却,过滤,取续滤液进行含量分析。如图3可知,提取时间为30 min麦角甾醇提取效果最佳。
2.4 料液比的选择 称取金蝉花粉末约0.25 g,以料液比1∶50、1∶100、1∶150、1∶200、1∶250、1∶300 (g∶mL)精密加入相应体积的80%乙醇溶液,在80 ℃水浴锅中提取30 min,冷却,过滤,取续滤液进行含量分析。麦角甾醇含量依次为0.323、0.481、0.544、0.691、0.682、0.698 mg/g,由结果可知在料液比1∶200之后,随着料液比的增加,提取效果无明显改善,故实验以料液比1∶200进行提取。
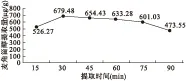
图3 提取时间对金蝉花麦角甾醇提取量的影响
2.5 提取工艺的优化
2.5.1 星点试验设计与结果 在单因素试验基础上,选择乙醇浓度、提取温度和提取时间为考察因素进行星点试验设计,因料液比为非连续变量,确定料液比为1∶200 (g∶mL),以麦角甾醇提取量为响应值,采用Design Expert 8.0.6 统计分析软件进行数据拟合,因素水平见表1,试验安排与结果见表2。
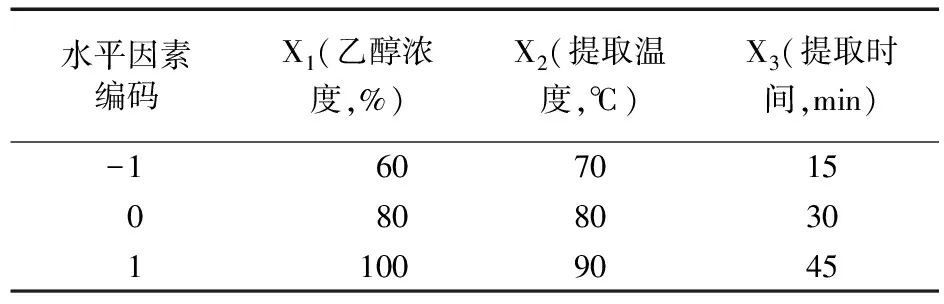
表1 金蝉花麦角甾醇提取工艺星点因素水平

表2 金蝉花麦角甾醇提取工艺星点试验安排
2.5.2 建立模型方程与显著性检验 应用Design-Expert 8.0.6 软件对表2中的数据进行二次多元拟合,得到乙醇浓度(X1)、提取温度(X2)、提取时间(X3)与金蝉花麦角甾醇提取量之间的二次多项回归方程:Y=680.406+63.747 5 X1-3.298 75 X2+14.858 75 X3+1.265 X1X2+0.485 X1X3-16.442 5 X2X3-81.576 75 X12-10.059 25 X22-23.634 25 X32(R2=98.53%)。
从表3可以看出,因素中一次项提取时间对金蝉花麦角甾醇提取量具有显著性差异,乙醇浓度对金蝉花麦角甾醇提取量具有极显著差异,提取温度对金蝉花麦角甾醇提取量线性效应不显著;二次项中乙醇浓度对金蝉花麦角甾醇提取量的曲面效应极显著;比较各因子交互作用均不显著。
2.5.3 响应面分析 Design-Expert 8.0.6 软件依据回归方程来绘制响应面立体分析图及等高线,考察所拟合的响应面曲线的形状,并通过响应面等高线图(图4)和曲面图(图5)对影响金蝉花麦角甾醇提取量的条件中任何2种因素的交互效应进行评价和分析,从而确定最佳工艺。
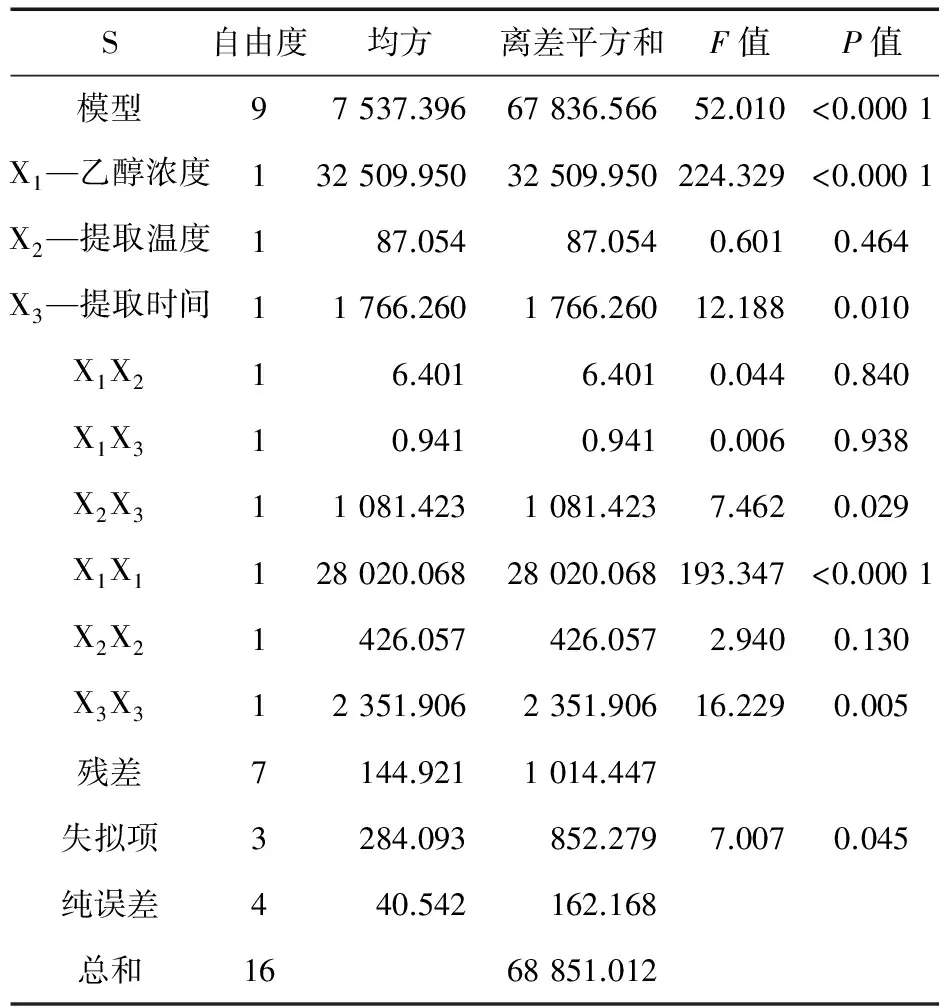
表3 回归模型方差分析

图4 优化工艺模型的等高线叠加图
3.提取温度与提取时间对麦角甾醇提取量影响的等高线叠加图

图5 优化工艺模型的效应面图
3.提取温度与提取时间对麦角甾醇提取量影响的效应面图
2.5.4 工艺参数的优化及验证实验 由简化的回归方程进行预测分析,在星点设计试验条件范围内,最优试验条件为:乙醇浓度87.76%、提取温度74.44 ℃、料液比1∶200(g∶mL)、提取时间37.67 min,金蝉花麦角甾醇提取量的预测值为697.50 μg/g。
称取金蝉花粉末约0.25 g,共3份,分别精密加入88%乙醇溶液50 mL,在74 ℃水浴锅中提取38 min,冷却,过滤,取续滤液进行含量分析。得金蝉花麦角甾醇提取量分别为693.64、688.97、696.51 μg/g,平均值为693.04 μg/g,RSD=0.55%,与预测值接近,星点设计-响应面法优化的工艺合理可行。
3 麦角甾醇的HPLC测定
3.1 波长的选择 用UltiMate 3000 DAD对麦角甾醇在200~600 nm处进行扫描。麦角甾醇在283 nm处有最大吸收值,故选用283 nm作为检测波长。
3.2 色谱条件 以Agilent Eclipse XDB-C18(4.6 mm×150 mm,5 μm)为色谱柱,以甲醇为流动相,流速为1.0 mL/min,柱温25 ℃,紫外检测波长为283 nm,进样量为10 μL[13]。色谱图见图6。

图6 麦角甾醇标准品(1)及金蝉花样品(2)HPLC色谱图
3.3 对照品溶液的制备 精密称取麦角甾醇对照品3.8 mg于25 mL容量瓶中,加甲醇至刻度,摇匀,作为储备液。根据要求,用甲醇将储备液稀释成9.28、18.56、37.13、74.25、148.50 μg/mL系列溶液,作为对照品溶液。
3.4 线性关系考察 按“3.2”项下色谱条件,依次吸取麦角甾醇系列对照品溶液各10 μL,注入色谱仪测定,以麦角甾醇吸收峰面积(Y)对质量浓度(X,μg/mL)进行线形回归,得回归方程:Y=0.149 7 X-0.190 4,R2=0.999 8,结果显示,进样量在9.28~148.50 μg/mL范围内有良好的线性关系。
3.5 精密度考察 以37.13 μg/mL麦角甾醇对照品溶液为测试溶液,对精密度进行考察。按“3.2”项下色谱条件,重复进样6次,测定峰面积,结果RSD为0.95%(n=6),结果表明,此条件下麦角甾醇的精密度和重现性良好。
3.6 稳定性考察 称取金蝉花粉末约0.25 g,按“2.5.4”项下方法进行提取,过滤,取续滤液,分别在0、5、10、15、20、25、30 h进行测定,得峰面积,其RSD值为1.17%,结果表明,在30 h内样品稳定。
3.7 准确度考察 称取已知含量的金蝉花粉末6份,每份约0.25 g,加入适量麦角甾醇对照品,按“2.5.4”项下方法进行提取制备,金蝉花对照品溶液和供试品溶液各进样10 μL,测得峰面积并计算含量,得平均回收率为97.99%,RSD=0.69% (n=6)。
3.8 样品测定及重复性考察 精密称取同一批号金蝉花粉6份,每份约0.25 g,按“2.5.4”项下优化方法进行提取,测定峰面积,并计算麦角甾醇含量(μg/g),平均值为700.25 μg/g,RSD为0.88%。
4 结论
4.1 提取方法的选择 本研究在单因素试验的基础上,以乙醇浓度、提取时间和提取温度作为考察因素,麦角甾醇提取量为评价指标,以Design-Expert 8.0.6为分析软件,通过星点设计-效应面法对提取工艺进行优化。试验筛选出在1∶200 (g∶mL)料液比下,以88%乙醇溶液为提取溶剂,74 ℃水浴提取38 min,金蝉花麦角甾醇最高提取量为693.04 μg/g。
4.2 检测方法的确定 通过DAD扫描,麦角甾醇在283 nm处有最大吸收值,色谱条件以Agilent Eclipse XDB-C18(4.6 mm×150 mm,5 μm)为色谱柱,甲醇为流动相,流速为1.0 mL/min,柱温25 ℃,紫外检测波长为283 nm,进样量为10 μL。麦角甾醇在9.28~148.50 μg/mL范围内有良好的线性关系,且稳定性好、精密度高,适合对金蝉花麦角甾醇进行检测。
4.3 金蝉花的药用前景 虫草类真菌能产生多种生理活性物质,在生物技术及医疗保健上有重要的作用。经临床研究及药效学分析,金蝉花的活性成分种类、含量及功效并不亚于冬虫夏草,而相较于冬虫夏草,金蝉花价格相对低廉,生态要求比较低,故金蝉花潜在的医疗价值和经济价值非常巨大,市场前景非常广阔。
[1] 浙江省食品药品监督管理局.浙江省中药炮制规范[S].浙江科学技术出版社,2005:360.
[2] 姚婷,罗靖,宋捷民.金蝉花多糖的微波辅助提取工艺研究[J].江西中医学院学报,2012,24(5):73-76.
[3] 葛飞,夏成润,李春如,等.蝉拟青霉菌丝体与天然蝉花中化学成分的比较研究[J].菌物学报,2007,26(1):68-75.
[4] 徐红娟,莫志宏,余佳文.蝉花生物活性物质研究进展[J].中国药业,2009,18(4):19-21.
[5] 陈安徽,陈宏伟,徐洋,等.蝉花虫草中核苷类成分的分离纯化和鉴定[J].食品科学,2013,34(1):131-134.
[6] 縢晔,官宗华,宋玉良.野生蝉花与人工培养品中氨基酸、无机元素成分的比较[J].浙江中医药大学学报,2012,36(10):1123-1127.
[7] 谢炜,郭月芳,盛雨辰.蝉花菌丝体对慢性肾功能衰竭大鼠的治疗作用[J].中国医药工业杂志,2011,42(10):770-772.
[8] 刘伟敬,唐阳敏,谢淑华,等.蝉花菌丝对糖尿病肾病大鼠的肾脏保护作用机制研究[J].中国中西医结合肾病杂志,2014,15(8):665-668.
[9] 宋捷民,陈玲,陈玮,等.蝉花对免疫功能影响的实验研究[J].中国中医药科技,2007,14(1):37-38.
[10]Arora A,Raghruaman H,Chattopadhyay A.Influence of cholesterol and ergosterol on membrane dynamics:a fluorescence approach[J].Biochemical and Biophysical Research Communications,2004,31(8):920-926.
[11]Yuan JP,Wang JH,Liu X,et al.Simultaneous determination of free ergosterol and ergosteryl esters in Cordyceps sinensis by HPLC [J].Food Chemistry,2007,105(4):1755-1759.
[12]高虹,史德芳等.巴西菇麦角甾醇抗肿瘤活性及作用机理初探[J].中国食用菌,2011,30(6):35-39.
[13]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药出版社,2010:299.
Optimization of extraction technology of ergosterol in cordyceps cicadae by response surface methodology
YANG An-lun1*,CHEN Zhong2,LI Jian-sheng3
(1.Zhejiang Provincial Hospital of TCM,Hangzhou 310006,China;2.Zhejiang Chinese Medical University Medical Pieces.,LTD,Hangzhou 311401,China;3.Zhejiang Chinese Medical University,Hangzhou 310053,China)
Objective To optimize the extraction process of ergosterol in cordyceps cicadae.Methods Based on single factor tests,central composite design-response surface methodology was applied to optimize the process with ethanol concentration,extraction temperature and extraction time as independent variables,and the extraction amounts of ergosterol as dependent variable.Design-Expert 8.0.6 statistic analysis software was used to fit multivariate linear equation and second-order polynomial equation for experimental data,and delineate response surface and contour plot.Results The best technical condition was as follows:the extraction lasted for 38 min under 74 ℃ with 88% alcohol as the extration solvent.The linear range of ergosterol was 9.28~148.50 μg/mL and the average recovery rate was 97.99%.Conclusion The method is simple and rapid,and it provides scientific basis for the safety and effectiveness of cordyceps cicadae in clinical use.
Cordyceps cicadae;Ergosterol;Extraction technology;HPLC;Central composite design-response surface methodology
2015-03-04
1.浙江省中医院,杭州 310006;2.浙江中医药大学中药饮片有限公司,杭州 311401;3.浙江中医药大学,杭州 310053
浙江省中医药科学研究基金计划(2013ZA027)
10.14053/j.cnki.ppcr.201511021
*通信作者
