尤文联合地塞米松对大鼠急性肺损伤的疗效
2015-03-07卓宋明余海彬
申 严,卓宋明,庄 虹,李 娜,余海彬
尤文联合地塞米松对大鼠急性肺损伤的疗效
申 严,卓宋明,庄 虹,李 娜,余海彬
目的 明确尤文联合地塞米松对大鼠急性肺损伤模型的效果及其相关机制。方法 将96只SD大鼠分别于气管内滴注LPS制备急性肺损伤模型,随机分为溶媒对照组(LPS组)、英脱利匹特组(ω-6组)、尤文组(ω-3组)、地塞米松组(DXM组)、英脱利匹特+地塞米松组(ω-6+DXM组)、尤文+地塞米松组(ω-3+DXM组),分别给予相应的干预处理3 d后,HE染色检测肺组织病理改变,测定PaO2及肺组织湿/干重比(W/D),ELISA法检测BALF中相关炎症因子的含量。结果 LPS组与ω-6组大鼠肺泡隔增厚,肺组织出血、水肿及大量炎性细胞浸润,肺组织W/D比值明显高于其他各组;给予地塞米松或尤文后,模型大鼠死亡率降低,肺损伤程度减轻,PaO2升高,BALF中TNF-α、IL-1β、IL-6含量降低(P<0.05)。ω-3组、DXM组、ω-6+DXM组之间各检测指标无明显区别,而ω-3+DXM组肺组织基本正常,W/D比值最低,PaO2最高,BALF中TNF-α、IL-1β、IL-6含量明显低于其他各组;给予尤文后BALF中IL-10明显增高,ω-3组与ω-3+DXM组BALF中IL-10明显高于其他各组,差异均有统计学意义(P<0.05)。结论 尤文联合地塞米松可通过调控TNF-α、IL-1β、IL-6及IL-10等相关炎症因子的表达,减轻肺损伤。
急性肺损伤;脂多糖;尤文;地塞米松;炎症因子
0 引言
急性肺损伤(Acute lung injury,ALI)是由多种炎症介质和细胞因子介导的,以弥漫性肺泡壁毛细血管通透性增加为特征的炎症损伤性疾病,往往导致急性、进行性、缺氧性呼吸衰竭,是临床常见的危重症之一[1-2]。糖皮质激素能明显抑制炎症的发生、发展,是临床上治疗ALI的常用药物[3],但目前ALI患者的预后仍不乐观,死亡率可达67%[4],能有效延缓ALI进程的治疗方案仍在探索之中。研究表明,ω-3鱼油脂肪乳注射液(Omegaven,尤文)含有二十碳五烯酸(EPA)、二十二碳六烯酸(DXMA)等多不饱和脂肪酸(PUFAs),可以通过多种分子机制调控机体炎症和免疫功能,在治疗感染性疾病方面比传统的ω-6脂肪乳(Intralipid,英脱利匹特)具有更广泛的临床应用价值[5-6]。本研究通过建立大鼠ALI模型,观察尤文联合地塞米松对ALI大鼠肺组织病理形态及动脉血氧分压(PaO2)的影响,同时检测各组大鼠肺泡灌洗液中TNF-α、IL-1β、IL-6、IL-10含量,探讨尤文联合地塞米松对ALI大鼠的疗效及其相关机制,以期为临床合理用药治疗ALI提供实验依据。
1 材料和方法
1.1 ALI模型的建立与分组 将96只(200±10)g健康SD大鼠(雌雄各半)分别于气管内滴注LPS(0.2 mg/kg,溶于0.3 mL 0.9%氯化钠溶液)制备急性肺损伤模型,随机分为溶媒对照组(LPS组)、英脱利匹特组(ω-6组)、尤文组(ω-3组)、地塞米松组(DXM组)、英脱利匹特+地塞米松组(ω-6+DXM组)、尤文+地塞米松组(ω-3+DXM组),每组16只大鼠,气管内滴注LPS 10 min后,采用尾静脉穿刺并固定静脉留置针,连续3 d分别给予相应的干预处理,LPS组大鼠注射0.9%氯化钠注射液、ω-6组注射20%英脱利匹特、ω-3组注射10% ω-3鱼油脂肪乳注射液(商品名:尤文),剂量均为30 mL/(kg·d),DXM组注射地塞米松注射液3 mg/kg(溶于等量0.9%氯化钠溶液),ω-6+DXM组及ω-3+DXM组分别联合注射等量地塞米松(3 mg/kg)和ω-6或ω-3[30 mL/(kg·d)]。LPS购自武汉博士德生物工程有限公司,0.9%氯化钠溶液、地塞米松注射液、20%英脱利匹特、10%尤文均购自上海华瑞制药有限公司。
1.2 观察各组大鼠死亡率,测定PaO2及肺组织湿/干重比 干预处理3 d后,将各组存活的大鼠经心脏穿刺抽取2 mL血液注入肝素抗凝管,采用血气分析仪测定PaO2。采集心脏血后,取出左侧肺,称取湿重后,置于80 ℃烤箱中烤至恒重,称干重,计算肺组织湿/干重比(W/D)。
1.3 BALF中TNF-α、IL-1β、IL-6、IL-10含量测定 结扎左侧肺门,于气管下段作一小T形切口,插入12号针头,用注射器吸取2.5 mL 0.9%氯化钠溶液行右肺肺泡灌洗,首先以较小的压力将盐水缓慢注入肺内,再缓慢回抽灌洗液,然后将所得液体缓慢注回肺内,如此反复约5次后回抽液体,注入15 mL离心管,然后重复3次上述操作,回收总量约6 mL肺泡灌洗液(Bronchoalveolar lavage fluid,BALF),4 ℃1 500 r/min离心10 min,上清液放入-70 ℃冰箱中保存,ELISA法测定BALF中TNF-α、IL-1β、IL-6、IL-10含量。酶联免疫吸附测定(ELISA)试剂盒购自武汉博士德生物工程有限公司。
1.4 HE染色观察肺组织病理形态学改变 留取肺泡灌洗液后,将套管针插入右心室,在左心耳剪一长约2 mm切口,同时向右心室灌注加入肝素的0.9%氯化钠溶液,直至将肺血管床血液冲洗干净,取右下肺组织于4%多聚甲醛中固定24 h,常规石蜡切片,HE染色,观察肺组织病理形态学改变。
2 结果
2.1 ALI模型大鼠死亡率、PaO2及肺组织W/D比值变化 LPS处理制作ALI模型后,各组大鼠均有部分发生死亡,LPS组及ω-6组各死亡6只大鼠,ω-3组、DXM组、ω-6+DXM组均有2只大鼠死亡,其死亡率低于LPS组及ω-6组,但差异无统计学意义;ω-3+DXM组有1只大鼠死亡,其死亡率明显低于LPS组及ω-6组,差异有统计学意义(P<0.05)。LPS组及ω-6组PaO2明显低于其他各组,肺组织W/D比值明显高于其他各组;联合给予尤文及地塞米松(ω-3+DXM组)后,PaO2达(92.72±8.36)mmHg,明显高于其他各组,肺组织W/D比值显著降低,明显低于其他各组,差异有统计学意义。ω-3组、DXM组、ω-6+DXM组间PaO2及肺组织W/D比值比较差异无统计学意义(P>0.05)。见表1。

表1 各组大鼠死亡率、PaO2及肺组织W/D比值的比较
注:与LPS组及ω-6组比较,*P<0.05;与ω-3组、DXM组及ω-6+DXM组比较,#P<0.05
2.2 BALF中TNF-α、IL-1β、IL-6、IL-10含量测定 LPS组与ω-6组大鼠BALF中TNF-α、IL-1β、IL-6含量均明显高于其他各组,差异有统计学意义(P<0.05)。见表2。DXM组、ω-6+DXM组及ω-3组的BALF中TNF-α、IL-1β、IL-6含量降低,ω-3+DXM组BALF中TNF-α、IL-1β、IL-6含量降低更明显,差异均有统计学意义(P<0.05),而ω-3组、DXM组、ω-6+DXM组之间TNF-α、IL-1β、IL-6含量比较差异无统计学意义;给予尤文后BALF中IL-10明显增高,ω-3组及ω-3+DXM组BALF中IL-10明显高于其他各组,差异有统计学意义。
2.3 肺组织病理学改变 LPS组及ω-6组大鼠肺组织弥漫性充血水肿,肺泡隔增厚,血管周围及肺泡腔内有较多渗出液,肺间质可见大量多形核白细胞浸润(图1A、B)。给予地塞米松或尤文干预处理后,大鼠肺组织病变明显减轻,ω-3组、DXM组、ω-6+DXM组肺泡结构较清晰,肺间质可见少量多形核白细胞浸润,肺泡腔内少量渗出液(图1C、D、E);而联合给予尤文及地塞米松后,肺组织结构基本正常,肺泡结构清楚,无明显充血、水肿及炎性细胞的浸润(图1F)。
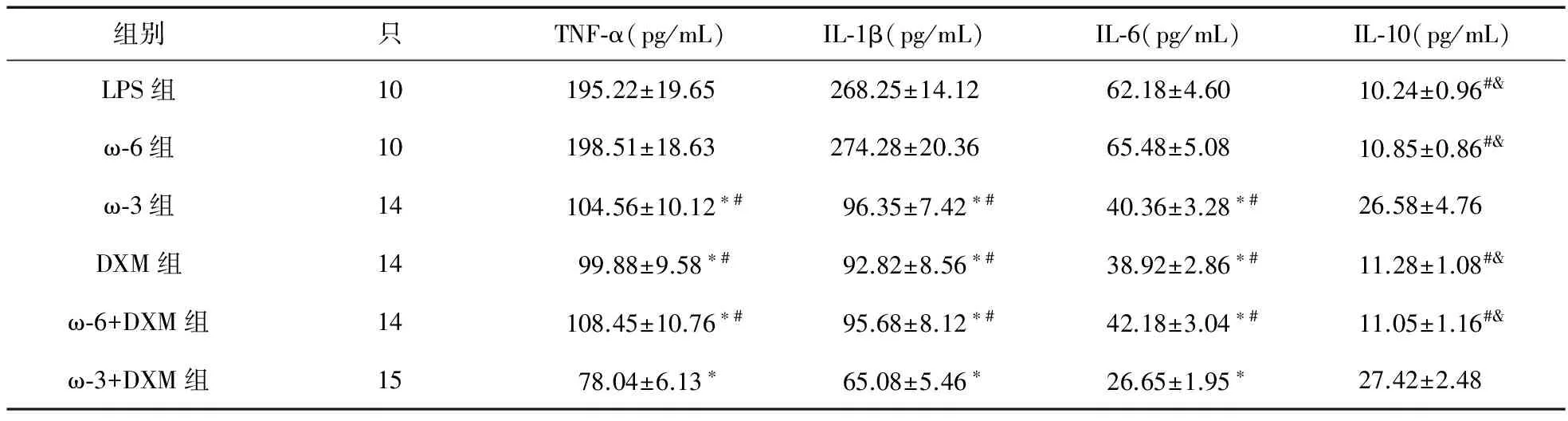
表2 各组大鼠BALF中TNF-α、IL-1β、IL-6、IL-10含量的比较
注:*与LPS组、ω-6组比较,*P<0.05;#与ω-3+DXM组比较,P<0.05;&与ω-3,P<0.05
3 讨论
ALI为常见的临床疾病,存在肺泡上皮和内皮细胞的损伤,往往迅速进展为肺水肿以及肺动脉高压,表现为急性发作的低氧血症,其机制是炎性细胞和促炎介质经血液循环被转运入肺内诱发弥漫性肺内病变,ALI具有与急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)相同的病理生理改变,严重的ALI或ALI的最终严重阶段就是ARDS[2,7-8]。研究表明,ALI的本质是炎症反应,因此,抗炎成为治疗ALI的积极策略。基于糖皮质激素能通过抑制NF-κB与相关基因上的NF-κB位点结合,抑制炎症细胞因子mRNA的转录,减少炎症因子的生成,从而减轻炎症反应,因而糖皮质激素是临床上治疗ALI的常用药物,但在应用糖皮质激素治疗ALI的时机及联合用药方案上一直存在争议[3,9-10]。因此,开展ALI发生后糖皮质激素治疗时机、用药方案和作用机制的研究,对于指导ALI的临床治疗具有积极的意义。
尤文富含ω-3多不饱和脂肪酸(Polyunsaturated fatty acids,PUFAs),主要成分有α-亚麻酸、EPA和DXMA等。文献报道,ω-3 PUFAs通过减少促

图1 肺组织病理学改变光镜下观察(HE染色)
炎介质如巨噬细胞炎性蛋白2(MIP-2)和血栓素B2(TXB2)的生成,减少中性粒细胞侵入肺泡内,对实验性肺损伤有一定的预防和治疗作用[11-12]。而英脱利匹特主要含有亚油酸、γ-亚麻酸和花生四烯酸(AA)等ω-6 PUFAs,其中AA是脂质炎症递质的前体,通过环氧化酶、脂氧化酶、细胞色素P450途径,可以产生多种炎症递质,如前列腺素E2(PGE2)、白三烯B4(LTB4)等,进而促进IL-1的产生及炎症反应[13]。本研究显示,气管内滴入LPS并给予溶媒或英脱利匹特注射处理3 d后,大鼠动脉血PaO2<70 mmHg,肺组织W/D比值明显高于其他各组,HE染色显示肺间质内大量炎性细胞浸润,肺泡隔明显增宽,肺组织病理评分明显高于其他各组;给予地塞米松或尤文干预处理后,PaO2升高,肺组织病变明显减轻,ω-3组、DXM组、ω-6+DXM组肺组织病理评分之间差异无统计学意义;而联合给予尤文及地塞米松后,ALI大鼠死亡率降低,PaO2进一步升高,达90 mmHg以上,肺泡结构清楚,无明显充血、水肿及炎性细胞的浸润,肺组织结构基本正常,表明给予英脱利匹特对ALI大鼠模型无明显疗效,而给予尤文或地塞米松均能明显减轻ALI大鼠肺组织病变,改善PaO2,降低死亡率,且尤文与地塞米松联合应用后对ALI大鼠模型肺组织具有协同效应,这也为临床治疗ALI等炎性疾病应选择尤文而不是选择英脱利匹特提供了实验依据。
IL-6是急性炎性反应中的一种多功能细胞因子,具有广泛的生物活性和免疫调节作用,是启动全身炎症反应最强的内源性炎症因子,主要由TNF-α、IL-1β刺激巨噬细胞分泌,转录由NF-κB所介导,与TNF-α、IL-1β一起被称作“前炎性细胞因子”[14-15]。研究表明,а7nAChR激动剂能通过抑制TNF-α、IL-6、IL-1β的产生,阻断炎症激活的恶性循环,减轻大鼠肠缺血再灌注后急性肺损伤,改善肺功能[16]。且尤文中富含的EPA和DXMA等ω-3 PUFAs也可以抑制人单核细胞的I-κB磷酸化及NF-κB的激活,进而抑制TNF-α等炎性因子产生,降低炎性反应[15,17]。本研究表明,给予地塞米松或尤文干预处理后,BALF中TNF-α、IL-1β、IL-6含量均明显降低,联合给予地塞米松和尤文干预处理后,BALF中TNF-α、IL-1β、IL-6含量降低更明显,表明尤文与地塞米松一样能通过抑制炎症因子的产生,减轻ALI大鼠肺组织病变,且尤文与地塞米松联合应用能产生协同效应,能进一步抑制TNF-α、IL-1β、IL-6等炎症因子的产生。
IL-10是重要的内源性抗炎因子之一,具有强有力的抗炎作用,能够广泛抑制TNF-α、IL-1β、IL-6等促炎介质生成。ARDS患者IL-10水平明显下降,且其水平的降低与病死率高度相关[18]。扶志敏等[19]在关于兔的急性肺损伤中也发现,ω-3 PUFAs可以上调IL-10的表达。此外,S100A8在体内能通过抑制肥大细胞活化及NF-κB通路,诱导IL-10产生,减轻小鼠急性肺损伤[20]。本研究发现,给予地塞米松处理后,BALF中IL-10水平较LPS组稍高,但差异无统计学意义;而给予尤文后,BALF中IL-10水平明显增高,ω-3组及ω-3+DXM组BALF中IL-10水平均明显高于其他各组,差异有统计学意义,表明尤文还能通过促进IL-10的表达抑制ALI模型的炎症反应。至于尤文通过何种机制调控IL-10的表达有待进一步研究。
综上所述,尤文联合地塞米松能对ALI治疗产生协同效应,两者通过促进IL-10产生,抑制ALI大鼠TNF-α、IL-1β、IL-6等促炎介质生成,减轻ALI大鼠肺组织病变,英脱利匹特对ALI大鼠模型无明显疗效,这为临床尽早选择ω-3脂肪乳联合地塞米松治疗ALI患者提供了重要的实验依据。
[1] 丁鼎,刘中洋,袭荣刚,等.ALI/ARDS的治疗进展[J].国际呼吸杂志,2014,34(18):1425-1429.
[2] 中华医学会呼吸病学分会.急性肺损伤/急性呼吸窘迫综合征的诊断标准(草案)[J].中华结核和呼吸杂志,2000,23(4):203.
[3] 朱珊珊.糖皮质激素对急性肺损伤的治疗现状[J].医学综述,2012,18(14):2243-2245.
[4] 苏晴,郑玉春,赵兵,等.急性肺损伤与急性呼吸窘迫综合征患者生存分析[J].中国全科医学,2013,16(7):2222-2226.
[5] Jing HR,Yao JH,Liu XM,et al.Fish-oil emulsion (omega-3 polyunsaturated fatty acids) attenuates acute lung injury induced by intestinal ischemiaereperfusion through Adenosine 5′-monophosphate-activated protein kinase-sirtuin1 pathway[J].J Surg Res,2014,187(1):252-261.
[6] 沈杨,施小燕.ω-3多不饱和脂肪酸治疗急性肺损伤的疗效观察[J].中国微生态学杂志,2010,22(7):640-642.
[7] 王颖,桑田.早产儿呼吸窘迫综合征的呼吸支持策略及研究进展[J].中国小儿急救医学,2014,21(10):613-616,621.
[8] 王植嘉,舒林华,尚云晓,等.经支气管镜检查确诊支气管内膜结核合并肺炎支原体感染一例[J].中国小儿急救医学,2013,20(1):111-112.
[9] 邓水香,曹同瓦,夏志洁.糖皮质激素治疗急性呼吸窘迫综合征[J].中华急诊医学杂志,2013,22(3):335-336.
[10]Liu F,Pauluhn J,Trübel H,et al.Single high-dose dexamethasone and sodium salicylate failed to attenuate phosgene-induced acute lung injury in rats[J].Toxicology,2014,315(1):17-23.
[11]Kohama K,Nakao A,Terashima M,et al.Supplementation of parenteral nutrition ith fish oil attenuates acute lung injury in a rat model[J].J Clin Biochem Nutr,2014,54(2):116-121.
[12]王瑾,于健春,康维明,等.鱼油脂肪乳剂对炎症的影响及其临床应用[J].中国实用外科杂志,2011,31(4):354-357.
[13]Chen W,Jiang HR,Zhou ZY,et al.Is omega-3 fatty acids enriched nutrition support safe for critical ill patients? A systematic review and meta-analysis[J].Nutrients,2014,6(6):2148-2164.
[14]魏东,刘英,贾宁,等.H9N2亚型猪流感病毒诱导小鼠急性肺损伤中TNF-α、IL-1β、IL-6和IL-10的变化和作用[J].中国实验动物学报,2013,21(2):72-74.
[15]石计朋,黄丽密,钱燕,等.橄榄油脂肪乳对LPS诱导急性肺损伤SD幼年大鼠前炎症因子TNF-α、IL-1β、IL-6的影响[J].实用预防医学,2014,21(3):275-277.
[16]朱国松,罗刚健,叶志强,等.а7nAChR激动剂和乌司他丁对大鼠肠缺血再灌注后肺组织IL-1β、IL-6和TNF-α作用的比较[J].实用医学杂志,2013,29(8):1231-1233.
[17]孔万权,王征,夏轶姿,等.ω-3多不饱和脂肪酸对急性呼吸窘迫综合征患者血清炎症介质的影响[J].中华危重症医学杂志(电子版),2012,5(1):13-17.
[18]王春亚,王贵佐.白细胞介素10及其基因多态性与急性呼吸窘迫综合征的关系[J].医学综述,2013,19(23):4332-4334.
[19]扶志敏,王正,杨林,等.ω-3鱼油脂肪乳剂对内毒素致兔急性肺损伤保护作用机制的研究[J].中国急救医学,2009,29(8):715-719.
[20]Hiroshima Y,Hsu K,Tedla N,et al.S100A8 induces IL-10 and protects against acute lung injury[J].J Immunol,2014,192(6):2800-2811.
Effects of omeganven combined with dexamethasone on rat model with acute lung injury
SHEN Yan,ZHUO Song-ming,ZHUANG Hong,LI Na,YU Hai-bin
(Department of Respiratory Medicine,Longgang District Central Hospital of Shenzhen,Shenzhen 518116,China)
Objective To explore the effects of omeganven combined with dexamethasone on the acute lung injury of rat model and the mechanism.Methods Ninety-six SD rats were treated with lipopolysaccharide (LPS) by intratracheal instillation to induce acute lung injury,and they were randomly divided into control group (LPS group),intralipid group (ω-6 group),omeganven group (ω-3 group),dexamethasone group (DXM group),intralipid+dexamethasone group (ω-6+DXM group) and omeganven+dexamethasone group (ω-3+DXM group).After 3 d of corresponding treatment,the pathologic changes in lung tissue section,wet/dry weight ratio (W/D) of lung tissue and PaO2were measured.The concentration of TNF-α,IL-1β,IL-6 and IL-10 in broncho-alveolar lavage fluid (BALF) were respectively measured by ELISA.Results In rats of LPS group and ω-6 group,alveolar septum thickening,lung hemorrhage,edema and inflammatory cell infiltration in lung tissue were easily seen,and W/D ratio of lung tissue was significantly higher than that of another groups.Among rats of ω-3 group,DXM group and ω-6+DXM group,there was no obvious difference in pathological changes,and the level of TNF-α,IL-1β and IL-6 in BALF,however,the indexes decreased significantly after treatment in DXM group and ω-3 group.In rats of ω-3+DXM group,the structure of lung tissue was almost normal,and the W/D ratio and the levels of TNF-α,IL-1β and IL-6 in BALF were the lowest(P<0.05).Furthermore,the level of IL-10 in BALF increased remarkably after treatment with omeganven,and it was obviously higher in rats of ω-3 group and ω-3+DXM group (P<0.05).Conclusion Omeganven combined with dexamethasone can relieve lung injury through regulating the expression of inflammatory factor in BALF such as TNF-α,IL-1β,IL-6 and IL-10 in rats with acute lung injury.
Acute lung injury;Lipopolysaccharide;Omeganven;Dexamethasone;Inflammatory factor
2015-04-15
深圳市龙岗中心医院呼吸内科,深圳 518116
10.14053/j.cnki.ppcr.201511009
