枯草芽孢杆菌3610 ClpQY基因缺失突变株的构建及其功能1)
2015-03-07赵银娟
赵银娟
(南方现代林业协同创新中心,江苏省有害生物入侵预防与控制重点实验室(南京林业大学),南京,210037)
严芳 吴小芹
(南京农业大学) (南方现代林业协同创新中心,江苏省有害生物入侵预防与控制重点实验室(南京林业大学))
责任编辑:程 红。
枯草芽孢杆菌(Bacillus subtilis)对多种植物病害具有较好的生防效应,因而被广泛关注[1-5]。同时该菌也是作为革兰氏阳性菌和芽孢杆菌的良好模式菌株。目前对其模式菌株的研究相当深入,尤其是关于芽孢的生成机理、生物膜的形成等[6-10]。本研究前期在1 株应用良好的生防菌蜡状芽孢杆菌(B.cereus)的转座子突变库中,筛选到与芽孢形成、生物膜以及对外界压力变化有极大关联的相关基因,网上比对结果显示该基因与一类重要的ATP 依赖的水解蛋白酶ClpQY 序列同源性较高。ClpQY早期被命名为HslVU,被认为是热激作用相关蛋白。目前对其研究主要集中在大肠杆菌(Escherichia coli)中,研究表明其控制了转录因子sigma32 的水平,而sigma32 直接调控转录热激相关蛋白的RNA 聚合酶[11]。此外,ClpQY 也调控了大肠杆菌细胞分裂的抑制蛋白SulA,调控了在环境压力下的细胞周期[12]。而该蛋白在枯草芽孢杆菌中目前还未见有相关报导。
为了验证枯草芽孢杆菌中ClpQY 基因的功能,本研究采用同源重组的方法,在基因组全序列清楚的枯草芽孢杆菌模式菌株NCIB 3610 中,构建ClpQY 基因的无痕缺失突变菌株,以进一步弄清ClpQY 在枯草芽孢杆菌中的功能,了解枯草芽孢杆菌的生防机理,同时,为其他芽孢杆菌的研究提供可靠的理论依据。
1 材料与方法
1.1 供试材料
枯草芽孢杆菌3610、枯草芽孢杆菌PY79、大肠杆菌DH5α、质粒pMAD(mlsr),均由江苏省有害生物入侵预防与控制重点实验室保存。
T4DNA 连接酶、Taq DNA 聚合酶、限制性内切酶、1 kb DNA Ladder 林可霉素(mls)等购于NEB 公司;PCR 引物由IDT 生物技术公司合成;质粒小样快速提取试剂盒、DNA 片段纯化回收试剂盒、基因组DNA 提取试剂盒购于QIAGEN 生物公司,蛋白胨、酵母粉等为Oxoid 公司产品。
大肠杆菌和枯草芽孢杆菌等所用培养基为常规LB 培养基,37 ℃或30 ℃培养;林可霉素在LB 培养基中的终质量浓度为100 mg·L-1。枯草芽孢杆菌产孢试验采用DSM 培养基。
1.2 枯草芽孢杆菌基因组DNA 的提取
参照《分子克隆实验指南》中革兰氏阳性菌的基因组DNA 提取步骤进行[13]27。
1.3 ClpQY 基因左右臂序列的扩增
根据枯草芽孢杆菌标准菌株B.subtilis 3610 全基因组序列(subtiList Web Server)用Primer 5.0 设计引物并引入相应的酶切位点(表1)。以subtiList Web Server 上提供的枯草芽孢杆菌3610 全基因组序列显示,ClpQY 基因全长1 963 bp。根据ClpQY 基因及上下游序列设计2 对寡核苷酸引物ClpQY-up-F,ClpQY-up-R;ClpQY-down-F,ClpQY-down-R,引物上分别添加酶切位点(表1下划线所示)。以提取的枯草芽孢杆菌3610 菌株基因组为模板,PCR扩增出ClpQY 基因两侧分别为840 bp 和983 bp 的同源臂序列,两侧同源臂间缺失1 927 bp 的ClpQY阅读框序列。上游同源臂扩增条件,94 ℃1 min,94℃1 min,55 ℃1 min,72 ℃1 min,30 个循环,72 ℃10 min;下游同源臂扩增条件,94 ℃1 min,94 ℃1 min,51 ℃1 min,72 ℃1 min,30 个循环,72 ℃10 min。枯草芽孢杆菌基因组的提取,大肠杆菌质粒提取,DNA 片段的回收、酶切、纯化、与载体的连接转化等操作,参照相关试剂盒的说明书;DNA 测序委托IDT 生物技术公司。
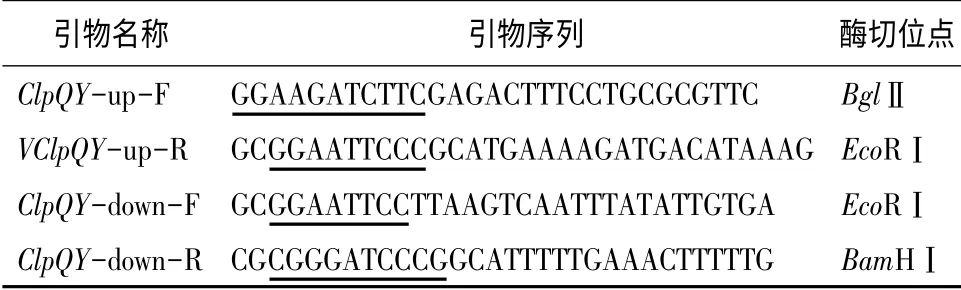
表1 引物序列及引入的酶切位点
1.4 ClpQY 基因左右臂的克隆
将纯化的PCR 产物与质粒pMAD 进行连接,连接产物转化感受态大肠杆菌DH5α,在含有mlsr(100 mg·L-1)LB 平板上37 ℃培养16 h,随机挑取阳性菌落进行菌落PCR,并提取质粒双酶切验证,得到重组质粒pMAD-up、pMAD-down,并测序上网比对验证。用Bgl Ⅱ和EcoR Ⅰ双酶切重组质粒pMAD-up,EcoRⅠ和BamHⅠ双酶切ClpQY 下游同源臂PCR 产物,并将酶切过的质粒和PCR 产物用T4DNA 酶连接起来,同时,转化大肠杆菌DH5α,获得pMAD-up-down 重组质粒,并测序上网比对验证。
1.5 缺失基因ClpQY(△ClpQY)菌株的构建
将此pMAD-up-down 重组质粒转化至感受态细胞枯草芽孢杆菌PY79 菌株,在mls 抗性平板上30 ℃培养过夜,挑取阳性克隆,并用引物ClpQY-up-F 和ClpQY-down-R 进行菌落PCR 扩增验证,选取PCR 产物有1.8 kb 和3.7 kb 左右的2 条带的阳性菌落,提取其基因组,用相同的方法转化感受态细胞枯草芽孢杆菌3610 菌株,稀释涂布LB 平板后,于30℃过夜培养,待长出菌落后,用牙签挑取单菌落,影印接种至LB 平板和含mls 的LB 平板上,30 ℃过夜培养,挑取mlsrLB 平板上没有而LB 平板上生长的单菌落,同样用引物ClpQY-up-F 和ClpQY-down-R PCR 验证,目标基因已被敲除。
1.6 转化
大肠杆菌转化和枯草芽孢杆菌转化均采用化学转化法[13]96。
1.7 生物膜形成的观察
不同菌株在LB 中培养至对数期,取10 μL 相同浓度的菌液,接种至12 孔板中,每孔中加入3 mL LBGM 培养基,置于培养箱中,30 ℃静置培养一段时间后取出观察。
1.8 菌体浓度测定
不同培养时间,取1 mL 待测液(浓度过高时,10倍稀释),摇匀,以空白培养液为参比,用752 型分光光度计测定600 nm 处的吸光值。
2 结果与分析
2.1 ClpQY 基因左右臂的克隆与序列
ClpQY 基因全长1 963 bp,为了用同源重组的方法将基因ClpQY 完全敲除掉,设计左臂中携带ClpQY 基因中的18 bp,右臂中也携带下游的18 bp。用引物对ClpQY-up-F/ClpQY-up-R 扩增枯草芽孢杆菌3610 菌株的左臂序列,ClpQY-down-F/ClpQYdown-R 扩增枯草芽孢杆菌3610 菌株的右臂序列,分别获得840 bp 和983 bp 的片段,将获得的片段分别克隆至pMAD 质粒中,筛选阳性重组质粒,经测序比对,与枯草芽孢杆菌3610 基因组序列同源性达100%,可用于同源重组时的左右臂序列。
2.2 重组质粒pMAD-up-down::mls 的构建及鉴定
将左臂质粒pMAD-up 用限制性内切酶BglⅡ和EcoRⅠ酶切,右臂PCR 产物用限制性内切酶EcoRⅠ和BamHⅠ酶切后,再用T4DNA 连接酶连接,构建重组质粒pMAD-up-down::mls,并用引物ClpQY-up-F/ClpQY-down-R 进行PCR 鉴定,获得1.8 kb 左右的条带,图1中的C 列,说明重组质粒构建成功。
2.3 ClpQY 基因缺失突变株的构建
将构建好的重组质粒pMAD-up-down::mls 转化至感受态细胞枯草芽孢杆菌菌株PY79,mlsrLB平板上培养过夜,获得阳性克隆,用引物ClpQY-up-F/ClpQY-down-R 进行PCR 鉴定,同源重组交换后,应该会在基因组中扩增出1.8 kb 和3.7 kb 左右的2 条带。结果显示,在挑取的9 个阳性克隆子中,有4 个出现了1.8 kb 和3.7 kb 左右的两条带(1、5、7、8 号),而3610 和重组质粒pMAD-up-down 分别扩增出3.7 kb 和1.8 kb 左右的条带(图1),这说明这4 个克隆已完成了左右臂与PY79 基因组的同源重组,即PY79 的LOOP IN。
2.4 ClpQY 缺失突变株的鉴定
提取LOOP IN 的PY79 全基因组,用同样的方法转化感受态细胞枯草芽孢杆菌菌株3610,稀释涂布于LB 平板上,待长出单克隆后,用牙签影印涂布至LB 平板和mlsrLB 平板上,同源重组后,ClpQY 将被完全敲除,此时,突变株将只能在LB 平板上生长(图2A),而不能在mlsrLB 平板上生长(图2B)。相对应地挑取LB 平板上的菌落,并提取基因组,同样利用引物ClpQY-up-F/ClpQY-down-R 来进行扩增验证,只出现1.8 kb 左右的条带,而没有3.7 kb 左右条带的克隆即为ClpQY 基因敲除的缺失菌株,挑取的21 个克隆中仅2、11、16 号为阳性,其余为假阳性(野生型)(图3)。

图1 菌落PCR 检测pMAD-up-down 与PY79 同源重组结果
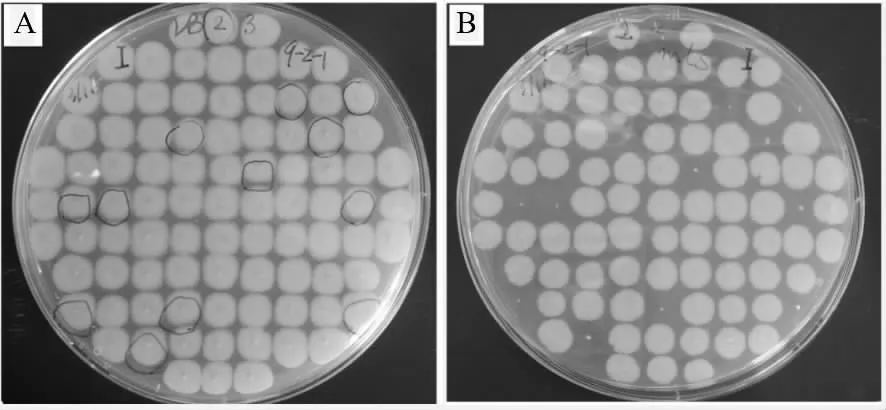
图2 平板影印法检测枯草芽孢杆菌3610 ClpQY 基因敲除克隆
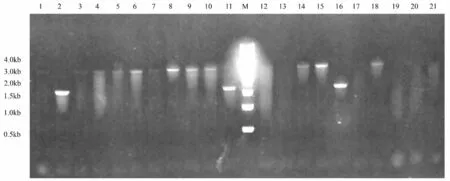
图3 菌落PCR 鉴定枯草芽孢杆菌3610 ClpQY 基因敲除结果
2.5 ClpQY 基因缺陷对枯草芽孢杆菌生物膜形成的影响
从图4可以看出,相比较于野生型菌株3610,在其刚刚形成生物膜的时候,ClpQY 基因缺失后的枯草芽孢杆菌3610 已具有明显的生物膜特征,而过表达ClpQY 的3610 则比野生型菌株弱,而在缺陷ClpQY 基因菌株中再次转入ClpQY 质粒后,发现生物膜的形成介于野生型和缺失菌株之间,由此可推测,ClpQY 对形成生物膜的相关基因具有调控作用。
2.6 高温胁迫对ClpQY 基因缺失突变株生长的影响
从图5可以看出,在37 ℃下,枯草芽孢杆菌3610 和ClpQY 突变株的生长差异不大;在3610 和缺失突变株中过表达ClpQY(ClpQY)的菌株,生长也没有很大变化,而在53 ℃高温压力下,4 菌株生物量在2~4 h 持续增长,而4 h 后,枯草芽孢杆菌3610菌株的生长受到了抑制,尤其是在3610 中过表达ClpQY 的菌株,生物量增加更少,而ClpQY 缺失菌株则继续维持一定的生长,生物量持续增加,至6 h 达到最高;在缺失菌株中转化入ClpQY 的菌株(△ClpQY-ClpQY)则介于两者之间,6 h 后,野生型3610 菌株及带有ClpQY 质粒的另外2 株菌和ClpQY缺失菌株生物量均开始下降。然而,ClpQY 缺失菌株的生物量始终高于其他3 株,这说明,ClpQY 的缺失对枯草芽孢杆菌在高温下的生长要高于野生型菌株,表明它的存在不是高温生长所必需的,相反,它很有可能降解了稳定细胞在高温下生存的一些因子,从而表现出在缺失菌株在高温胁迫中的延迟性。

图4 ClpQY 基因对枯草芽孢杆菌生物膜形成的影响

图5 ClpQY 基因对枯草芽孢杆菌在高温下生长的影响
3 讨论
枯草芽孢杆菌作为生防菌的应用研究在国内较多,而对其机理的探讨相对较少。从国外对枯草芽孢杆菌生防机理的研究结果来看,该菌防治植物病害的主要作用方式为:拮抗物质的生成[14-18]、诱导寄主抗性[19]、竞争作用[20-21]等。如产生枯草菌素拮抗物质,或形成生物膜提高生防菌定殖能力,抵御不良环境,阻止病原菌的侵入等。本研究前期在研究1 株生防菌蜡状芽孢杆菌的生防机理时,发现其转座突变库中与芽孢和生物膜形成等相关的序列,比对结果显示其与ClpQY 同源性最高。本研究利用同源重组的方法获得了遗传背景相对清楚的枯草芽孢杆菌的ClpQY 缺失突变株,对其产孢和高温下生长状况作了探讨,这将为其他芽孢杆菌的研究提供很好的借鉴。
ClpQY 是一类重要的ATP 依赖的水解蛋白酶,在真核生物疟原虫中,前人发现其对疟原虫的生长有极大的影响,敲除该基因可引起疟原虫的程序性死亡[22-23]。而在对原核生物的研究中,主要集中在大肠杆菌。Kanemori et al.[12]研究发现,ClpQY 可以协同其他蛋白酶,如ClpXP、ClpAP、FtsH 等,在高温胁迫或其他胁迫时,降解非正常蛋白,同时,对维持细胞稳定性的sigma32 因子等转录因子的水平及其合成进行调节。体外试验也显示,ClpQY 在高温下对sigma32 的降解速度比正常生长温度快15 倍[24]。在本研究中,枯草芽孢杆菌的ClpQY 缺失菌株在高温生长时,比野生型3610 菌株的耐受性更高,这说明,ClpQY 并不是高温压力下必需的基因,它的缺失不会影响其生长;反之,它很可能像在大肠杆菌中一样,程序性水解了对维持细胞稳定性有重要作用的转录因子,如此,在高温胁迫下,缺失菌株反而表现出比野生型菌株更高的耐受性而产生更多的生物量。因此,下一步有必要对ClpQY 在枯草芽孢杆菌中的调控通路和作用方式作进一步的研究。
ClpQY 对枯草芽孢杆菌生物膜的形成同样存在着类似的调节过程,由于本研究中对ClpQY 缺失菌株的产孢和对照相比,并没有明显地变化(结果未显示),而生物膜的形成却具有提前的效应,当在3610 中过表达ClpQY 时,生物膜的形成要晚于野生型和缺失菌株,而在缺失菌株中转入ClpQY 时,则中和了此效应,由此说明,ClpQY 对生物膜的形成确实具有调控作用。Vlamakis et al.[25]研究表明,Spo0A在生物膜的形成过程中起着重要的调节作用,其磷酸化水平决定了生物膜或芽孢的形成,因此,可推测ClpQY 的下游很有可能是Spo0A,这为更进一步深入研究ClpQY 的调控通路打下了基础。
本研究中,能够高效地构建ClpQY 缺失菌株,是利用驯化的高感受态枯草芽孢杆菌PY79 菌株作为过渡,从而增加了重组质粒的转化效率,同时,LOOP IN 的PY79 基因组和3610 基因组间的重组率也由于同源片段的增加而使得重组率大大提高。因此,该方法能够在短时间之内获得敲除目的基因的缺失菌株,且采用这种方法获取的缺失菌株是完全敲除了目的基因而不带入抗性基因的菌株。因此,避免了抗性基因对菌株的影响,也避免了由于敲除不彻底而带来的对基因功能的影响,以及对下游基因表达的极性效应。目前,该方法的应用在国内还不常见。因此,采用高感受态枯草芽孢杆菌PY79 作为过渡,采用LOOP IN 和LOOP OUT 的方法,对于成功高效地构建枯草芽孢杆菌缺失菌株具有很好的借鉴作用。
[1] 丁国春,付鹏,李红梅,等.枯草芽孢杆菌AR11 菌株对南方根结线虫的生物防治[J].南京农业大学学报,2005,28(2):46-49.
[2] 何红,蔡学清,陈玉森,等.辣椒内生枯草芽孢杆菌BS-2 和BS-1 防治香蕉炭疽病[J].福建农林大学学报:自然科学版,2002,31(4):442-444.
[3] Liu Weiwei,Ji Jing,Wang Chao,et al.Evaluation and identification of the potential nematicidal volatiles produced by Bacillus subtilis[J].Acta Phytopathologiga Sinica,2009,39(3):304-309.
[4] 喻国辉,程萍,王燕鹂,等.枯草芽抱杆菌TR21 田间防治巴西蕉枯萎病的效果[J].中国生物防治,2010,26(4):497-500.
[5] 罗楚平,刘邮洲,吴荷芳,等.脂肽类化合物bacillomycin L 抗真菌活性及其对水稻病害的防治[J].中国生物防治学报,2011,27(1):76-81.
[6] Chai Yunrong,Chu Frances,Kolter R,et al.Bistability and biofilm formation in Bacillus subtilis[J].Mol Microbiol,2008,67(2):254-263.
[7] Stewart P S.Mechanisms of antibiotic resistance in bacterial biofilms[J].Int J Med Microbiol,2002,292(2):107-113.
[8] Seminara A,Angelini T E,Wilking J N,et al.Osmotic spreading of Bacillus subtilis biofilms driven by an extracellular matrix[J].Proc Natl Acad Sci USA,2012,109(4):1116-1121.
[9] Hamon M A,Lazazzera B A.The sporulation transcription factor Spo0A is required for biofilm development in Bacillus subtilis[J].Mol Microbiol,2001,42(5):1199-1209.
[10] Kearns D B,Chu F,Branda S S,et al.A master regulator for biofilm formation by Bacillus subtilis[J].Mol Microbiol,2005,55(3):739-749.
[11] Turgay K,Hahn J,Burghoorn J,et al.Competence in Bacillus subtilis is controlled by regulated proteolysis of a transcription factor[J].The EMBO Journal,1998,17(22):6730-6738.
[12] Kanemori M,Yanagi H,Yura T.The ATP-dependent HslVU/ClpQY protease participates in turnover of cell division inhibitor SulA in Escherichia coli[J].J Bacteriol,1999,181(12):3674-3680.
[13] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].精编版.黄培堂,王恒樑,周晓巍,等译.北京:科学出版社,2008.
[14] Guder A,Schmitter T,Wiedemann I,et al.Role of the single regulator MrsRl and the two-component system MrsR2/K2 in the regulation of mersacidin production and immunity[J].Appl Environ Microbiol,2002,68(1):106-113.
[15] Hasper H E,de Kruijff B,Breukink E.Assembly and stability of nisin-lipid II pores[J].Biochemistry,2004,43(36):11567-11575.
[16] Pyoung ⅡK,Ryu J,Kim Y H,et al.Production of biosurfactant lipopeptides Iturin A,fengycin and surfactin A from Bacillus subtilis CMB32 for control of Colletotrichum gloeosporioides[J].J Microbiol Biotechnol,2010,20(1):138-145.
[17] Sari E,Etebarian H R,Roustaei A,et al.Biological control of Gaeumannomyces graminis on wheat with Bacillus spp.[J].Plant Pathology Journal,2006,5(3):307-314.
[18] Stein T.Bacillus subtilis antibiotics:structures,syntheses and specific functions[J].Mol Microbiol,2005,56(4):845-857.
[19] Rudrappa T,Biedrzycki M L,Kunjeti S G,et al.The rhizobacterial elicitor acetin induces systemic resistance in Arabidopsis thaliana[J].Commun Integr Biol,2010,3(2):130-138.
[20] Bais H P,Fall R,Vivanco J M.Biocontrol of Bacillus subtilis against infection of Arabidopsis toots by Pseudomonas syringae is facilitated by biofilm formation and surfactin production[J].Plant Physiol,2004,134(1):307-319.
[21] Chen Yun,Cao Shugeng,Chai Yunrong,et al.A Bacillus subtilis sensor kinase involved in triggering biofilm formation on the roots of tomato plants[J].Mol Microbiol,2012,85(3):418-430.
[22] Jain S,Rathore S,Asad M,et al.The prokaryotic ClpQ protease plays a key role in growth and development of mitochondria in Plasmodium falciparum[J].Cellular Microbiology,2013,15(10):1660-1673.
[23] Rathore S,Jain S,Sinha D,et al.Disruption of a mitochondrial protease machinery in Plasmodium falciparum is an intrinsic signal for parasite cell death[J].Cell Death and Disease,2011,24(2):118-130.
[24] Kanemori M,Nishihara K,Yanagi H,et al.Synergistic roles of HslVU and other ATP-Dependent proteases in controlling in vivo turnover of sigma32 and abnormal proteins in Escherichia coli[J].J Bacteriol,1997,179(23):7219-7225.
[25] Vlamakis H,Chai Yunrong,Beauregard P,et al.Sticking together:building a biofilm the Bacillus subtilis way[J].Nat Rev Microbiol,2013,11(3):157-168.
