舒利迭治疗儿童哮喘的疗效及对血PDGF、Eotaxin和IL-35的影响
2015-03-07作者单位063001河北唐山唐山市人民医院儿科杨振朋寇永妹吴丙美赵永生检验科李世龙
作者单位:063001 河北 唐山,唐山市人民医院儿科(杨振朋,李 敏,寇永妹,吴丙美,赵永生,李 丹),检验科(李世龙)
杨振朋,李 敏,寇永妹,吴丙美,赵永生,李世龙,李 丹
舒利迭治疗儿童哮喘的疗效及对血PDGF、Eotaxin和IL-35的影响
作者单位:063001 河北 唐山,唐山市人民医院儿科(杨振朋,李敏,寇永妹,吴丙美,赵永生,李丹),检验科(李世龙)
杨振朋,李敏,寇永妹,吴丙美,赵永生,李世龙,李丹
[摘要]目的探讨舒利迭治疗儿童哮喘的临床疗效,观察其对血清中血小板源生长因子(PDGF)、嗜酸粒细胞趋化因子(Eotaxin)和白细胞介素-35(IL-35)的影响。方法选取我院收治的支气管哮喘患儿206例,随机分为两组,对照组(103例)应用辅舒酮治疗,观察组(103例)应用舒利迭治疗。分别检测治疗前后患儿血清中PDGF、Eotaxin和IL-35的表达水平。结果治疗1个月后,观察组的总有效率明显高于对照组;治疗后两组患儿血清PDGF和Eotaxin的表达均下降,IL-35的表达上升,但是治疗后观察组上述3指标的改善幅度明显大于对照组(P<0.05)。结论舒利迭可以改善儿童哮喘的治疗效果,有效调节血清PDGF、Eotaxin和IL-35的含量,优化体液环境和细胞因子的平衡,临床可以积极应用。
[关键词]儿童;哮喘;舒利迭;PDGF;Eotaxin;IL-35
支气管哮喘(简称哮喘)是一种由多种炎性细胞参与的气道慢性炎性疾病,以慢性嗜酸性炎性反应、气道高反应性和气道重塑性为特点,目前已经成为儿童慢性呼吸系统疾病中患病率最高的疾病之一,且呈现逐年上升的趋势[1]。有研究显示,在哮喘发病过程中,血清血小板源生长因子(PDGF)、嗜酸粒细胞趋化因子(Eotaxin)的表达上升,白细胞介素-35(IL-35)的表达下降,启动机体内环境中的瀑布效应,加速病变进展[2-4]。舒利迭是沙美特罗/丙酸氟替卡松复方制剂,近来显示其不仅控制哮喘的效果好,还对内环境中相关的细胞因子有一定的调节作用[5]。本研究针对我院收治的哮喘患儿在常规治疗基础上,应用舒利迭治疗,观察治疗效果及对血清PDGF、Eotaxin和IL-35的影响,以期为临床工作提供理论支持。
1资料与方法
1.1病例资料选择我院2009年1月~2012年12月诊治的支气管哮喘的患儿作为研究对象,共206例,纳入对象均符合中华医学会儿科分会呼吸学组2003年修订的儿童支气管诊断标准[6],均与患儿监护人签定知情同意书,并经医院伦理委员会批准。排除标准:(1)患儿监护人不同意观察的;(2)伴有先天性疾病的患儿;(3)过敏体质的患儿。患儿年龄5~14(8.8±3.3)岁,病程1~12(4.2±2.7)年。按患儿入院顺序进行排序,应用随机数字表法分为两组,观察组103例,年龄5~13(8.7±3.5)岁,病程1~11(4.3±2.4)年;对照组103例,年龄5~14(8.9±3.5)岁,病程1~12(4.0±2.7)年。两组在常规资料的比较中无显著差异,具有可比性。
1.2方法对照组在常规治疗及护理基础上,加用辅舒酮(葛兰素史克公司,国药准字H20010389,每吸含丙酸氟替卡松125 μg),1吸/次,2次/d,疗程1个月。观察组在常规治疗及护理基础上,加用舒利迭50 μg/100 μg(葛兰素史克公司,国药准字H20090561,每吸含沙美特罗50 μg,丙酸氟替卡松100 μg),1吸/次,2次/d,疗程1个月。治疗期间两组患儿有急性哮喘症状时,按需使用万托林气雾剂。
1.3PDGF、Eotaxin和IL-35的检测分别在治疗前及治疗1个月后,于清晨抽取患儿空腹静脉血10 ml,离心后取血清,置于-20 ℃冰箱中保存,样本均于抽血后的2 w内集中检测。PDGF、Eotaxin和IL-35的检测应用酶联免疫吸附法(ELISA),试剂均购自武汉博士德生物技术公司,全自动酶免分析系统为TECAN RMP200。操作均由同一主管检验师完成,严格质量控制。
1.4疗效判断显效:哮喘的临床症状完全缓解,偶有轻度发作但不需要用药即可缓解,最大呼气流量(PEF)恢复正常;有效:临床症状明显缓解,日间或夜间症状评分[7]减少2分,PEF达预计值的80%;无效:临床症状无缓解或加重,日间或夜间症状评分减少<2分,PEF在预计值<80 %。总有效率=(显效+有效)/总例数×100%。
1.5统计学方法应用SPSS13.0统计学软件分析,计量资料采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1两组治疗1个月后疗效的比较治疗1个月后,观察组的总有效率明显高于对照组(P<0.01,表1)。

表1 两组治疗1个月后疗效的比较(例)
注:与对照组比较,①P<0.01
2.2两组治疗前后血清PDGF、Eotaxin和IL-35表达的比较治疗前两组血清PDGF、Eotaxin和IL-35的表达水平无统计学差异,具有可比性;治疗后两组血清PDGF、Eotaxin的表达均下降,IL-35的表达上升;但是治疗后两组PDGF、Eotaxin和IL-35表达差异有统计学意义。见表2。
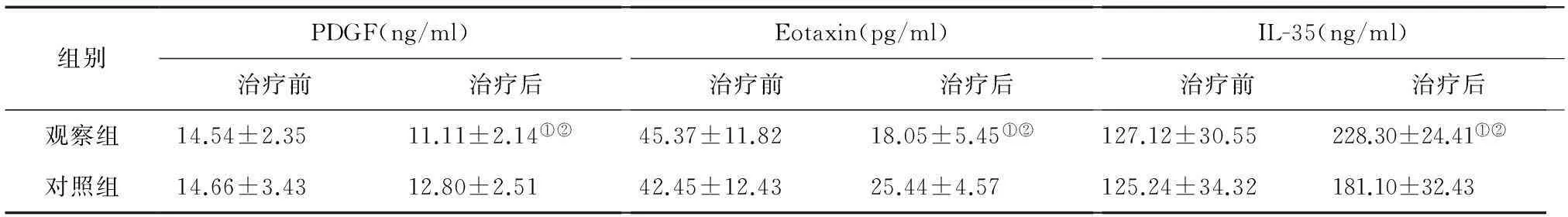
表2 两组治疗前后血清PDGF、Eotaxin和IL-35表达的比较(n=103)
注:与本组治疗前比较,①P<0.05;与治疗后对照组比较,②P<0.05
3讨论
哮喘是由多种细胞和细胞组分参与的气道慢性炎性疾病,免疫相关因子和炎性因子均参与病变的进展。PDGF是哮喘病变形成和进展中的重要蛋白,PDGF在肺组织和气道平滑肌中的表达升高,不仅具有气道重塑作用,还对气道平滑肌细胞的增生有重要影响[8-9]。有研究认为,PDGF可能作为刺激物可以直接促进NF-κB的活性,而相关药物的拮抗作用,可以抑制气道壁的增厚和持续的气道反应性[10-11]。Eotaxin主要来源于内皮细胞、肺泡上皮细胞和巨噬细胞,浆细胞也可以形成少量的Eotaxin[12]。Eotaxin作为一种选择性嗜酸性粒细胞趋化因子,同时也是嗜酸性粒细胞活化的激动剂,可以结合表面受体,引起过敏性炎症损伤[13-14]。也有研究显示,Eotaxin在气道嗜酸性粒细胞浸润中起重要的作用,同时可以使肥大细胞向气道方向进行迁移,参与免疫因子的募集[15]。IL-35是白细胞介素家族的新成员,主要由Treg分泌,在正常机体中的表达稳定,主要发挥抑制炎性反应及免疫因子活性的负向调节作用[16-17]。有研究认为,IL-35可以抑制炎症反应,并防止过度的自身免疫反应的发生[18]。动物实验研究显示,IL-35在经树突状细胞刺激后产生,可以抑制外周血中CD4和CD8阳性的T细胞反应,抑制过敏性病变的进展[19-20]。
本研究结果显示,应用舒利迭治疗儿童哮喘,疗效明确,临床中可以积极应用。舒利迭是沙美特罗/丙酸氟替卡松复方制剂。沙美特罗在吸入后可以均匀沉积在气道黏膜,有效刺激细胞内的腺苷酸环化酶,松弛支气管平滑肌,并维持在12 h以上[21]。丙酸氟替卡松的作用有:(1)高脂溶性特征,对糖皮质激素受体有很高的亲和力,患儿吸入给药后,在肺部停留时间较长,对抑制炎症反应效果明显;(2)通过减少β2受体的脱敏来维持β2受体的敏感性,增强沙美特罗对平滑肌的解痉作用。沙美特罗/丙酸氟替卡松两种成分疗效上互补,剂量准确,均匀吸入,治疗过程中的依从性好,患儿易于接受和掌握[22-23]。
本研究结果还显示,治疗后两组血清PDGF和Eotaxin的表达均下降,而IL-35的表达上升,但是治疗后观察组PDGF和Eotaxin的表达明显低于对照组,IL-35的表达明显高于对照组,提示舒利迭对PDGF、Eotaxin和IL-35的调控作用更强。即舒利迭能更有效地调节PDGF介导的气道重塑作用,调节Eotaxin和IL-35介导的炎性反应平衡。PDGF具有高效的气道重塑作用,当其表达降低后,使气道的纤维化作用减弱,促进损伤的平滑肌细胞再生能力增强,气道的结构更趋正常,同时细胞外基质的降解作用减弱,使气道的收缩程度减低[24]。而Eotaxin表达下调,减少了由Eotaxin诱导的免疫性级联反应的形成,使气道的变应性改变减弱[25],机体的致敏程度下降。IL-35治疗后明显升高,使哮喘患儿炎性反应程度下降,也使抗炎介质介导的炎性保护因子升高,炎细胞活化的作用下降,内环境更趋优化[26]。但舒利迭对PDGF、Eotaxin和IL-35的具体调节作用及相关通路机理尚需更多基础研究来证实。
综上所述,舒利迭治疗儿童哮喘的疗效明显,可能是通过有效下调血清PDGF和Eotaxin的表达,上调血清IL-35的表达,优化内环境而实现的,值得在临床积极应用。
【参考文献】
[1]沈勇, 朱卫元, 姚明. 孟鲁司特联合舒利迭治疗儿童哮喘72例疗效观察[J]. 华北煤炭医学院学报, 2011,13(3): 366-367.
[2]董晓斐,罗银河,刘红萍,等.咳喘宁对哮喘大鼠Eotaxin的调节作用[J].中医药导报, 2013, 19(2): 90-91.
[3]Moldaver DM, Bharhani MS, Wattie JN, et al. Amelioration of ovalbumin-induced allergic airway disease following Der p1 peptide immunotherapy is not associated with induction of IL-35[J]. Mucosal Immunol, 2014, 7(2): 379-390.
[4]Ning Y, Huang H, Dong Y,et al. 5-Aza-2'-deoxycytidine inhibited PDGF-induced rat airway smooth muscle cell phenotypic switching[J]. Arch Toxicol, 2013, 87(5): 871-881.
[5]张茹,赵秀品.舒利迭治疗儿童哮喘疗效观察与分析[J].中国妇幼保健, 2013, 28(20): 3296-3297.
[6]中华医学会儿科学分会呼吸学组,中华医学会中华儿科杂志编辑委员会.儿童支气管哮喘防治常规(试行)[J].中华儿科杂志, 2004, 42(2): 100-106.
[7]全国儿科哮喘防治协作组.儿童哮喘防治常规[J].中华儿科杂志, 1998, 36(12): 747.
[8]Lee-Fowler TM, Guntur V, Dodam J, et al. The tyrosine kinase inhibitor masitinib blunts airway inflammation and improves associated lung mechanics in a feline model of chronic allergic asthma[J]. Int Arch Allergy Immunol, 2012, 158(4): 369-374.
[9]Damera G, Druey KM, Cooper PR,et al. An RGS4-mediated phenotypic switch of bronchial smooth muscle cells promotes fixed airway obstruction in asthma[J]. PLoS One, 2012, 7(1): e28504.
[10]Ning Y, Sun Q, Dong Y, et al. Slit2-N inhibits PDGF-induced migration in rat airway smooth muscle cells: WASP and Arp2/3 involved[J]. Toxicology,2011, 283(1): 32-40.
[11]Spinelli AM, Gonzalez-Cobos JC, Zhang X,et al. Airway smooth muscle STIM1 and Orai1 are upregulated in asthmatic mice and mediate PDGF-activated SOCE, CRAC currents, proliferation, and migration[J]. Pflugers Arch,2012,464(5): 481-492.
[12]Wang TN, Huang MS, Lin MC,et al. Betel chewing and arecoline affects Eotaxing-1, asthma and lung function[J]. PLoS One,2014, 9(3): e91889.
[13]Kuo NW, Gao YG, Schill MS, et al. Structural insights into the interaction between a potent anti-inflammatory protein, viral CC chemokine inhibitor (vCCI), and the human CC chemokine, Eotaxin-1[J]. J Biol Chem,2014, 289(10): 6592-6603.
[14]Neighbour H, Boulet LP, Lemiere C, et al. Safety and efficacy of an oral CCR3 antagonist in patients with asthma and eosinophilic bronchitis: a randomized, placebo-controlled clinical trial[J]. Clin Exp Allergy,2014, 44(4): 508-516.
[15]张慧平,李元霞,庞随军,等.婴幼儿哮喘53例外周血Leptin、Eotaxin、总IgE检测及其临床意义[J].陕西医学杂志, 2013, 42(1): 99-101.
[16]Collison LW, Workman CJ, Kuo TT, et al. The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J]. Nature,2007, 450(7169): 566-569.
[17]Lilly LM, Gessner MA, Dunaway CW, et al. The β-glucan receptor dectin-1 promotes lung immunopathology during fungal allergy via IL-22[J]. J Immunol, 2012,189(7): 3653-3660.
[18]Whitehead GS, Wilson RH, Nakano K, et al. IL-35 production by inducible costimulator (ICOS)-positive regulatory T cells reverses established IL-17-dependent allergic airways disease[J]. J Allergy Clin Immunol,2012, 129(1): 207-215.
[19]Huang CH, Loo EX, Kuo IC, et al. Airway inflammation and IgE production induced by dust mite allergen-specific memory/effector Th2 cell line can be effectively attenuated by IL-35[J]. J Immunol,2011, 187(1): 462-471.
[20]Park BS, Hong GU, Ro JY. Foxp3(+)-Treg cells enhanced by repeated low-dose gamma-irradiation attenuate ovalbumin-induced allergic asthma in mice[J]. Radiat Res, 2013, 179(5): 570-583.
[21]袁大华,黄贤贵.舒利迭联合孟鲁司特钠治疗儿童咳嗽变异性哮喘的疗效观察[J].吉林医学, 2012, 33(5): 960-961.
[22]朱毅,陆丽华.舒利迭与辅舒酮治疗儿童中度支气管哮喘的疗效比较[J].吉林医学, 2009, 30(9): 845-846.
[23]毛春发.舒利迭治疗儿童中、重度哮喘50例疗效分析[J].浙江中医药大学学报, 2009, 33(4): 553-554.
[24]Simeone-Penney MC, Severgnini M, Rozo L,et al. PDGF-induced human airway smooth muscle cell proliferation requires STAT3 and the small GTPase Rac1[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(4): L698-704.
[25]Beal DR, Stepien DM, Natarajan S, et al. Reduction of Eotaxing production and eosinophil recruitment by pulmonary autologous macrophage transfer in a cockroach allergen-induced asthma model[J]. Am J Physiol Lung Cell Mol Physiol,2013,305(11): 866-877.
[26]周月朋,李俊杰,李晓东,等.支气管哮喘患儿外周血IL-27、IL-35及EBI3的表达变化及意义[J].解放军医药杂志, 2014, 26(7): 71-73.
Curative effect of seretide in treatment of asthma of children and its influence on serum PDGF, Eotaxin and IL-35
Yang Zhenpeng1, Li Min1, Kou Yongmei1, Wu Bingmei1, Zhao Yongsheng1, Li Shilong2, Li Dan11. Department of Pediatrics, People's Hospital of Tangshan City, Tangshan, Hebei, 063001, China; 2. Department of Laboratory, People's Hospital of Tangshan City, Tangshan, Hebei, 063001, China
[Abstract]ObjectiveTo explore the clinical curative effect of seretide in the treatment of asthma of children and observe the influence of seretide on platelet-derived growth factor (PDGF), eosinophil chemotactic factor (Eotaxin) and interleukin-35 (IL-35) in serum. Methods Total 206 children with bronchial asthma to receive treatment in our hospital were selected and randomly divided into two groups. In the control group (n=103), flixotide was used for the treatment; in the observation group (n=103), seretide was used for the treatment. Before and after the treatment, the expression levels of PDFG, Eotaxin and IL-35 in serum of the children were examined, respectively. ResultsAfter the treatment for one month, the overall effective rate of the observation group was significantly higher than that of the control group, and the expression levels of PDGF and Eotaxin in both groups decreased but that of IL-35 increased; however, after the treatment, the improvement of the foresaid three indexes in the observation group was significantly greater than that in the control group (P<0.05). Conclusion Seretide can improve the treatment effect on asthma of children, regulate effectively the content of PDGF, Eotaxin and IL-35 in serum, and optimize the balance between the humoral environment and cytokine balance, so it may be positively used for clinical application.
[Key words]children; asthma; seretide; PDGF; Eotaxin; IL-35
(收稿日期:2014-09-28)
文章编号1004-0188(2015)04-0374-04
doi:10.3969/j.issn.1004-0188.2015.04.010
中图分类号R 725.6
文献标识码A
