索拉非尼联合经动脉化疗栓塞治疗原发性大肝癌的疗效
2015-03-07作者单位610083成都成都军区总医院肿瘤中心
作者单位:610083 成都,成都军区总医院肿瘤中心
谭 勇,张 涛,彭晶晶,赵 煜
索拉非尼联合经动脉化疗栓塞治疗原发性大肝癌的疗效
作者单位:610083 成都,成都军区总医院肿瘤中心
谭勇,张涛,彭晶晶,赵煜
[摘要]目的观察索拉非尼联合经动脉化疗栓塞(TACE)治疗原发性大肝癌的临床疗效及安全性。方法将2010年1月~2013年6月我科收治的57例大肝癌(直径≥5 cm)患者随机分为观察组和对照组。观察组29例给予索拉非尼联合TACE治疗,对照组28例给予单纯TACE治疗。比较两组的临床疗效、无进展生存期(PFS)及不良反应发生情况。结果治疗3个月后,观察组治疗有效率和疾病控制率均显著高于对照组(41.4% vs. 14.3%,75.9% vs. 50.0%)(P<0.05)。观察组中位PFS为10.0个月,明显高于对照组的6.0个月(P<0.05)。两组不良反应均在Ⅰ~Ⅱ级,患者耐受良好,未见严重不良反应,两组不良反应发生率无明显差异(P>0.05)。结论索拉非尼联合TACE治疗原发性大肝癌疗效好,患者耐受性良好,安全可靠,能有效延长患者的无进展生存期。
[关键词]索拉非尼;化疗栓塞;肝癌;疗效
原发性肝癌是世界范围内5大恶性肿瘤之一,由于起病多隐匿,多数患者在就诊时已属于中晚期,手术切除率低,往往失去最佳治疗时机,经动脉化疗栓塞(TACE)已成为治疗失去手术时机肝癌患者的首选疗法之一[1]。由于栓塞后侧支循环的形成及门静脉供血系统的存在,单纯TACE往往难以使肿瘤完全坏死,部分患者疗效有限,尤其是大肝癌疗效欠佳[2]。本研究旨在观察比较索拉非尼联合TACE与单纯TACE在治疗大肝癌中的临床疗效及安全性,为临床大肝癌的治疗提供依据。
1资料与方法
1.1病例资料以我科2010年1月~2013年6月收治的57例大肝癌(直径>5 cm)患者为研究对象,研究方案通过我院医学伦理委员会批准同意,患者及家属均签署知情同意书。所有患者均符合原发性肝癌的诊断标准[3],且至少1个肿块直径≥5 cm。所有患者按入院顺序编号,采用随机数字表法分为观察组(n=29)和对照组(n=28)。两组患者在性别、年龄、肿瘤大小、AFP水平、肝功能Child-Pugh分级、UICC肿瘤分期等方面未见明显差异(P>0.05,表1),具有可比性。
1.2治疗方法观察组患者给予索拉非尼联合TACE治疗。采用改良Seldinger法,在局麻下行股动脉插管,常规行肝动脉及肠系膜上动脉造影,根据造影结果,尽可能将导管超选择地插入肿瘤的供血动脉中,而后注入100 mg奥沙利铂[赛诺菲安万特(中国)投资有限公司,国药准字 H20070030],注射时间>15 min。再用“超液化碘油+吡柔吡星(深圳万乐药业有限公司,国药准字 H10930106)40 mg”的混合悬液20~30 ml,缓慢注入目标动脉,必要时辅以明胶海绵颗粒栓塞,栓塞至造影显示病灶血供减少95%以上为止。术后第3 d给予索拉非尼(拜耳药业,国药准字H20110599) 400 mg口服治疗,2次/d,依据不良反应程度调整用药剂量。患者出现3度及以上不可耐受不良反应时,剂量调整为400 mg,1次/d。术后1个月复查CT或MRI评估栓塞疗效,效果不明显者可考虑第2次TACE治疗。再次栓塞前1 d停用索拉非尼,术后第2 d继续服用。对照组患者给予单纯TACE治疗,方法同观察组。治疗3个月后评价疗效。
1.3疗效评价标准 治疗3个月后,采用GE公司64排螺旋CT增强扫描复查,根据图像后处理系统重建图像,观察测量肿瘤病灶的大小。参照mRECIST标准[4]评价疗效,分为:完全缓解(CR):所有病灶未见活性,且无新发病灶出现;部分缓解(PR):肿瘤病灶最大径缩小≥50%,且无新发病灶出现;稳定(SD):肿瘤病灶最大径缩小<50%,增大≤25%;进展(PD):肿瘤病灶最大径增大≥25%或出现新发肿瘤病灶。有效率(RR)=(CR+PR) /总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。毒副反应参照美国国立癌症研究所(NCI-CTC3.0)标准进行评价。
1.4统计学方法 应用SPSS18.0软件进行统计学分析,计数资料以例或(和)率的形式表示,组间率的比较采用χ2检验,采用Kaplan-Meiea分析两组无进展生存期(PFS),以P<0.05为差异有统计学意义。
2结果
2.1临床疗效治疗3个月后,观察组有效率和疾病控制率明显高于对照组(P<0.05,表2)。
2.2生存分析观察组和对照组患者的中位PFS分别为10.0个月和6.0个月,差异具有统计学意义(χ2=4.577,P<0.05,图1)。
2.3不良反应发生情况治疗过程中,观察组2例出现手足皮肤反应,1例出现皮疹,1例出现腹泻;对照组1例出现皮疹。所有患者毒副反应均在Ⅰ~Ⅱ级,未见严重不良反应。两组间不良反应发生率未见明显差异(P>0.05)。
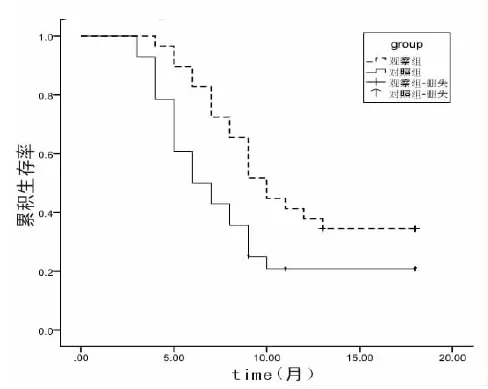
图1 Kaplan-Meier法分析两组中位PFS

组别性别男女年龄(岁)肿瘤大小(cm)AFP水平(μg/L)≤400>400Child-Pugh分级A B UICC肿瘤分期ⅠⅡⅢⅣ观察组191052.3±5.17.5±0.71118209 0 4 16 9对照组171153.1±5.37.3±0.6820199 0 5 17 6

表2 两组疗效比较[n(%)]
注:与对照组相比,①P<0.05
3讨论
肝脏有肝动脉和门静脉双重供血系统,肝癌95%以上的血供来源于肝动脉,阻断肝癌病灶局部肝动脉供血是治疗肝癌的可靠方法[5]。TACE治疗肝癌的原理也是基于肝脏和肝癌病变的生理特征及供血特点。TACE一方面通过造影结果,超选择地栓塞肿瘤的供血动脉,使肿瘤病灶局部缺血坏死;另一方面TACE还能提高肿瘤局部化疗药物的浓度,有效降低全身血药浓度和毒副反应,减轻对肝脏的损害[6]。肿瘤的发生和转移依赖于新生血管形成,阻断肿瘤血管的再生是控制复发的有效途径。TACE术后侧支循环的形成及门静脉的双重供血是导致局部复发、影响介入预后的重要因素。研究发现,单纯TACE术后患者肿瘤的完全坏死率不到40%,远期疗效不够理想[7]。多次TACE治疗还加重了患者肝功能的损害,并发症明显增多。
索拉非尼作为一种口服多激酶抑制剂,是一种新型多靶点分子靶向药物,可通过抑制RAF-1激酶和B-RAF激酶,阻碍ERK磷酸化,从而抑制肿瘤细胞的增殖[8]。血管内皮生长因子(VEGF)及其受体高表达是刺激并启动肿瘤血管的生成,造成肿瘤局部复发的重要因素。索拉非尼还可抑制细胞表面VEGFR-2、VEGFR-3及c-KIT等受体的磷酸化,影响酪氨酸激酶活性,从而到达抑制肿瘤血管生成的作用[9]。已证实索拉非尼对肾癌、肝癌、黑色素瘤等多种肿瘤有抑制作用,也是目前唯一被循证医学证实可显著延长肝癌患者生存时间的药物[7-8]。
Han等[10]报道,索菲拉尼联合TACE治疗肝癌的中位PFS为10.6个月,总生存期为16.5个月,与本研究接近。一项针对进展期肝癌的多中心大型临床研究显示[11],索拉非尼联合TACE治疗进展期肝癌的中位生存期为12个月,明显高于单纯TACE治疗,说明索拉非尼联合TACE能有效延长进展期肝癌患者的无进展生存期和总生存期。本研究结果显示,对于原发性大肝癌患者,经过3个月治疗后,观察组治疗有效率和疾病控制率均显著高于对照组,与Pinter 等[12]的研究基本一致,且观察组中位PFS为10.0个月,明显高于对照组的6.0个月,这些均提示索拉菲尼联合TACE在大肝癌治疗方面具有较好的临床疗效。张应强等[5]的研究还发现,索拉菲尼联合TACE还能显著延长大肝癌患者的肿瘤进展时间,疗效明显优于单纯TACE和单纯索拉菲尼治疗患者(6.0 vs.3.0 vs. 2.5个月)。李湘竑等[13]对10例大肝癌肝移植术后复发的患者应用索拉非尼治疗,并与8例未接受索拉非尼治疗患者进行对比,结果显示索拉非尼治疗组患者生存时间为5~22个月,明显高于对照组(1~8个月),提示索拉非尼能显著延长大肝癌肝移植术后肿瘤复发患者的生存期,且患者耐受良好。
索拉非尼常见的不良反应包括手足皮肤反应、消化道出血、皮疹等[14]。本研究中观察组2例出现手足皮肤反应,1例出现皮疹、1例出现腹泻,但毒副反应均在Ⅰ~Ⅱ级,未见严重不良反应,提示患者耐受性良好。
总之,索拉非尼联合TACE治疗原发性大肝癌疗效确切,能有效延长患者的无进展生存期,且患者耐受性良好,值得临床推广。
【参考文献】
[1]Zhang X, Yang XR, Huang XW, et al. Sorafenib in treatment of patients with advanced hepatocellular carcinoma: a systematic review[J]. Hepatobiliary Pancreat Dis Int, 2012, 11(5): 458-466.
[2]Dong W, Zhang T, Wang ZG, et al. Clinical outcome of small hepatocellular carcinoma after different treatments: a meta-analysis [J]. World J Gastroenterol, 2014, 20(29): 10174-10182.
[3]中国抗癌协会肝癌专业委员会. 原发性肝癌诊断标准[J].中华肝脏病杂志, 2000, 8(3): 135.
[4]Lencioni R, Llovet JM. Modified recist(mRECIST) assessment for hepatocellular carcinoma[J]. Semin Liver Dis, 2010, 30(1): 52-60.
[5]张应强,杨建勇,王于,等. TACE联合索拉非尼治疗大肝癌的疗效与安全性分析[J]. 中华医学杂志, 2013, 93(13): 987-991.
[6]顾国文,李相成. 肝动脉化疗栓塞联合经皮无水乙醇注射治疗不能切除肝癌疗效的荟萃分析[J]. 中华医学杂志, 2009, 89(12): 805-809.
[7]Bai W, Wang YJ, Zhao Y, et al. Sorafenib in combination with transarterial chemoembolization improves the survival of patients with unresectable hepatocellular carcinoma: a propensity score matching study [J]. J Dig Dis, 2013, 14(4): 181-190.
[8]张哲,王艳红,周小芸, 等. 索拉非尼对人肝癌细胞的体外杀伤作用与磷酸化胞外信号调节激酶基础表达水平的关系[J]. 中华实验外科杂志, 2009, 26(10): 1313-1315.
[9]Choi GH, Shim JH, Kim MJ, et al. Sorafenib alone versus sorafenib combined with transarterial chemoembolization for advanced-stage hepatocellular carcinoma: results of propensity score analyses [J]. Radiology, 2013, 269(2): 603-611.
[10]Han G, Yang J, Shao G, et al. Sorafenib in combination with transarterial chemoembolization in Chinese patients with hepatocellular carcinoma: a subgroup interim analysis of the START trial[J]. Future Oncol, 2013, 9(3): 403-410.
[11]Zhao Y, Wang WJ, Guan S, et al. Sorafenib combined with transarterial chemoembolization for the treatment of advanced hepatocellular carcinoma: a large-scale multicenter study of 222 patients [J]. Ann Oncol, 2013, 24(7): 1786-1792.
[12]Pinter M, Hucke F, Graziadei I, et al. Advanced-stage hepatocellular carcinoma: transarterial chemoembolization versus sorafenib [J]. Radiology, 2012, 263(2): 590-599.
[13]李湘竑,钟克波,刘延,等.索拉菲尼治疗肝癌肝移植术后肿瘤复发患者的疗效及安全性分析[J].南方医科大学学报, 2011, 31(9): 1608-1610.
[14]Chung YH, Han G, Yoon JH, et al. Interim analysis of START: study in Asia of the combination of TACE (transcatheter arterial chemoembolization) with sorafenib in patients with hepatocellular carcinoma trial [J]. Int J Cancer, 2013, 132(10): 2448-2458.
Curative effect of sorafenib combined with transcatheter arterial chemoembolization in treatment of large primary liver cancer
Tan Yong, Zhang Tao, Peng Jingjing, Zhao YuCancer Center, General Hospital of Chengdu Military Command, Chengdu, Sichuan, 610083, China
[Abstract]ObjectiveTo observe the curative effect and safety of sorafenib combined with transcatheter arterial chemoembolization (TACE) in treatment of large primary liver cancer. Methods 57 patients with large liver cancer (diameter ≥5 cm) to receive treatment in our hospital from Jan. 2010 to Jun. 2013 were randomly divided into observation group (n=29) and control group (n=28). Sorafenib combined with TACE was administered in the observation group while only TACE was performed on the patients in the control group. And then, the curative effect, progression-free survival (PFS), and incidence of adverse reaction between the two groups were compared. ResultsAfter three months of treatment, the effective rate and disease control rate in the observation group were significantly higher than those in the control group (41.4% vs. 14.3%, 75.9% vs. 50.0%) (P<0.05); the middle level of PFS in the observation group was 10.0 months, significantly higher than that (six months) in the control group (P<0.05); the adverse reactions in both groups were in Grade Ⅰ-Ⅱ, the patients tolerated the treatment well, and no serious adverse reaction, of which the incidences between the two groups had no significant difference (P>0.05). Conclusion Sorafenib combined with TACE in the treatment of large primary liver cancer has good curative effect, and the patients have good tolerance; with safety and reliability, it can effectively prolong the progression-free survival of the patients.
[Key words]sorafenib; chemoembolization; liver cancer; curative effect
(收稿日期:2014-11-17)
文章编号1004-0188(2015)04-0386-04
doi:10.3969/j.issn.1004-0188.2015.04.014
中图分类号R 657.3
文献标识码A
