人骨髓间充质干细胞在体外向成骨细胞定向分化的研究分析
2015-03-07刘志刚余化龙王志勇
刘志刚,熊 敏※,唐 冰,李 锋,余化龙,曾 云,陈 洁,何 宁,王志勇,韩 珩
(1.湖北医药学院附属东风医院骨科研究所,湖北 十堰 442000; 2.华中科技大学同济医学院附属同济医院骨科,武汉 430030)
人骨髓间充质干细胞在体外向成骨细胞定向分化的研究分析
刘志刚1,熊敏1※,唐冰1,李锋2,余化龙1,曾云1,陈洁1,何宁1,王志勇1,韩珩1
(1.湖北医药学院附属东风医院骨科研究所,湖北 十堰 442000; 2.华中科技大学同济医学院附属同济医院骨科,武汉 430030)
摘要:目的探讨人骨髓间充质干细胞在体外向成骨细胞定向分化情况。方法取引产胎儿的人骨髓间充质干细胞进行原代细胞培养,诱导培养向成骨细胞分化,诱导后进行形态学观察,碱性磷酸酶(ALP)染色与生长曲线测定。当人骨髓间充质干细胞培养生长密度为80.0%左右时分为转染组与对照组,对照组不进行转染,转染组常规进行转染。结果原代细胞生长2 h开始贴壁,培养4 d左右胞体逐渐变得粗大。经成骨诱导后细胞形态由长梭形逐渐变为多边形,形成细胞结节甚至团块状。转染组的胎儿骨髓间质干细胞和未转染对照组的生长状况对比差异无统计学意义(P>0.05),转染细胞与未转染细胞倍增时间分别为(23±4) h和(25±4) h。转染组在转染后第3、6、9、12日的ALP活性均明显高于对照组[(0.12±0.02)%比( 0.10±0.02)%,(0.16±0.02)% 比(0.12±0.02)%,(0.20±0.03)% 比(0.13±0.02)%,(0.23±0.04)% 比(0.14±0.02)%],差异有统计学意义(P<0.01)。结论胎儿骨髓间充质干细胞在成骨细胞分化转染的诱导下可促进向成骨细胞进行定向分化,为胎儿间质干细胞分化调控和药物作用机制研究奠定基础。
关键词:人骨髓间充质干细胞;成骨细胞;定向分化;地塞米松;碱性磷酸酶
骨髓间充质干细胞属于成体干细胞,在骨髓中的含量很低,占骨髓内单核细胞总数的1/104~1/105。但是其可在体外分离及大量扩增培养,在不同的诱导剂条件可分化为成骨细胞、软骨细胞和脂肪细胞,也充分证明了骨髓间充质干细胞是多潜能间质干细胞[1-3]。骨髓间充质干细胞因具有独特的优越性而成为骨组织工程中理想的种子细胞,为骨缺损和骨坏死的修复提供了新方法[4-5]。同时骨髓成骨微环境是一个复杂的三维环境,骨髓微环境不仅为细胞间的相互沟通提供场所,也为成骨的增殖和分化提供必要条件,更重要的是它可以在骨髓间充质干细胞向成骨细胞相互作用的基础上产生调控功能,从而保证机体骨细胞的稳定状态[6-7]。骨髓间充质干细胞的转分化包含两种形式:一种骨髓间充质干细胞在不同环境下可分别向不同组织细胞分化[8];另一种是骨髓间充质干细胞向一种组织细胞分化后,在微环境改变的情况下又再向另外的组织细胞转分化[9]。本研究主要探讨人骨髓间充质干细胞在体外向成骨细胞定向分化情况,现报道如下。
1材料与方法
1.1试剂与仪器DMEM培养基、青-链霉素溶液、十二烷基磺酸纳(美国Gibco公司)、胎牛血清、胰蛋白酶、地塞米松(美国Promega公司)、乙二胺四乙酸、维生素C、β-甘油磷酸、二乙醇胺、D-磷酸硝基酚、二甲基亚砜(美国Sigma公司)。293T细胞株、质粒T antigen和PCI1OA1由本实验室保存。倒置相差显微镜(日本Olympus公司)、CO2培养箱(美国Sheldon公司)、超净工作台(中国苏净集团)、低速冷冻离心机和高速冷冻离心机(美国Gigma公司)。
1.2人骨髓间充质干细胞的分离和培养在产妇知情同意与医院伦理批准的前提下,取胎龄4个月的引产胎儿,乙醇消毒后取出四肢长骨。无菌环境下剥离肌肉和骨膜,用微量一次性注射器冲洗骨髓腔。以离心半径10 cm,1000 r/min 离心10 min,弃上清,加入15 mL DMEM培养液重悬细胞。将细胞的浓度调整至107个细胞/mL,重悬后加入装有3 mL Ficoll淋巴分离液的离心管中,以离心半径10 cm,2000 r/min 离心30 min。吸出培基和分离液之间的间质干细胞层,再用DMEM培养基洗涤3次(离心半径10 cm,1000 r/min,5 min)。重悬后将浓度调整至106个细胞/mL,种入25 cm2的塑料培养瓶中,常规在CO2培养箱进行培养与换代。
1.3细胞转染当人骨髓间充质干细胞培养生长密度为80.0%左右时分为转染组与对照组,对照组不进行转染。而转染组在转染前1日,按1×106个细胞/mL将293T细胞密度加入不含抗生素的DMEM 10 mL培养基种入10 cm的培养皿中,常规溶解SV40病毒质粒和包装质粒PCI1OA1和Lipofectamin 2000,混匀后在室温下孵育5~10 min,形成混合物。将前1日种板的293T细胞培基吸掉,加入3 mL上述混合物,孵育6 h后,加入新鲜培养基,培养48 h后将培养基用4.5 μm的滤膜过滤。然后加入50%合的原代间质干细胞,同时加入800 mg/L的Polybene 5 μL。传代后加入含0.5 mg/L的嘌呤霉素进行筛选,继续进行传代。
1.4成骨诱导分化将转染细胞的转染组和未转染的P4代对照组细胞按1×104个细胞/mL密度接种12孔板,第2日换含诱导剂的培基(10%胎牛血清,5 mmol/L β-甘油磷酸、25 mg/L 维生素C、1 mmol/mL地塞米松),传代进行培养。倒置显微镜下观察细胞生长的速度、形态,并进行摄像保存。
1.5细胞生长曲线的测定取生长良好的第3代细胞和转染后的细胞消化制备单细胞悬液,调整细胞浓度为1×104个细胞/mL接种于6 cm培养皿。常规进行培养,每日取出3个培养皿,胰酶消化后计算每皿细胞数,多次测量取均值。以细胞数对数值为纵轴,培养时间为横轴,绘制细胞生长曲线。根据Patterson公式计算细胞群体倍增时间[10]。
1.6碱性磷酸酶 (alkaline phosphatase,ALP)活性测定取转染的与未转染细胞的细胞,用10%胎牛血清洗涤3次,0.04 g/L蛋白酶E消化并收集细胞。然后进行细胞内ALP活性测定,采用分光光度法进行测定,400 nm处测定吸光度,测定3次,取平均值。
2结果
2.1显微观察原代细胞生长2 h开始贴壁,初期细胞呈长梭形伸展贴壁,培养4 d左右后胞体逐渐变得粗大,有细长的突起(图1)。经成骨诱导后,细胞形态由长梭形逐渐变为多边形,胞核大而清晰,单核或2个左右核仁,形成细胞结节甚至团块状(图2)。

图1 原代人骨髓间充质干细胞 (HE染色×20)

图2 诱导剂诱导人骨髓间充质干细胞 (HE染色×20)
2.2细胞转染效果将0.5 mg/L的嘌呤霉素加入转染后的胎儿骨髓间质干细胞,转染组48 h后出现少量死亡细胞,72 h后细胞完全融合。而未转染细胞的对照组全部死亡。而从绘制的生长曲线可以看出,转染组的胎儿骨髓间质干细胞和未转染对照组的生长状况对比差异无统计学意义(P>0.05),转染细胞与未转染细胞倍增时间分别为(23±4) h和(25±4) h。见图3。
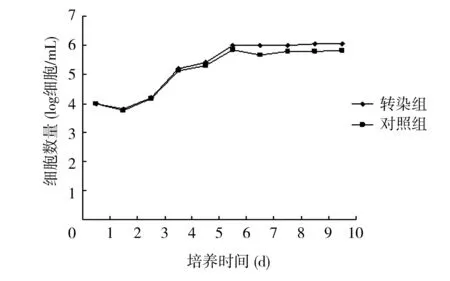
图3 未转染人骨髓间充质干细胞与转染人骨髓间
2.3两组ALP活性比较转染组在转染后第3、6、9、12日的ALP活性均明显高于对照组,差异有统计学意义(P<0.01)。见表1。
表1转染组与对照组转染后第3、6、9、12日ALP活性比较
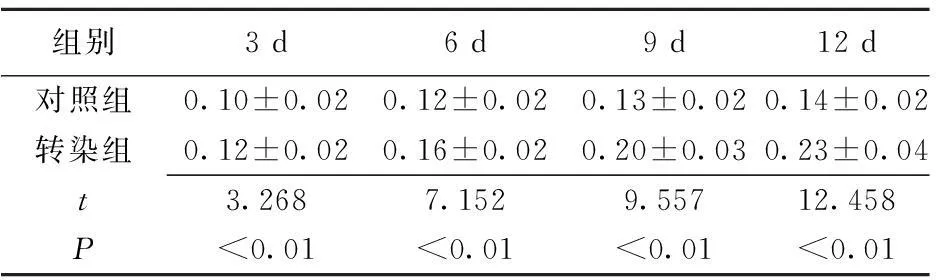
组别3d6d9d12d对照组0.10±0.020.12±0.020.13±0.020.14±0.02转染组0.12±0.020.16±0.020.20±0.030.23±0.04t3.2687.1529.55712.458P<0.01<0.01<0.01<0.01
ALP:碱性磷酸酶; 对照组:不进行转染
3讨论
骨髓间充质干细胞来源于中胚层,具有多向分化潜能,能向成骨细胞、内皮细胞、脂肪细胞、成纤维细胞、网状细胞等分化,是目前应用较广泛的重要种子细胞之一[10-11]。
在体外,建立切实可行的诱导处理分化条件,提高骨髓间充质干细胞向神经元细胞诱导处理的效率,是骨髓间充质干细胞最终应用于临床治疗的基础工作。但骨髓中骨髓间充质干细胞的含量很低,并随年龄增加而减少[12]。要利用骨髓间充质干细胞就必须实现其体外分离培养和克隆。骨髓间充质干细胞具有在塑料培养瓶中贴壁生长的特性,同时操作方法简单、易掌握,是一个较好的分离方法。同时认为在分离骨髓间充质干细胞时选择Percoll分离液对细胞进行分离较好,用Percoll分离液对大鼠骨髓作梯度离心,除去大部分血细胞,收集单个核细胞;用贴壁法培养除去剩余的非骨髓间充质干细胞,该方法所得细胞纯度较高。
通过显微镜下观察发现,胎儿骨髓间质干细胞的形态与文献报道[13]的成人的骨髓间充质干细胞C的形态一致,初期细胞呈长梭形伸展贴壁,培养4 d左右胞体逐渐变得粗大,有细长的突起。传代后生长明显加快,2~7 d为对数生长期,细胞倍增时间为(23±4) h,主要在于胎儿处于发育早期,细胞增殖能力更强。
骨髓间质干细胞的可以自发的向成骨细胞分化,在体外含10%胎牛血清普通培养条件下骨髓间质干细胞还可部分自发地分化成脂肪细胞,不过传代至5~6代细胞即开始出现老化,增殖缓慢,不能形成骨结节[13]。为此本研究用SV40病毒大、小T片段转染原代培养的胎儿骨髓间质干细胞,用嘌呤霉素进行筛选,得到的细胞具有更好的活力。骨髓间质干细胞的体外成骨分化很大程度上依赖于诱导条件,如地塞米松、β-甘油磷酸钠和维生素C作用于骨髓间质干细胞,在特定的浓度下则是诱导其向成骨细胞分化的基本辅剂。其中地塞米松可以诱导骨髓间质干细胞分化表达骨钙素,诱导其ALP活性,刺激细胞外胶原间充质的生物合成、钙的沉积和钙化结节的形成[14]。而β-甘油磷酸钠提供磷离子作为ALP作用的底物,诱导和激活ALP。而在维生素C存在时,β-甘油磷酸钠对ALP的活性增加无明显作用。只有在β-甘油磷酸钠时,骨髓间充质干细胞才发生矿化结节的沉积。而地塞米松的存在不仅促进骨髓间充质细胞生长和分化,而且调节成骨细胞分泌胰岛素样生长因子,促进细胞外间充质胶原合成。本研究骨髓间质干细胞经成骨诱导后,细胞形态由长梭形逐渐变为多边形,胞核大而清晰,单核或2个左右核仁,形成细胞结节甚至团块状。转染组48 h后出现少量死亡细胞,72 h后细胞完全融合。转染组的胎儿骨髓间质干细胞和未转染对照组的生长状况对比差异无统计学意义(P>0.01),转染细胞的倍增时间为(25±4) h。
ALP活性增强是成骨细胞分化成熟的重要标志。ALP是成熟成骨细胞的标志酶之一,其主要作用为水解有机磷酸酶,启动钙化。其活性的增加反映了成骨细胞成熟的程度增高[15]。本研究结果显示,转染组不同时间点的ALP活性均明显高于对照组,差异有统计学意义(P<0.05),表明分离的细胞是骨髓间质干细胞,用SV40病毒基因稳定转染的细胞形态和成骨特性与未转染的细胞无明显差异,多次传代后仍保持良好的增殖及分化状态。而未转染的细胞传至第5~6代后就逐渐老化,失去增殖和分化的能力。
总之,胎儿间质干细胞系是一种很好的研究细胞增殖、分化调控和药物作用机制的细胞模型。胎儿骨髓间充质干细胞在地塞米松、β-甘油磷酸钠和维生素C的诱导下在体外可向成骨细胞进行定向分化,为以后进一步进行胎儿间质干细胞分化调控和药物作用机制研究打下了基础。
参考文献
[1]Foster SR,Roura E,Thomas WG.Extrasensory perception:odorant and taste receptors beyond the nose and mouth[J].Pharmacol Ther,2013,23(11):163-165.
[2]Tang N,Zhao Y,Feng R,etal.Lysophosphatidic acid accelerates lung fibrosis by inducing differentiation of mesenchymal stem cells into myofibroblasts[J].J Cell Mol Med,2014,18(1):156-169.
[3]Granéli C,Thorfve A,Ruetschi U,etal.Novel markers of osteogenic and adipogenic differentiation of human bone marrow stromal cells identified using a quantitative proteomics approach[J].Stem Cell Res,2013,12(1):153-165.
[4]Gang EJ,Bosnakovski D,Figueiredo CA,etal.SSEA-4 identifies mesenchymal stem cells from bone marrow[J].Blood,2007,109(4):1743-1751.
[5]Heino TJ,Hentunen TA,Vaananen HK.Conditioned medium from osteocytes stimulates the proliferation of bone marrow mesebchymal stem cells and their differentiation into osteoblasts[J].Exp Cell Res,2004,294(2):458-468.
[6]Rose FR.Multilineage potential of adult human mesenchymal stem cell[J].Biochem Biophys Res Commun,2002,292(2):115-116.
[7]Barry FP,Boynton BE,Haynesworth S,etal.The monoclonal antibody SH-2,Raised against human mesenchymal stem cells,recognizes an epitope on endoglin(CD105) [J].Biochem Cell Biol,2004,36(2):568-569.
[8]Noel D,Douad F,Jorgense C.Regenerative medicine through mesenchymal stem cells for bone and cartilage repair[J].Curr Opin Investing Drug,2010,3(10):1000-1004.
[9]Farah MH,Olson JM,Sucic HB,etal.Generation of neurons by transient expression of neural bHLH proteins in mammalian cells[J].Development,2010,127(4):693-697.
[10]Whitfield MJ,Lee WC,Van Vliet KJ.Onset of heterogeneity in culture-expanded bone marrow stromal cells[J].Stem Cell Res,2013,11(3):1365-1377.
[11]Peng Y,Li Z,Li Z.GRP78 secreted by tumor cells stimulates differentiation of bone marrow mesenchymal stem cells tocancer-associated fibroblasts[J].Biochem Biophys Res Commun,2013,440(4):558-563.
[12]Sampson S,Botto-van Bemden A,Aufiero D.Autologous bone marrow concentrate:review and application of a novel intra-articular orthobiologic for cartilage disease[J].Phys Sportsmed,2013,41(3):7-18.
[13]Liu R,Yang Y,Yan X,etal.Abnormalities in cytokine secretion from mesenchymal stem cells in psoriatic skin lesions[J].Eur J Dermatol,2013,23(5):600-607.
[14]Martinez C,Henao A,Rodriguez JE,etal.Monitoring steady flow effects on cell distribution in engineered valve tissues by magnetic resonance imaging[J].Mol Imaging,2013,12(7):1-13.
[15]Rohaina CM,Then KY,Ng AM,etal.Reconstruction of limbal stem cell deficient corneal surface with induced human bone marrow mesenchymal stem cells on amniotic membrane[J].Transl Res,2013,8(10):1931-1932.
欢 迎 阅 读《 医 学 综 述 》半月刊6-106
The Basic Research Analysis of Direct Differentiation of Human Bone Marrow Mesenchymal Stem Cells into Osteoblasts in VitroLIUZhi-gang1,XIONGMin1,TANGBing1,LIFeng2,YUHua-long1,ZENGYun1,CHENJie,HENing1,WANGZhi-yong1,HANHeng1.(1.DepartmentofOrthopedicsInstitute,AffiliatedDongfengHospitalofHubeiMedicalCollege,Shiyan442000,China; 2.DepartmentofOrthopedics,TongjiHospitalAffiliatedtoTongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan430030,China)
Abstract:ObjectiveTo discuss human bone marrow mesenchymal stem cells differentiation into osteoblasts in vitro.MethodsHuman bone marrow mesenchymal stem cells of induced labor fetus were taken for primary culture to induce osteoblast differentiation,the morphology was observed,the alkaline phosphatase(ALP) staining and the growth curve were determined.When human bone marrow mesenchymal stem cell culture growth density was about 80.0%,they were divided into two groups:transfection group and control group,the control group was not transfected,the transfection group was givenconventional transfection.ResultsThe primary cell were adherent growth after 2 h and showed stretch fusiform adherent cells after cultured for 4 days.The cell body gradually became thick and showed elongated protrusions.After inducing,the cells showed morphology.The cells growth conditions between the transfected fetal bone marrow mesenchymal stem cells and the untransfected cells showed no significant difference(P>0.05).The doubling time of the transfected cells and non-transfected cells were (23±4) h and (25±4) h respectively.The ALP activity of the transfection group was significantly higher at different times [(0.12±0.02)% vs ( 0.10±0.02)%,(0.16±0.02)% vs (0.12±0.02)%,(0.20±0.03)% vs (0.13±0.02)%,(0.23±0.04)% vs (0.14±0.02)%] (P<0.01).ConclusionHuman bone marrow mesenchymal stem cells directly differentiated into osteoblasts in vitro under induction,which can be the basis for further fetal interstitial stem cell differentiation regulation and study on the drug action mechanisms.
Key words:Human mesenchymal stem cells; Osteoblasts; Directed differentiation; Dexamethasone; Alkaline phosphatase
收稿日期:2015-02-11修回日期:2015-06-11编辑:伊姗
基金项目:十堰市科学技术研究与开发项目计划(14Y50)
doi:10.3969/j.issn.1006-2084.2015.18.056
中图分类号:R468-2
文献标识码:A
文章编号:1006-2084(2015)18-3412-03
