激肽释放酶结合蛋白KBP在炎症中的作用机制及研究进展
2015-03-07何梦梅综述审校
何梦梅(综述),于 靖(审校)
(同济大学附属上海市第十人民医院眼科,上海 200072)
激肽释放酶结合蛋白KBP在炎症中的作用机制及研究进展
何梦梅△(综述),于靖※(审校)
(同济大学附属上海市第十人民医院眼科,上海 200072)
摘要:激肽是激肽释放酶-激肽系统的终末效应物质,并且存在于许多组织器官中,参与各种生物学功能的调控。研究发现组织激肽酶结合蛋白(KBP)是一种激肽释放酶的特殊抑制因子,它可以通过抑制激肽释放在一定程度上发挥生物学作用。KBP抑制炎症作用是其重要作用之一。KBP通过抑制激肽释放酶-激肽系统、促进巨噬细胞细胞因子信号抑制子3的表达、抑制氧化应激等途径,最终调控炎症因子的水平,从而有效抑制炎症。
关键词:激肽释放酶结合蛋白;炎症;激肽释放酶-激肽系统
激肽释放酶结合蛋白(Kallikrein-binding protein,KBP)是一种组织激肽酶特殊抑制因子,它广泛存在于肾脏、肺、胰腺、视网膜等,发挥不同的生物学功能。近几年其对炎症的作用越来越受到重视。炎症的病因不同,但其最终都有共同的致病机制,KBP通过多种途径作用于炎症通路,最终抑制炎性因子的释放,从而抑制炎症反应,所以该文将深入研究KBP对炎症的作用机制,为炎症的防治提供新的手段。
1KBP的分子结构
KBP最早是由Chao等[1]在大鼠血清中被分离出来的。KBP是相对分子质量为60 000左右的酸性糖蛋白,由401个氨基酸组成,等电位点为4.2~4.6, 其终止氨基酸天冬氨酸可与激肽释放酶形成一种对热和十二烷基硫酸稳定的92 000共价复合物[1]。KBP是一种组织激肽释放酶的特殊抑制因子,其互补DNA最早是从大鼠肝脏互补DNA文库中获得,其有5个外显子,最终编码416个氨基酸,与α1-抗胰凝乳蛋白酶有68.8%同源性,Chai等[2]将编码人KBP的基因克隆并测序,发现该基因位于染色体14q31~q32.1,与编码其他丝氨酸蛋白酶抑制剂超家族(serine proteins inhibitors,serpins)的基因位点接近,且与serpins有较多的同源序列,因此认为KBP也是该家族成员,同时被命名为丝氨酸蛋白酶抑制因子A类3K成员[1]。KBP主要在肝脏合成和分泌,同样广泛存在于肾脏、肺、胰腺、视网膜等。
2KBP与激肽释放酶-激肽系统的关系
激肽释放酶-激肽系统(Kallikrein-kinin system,KKS)由激肽释放酶原、激肽释放酶(kallikrein,KLK)、激肽原、激肽和激肽受体组成。激肽原由肝脏合成,其在血浆中浓度很高,分为高分子量激肽原(high molecular weight kininogen,HK)和低分子量激肽原(low molecular weight kininogen,LK)两种。前激肽释放酶和激肽释放酶前体在不同的化学和生物学刺激下可被激活,分别转化为组织激肽释放酶和血浆激肽释放酶,KLK是一种存在于腺体细胞、中性粒细胞和生物体液中的丝氨酸蛋白酶,激活的KLK作用于激肽原,其中血浆激肽酶将HK转化为缓激肽和赖氨酸缓激肽,而组织激肽酶将LK转化为赖氨酸缓激肽[3](图1), 赖氨酸缓激肽在酶的作用下可以转化为缓激肽。缓激肽通过自分泌-旁分泌机制释放,与组织器官中的激肽受体结合后调节一系列具有生物学活性的介质释放, 缓激肽还可通过其受体在细胞增殖、迁移和凋亡中发挥重要作用。
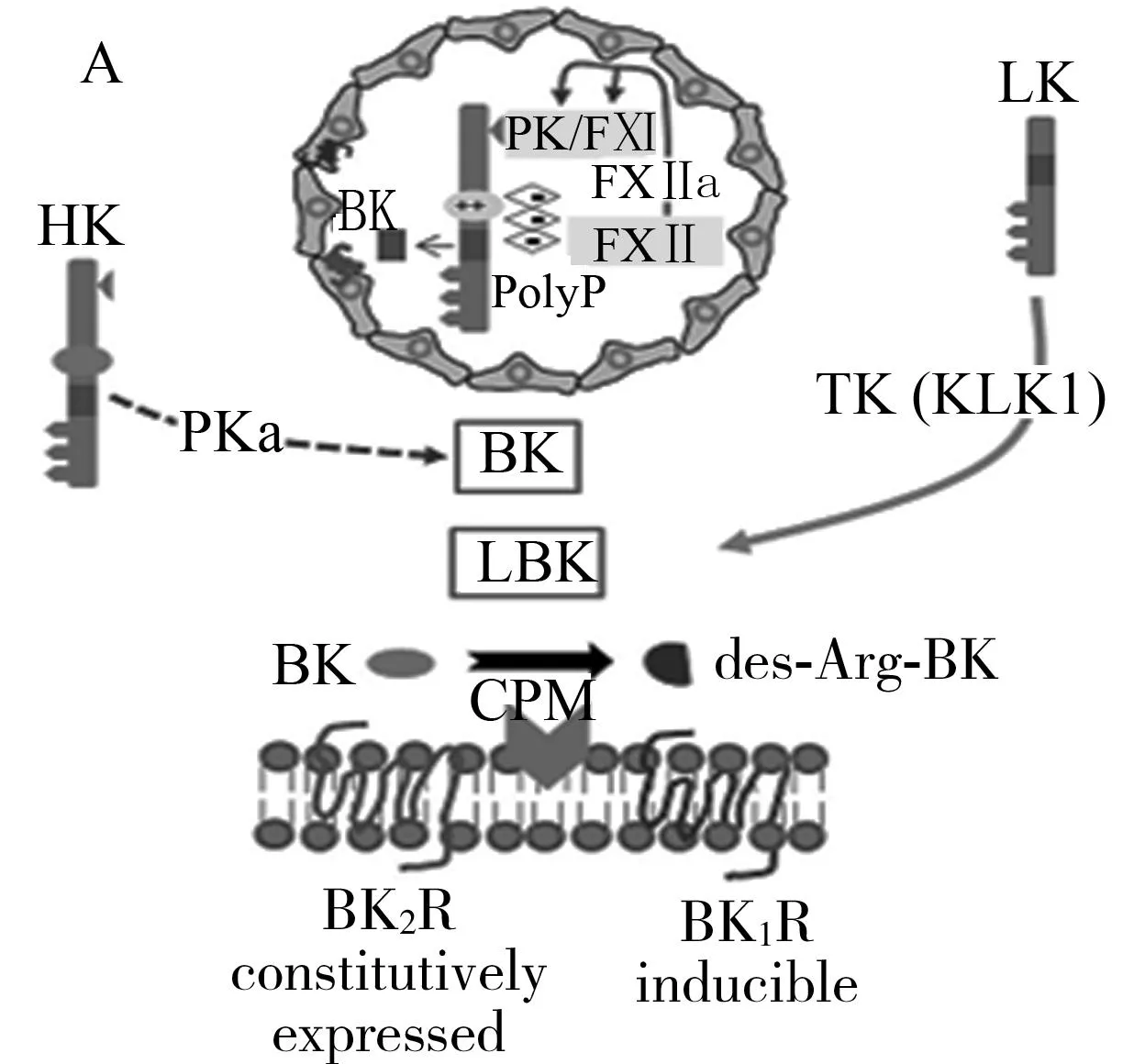
HK:高分子量激肽原;LK:低分子量激肽原;BK:缓激肽;LBK:赖氨酸缓激肽;TK:组织激肽释放酶;PK:血浆激肽释放酶;PolyP:磷酸化;FⅫ:因子Ⅻ;CPM:羧肽酶M;des-Arg-BK:血管性激肽
图1KKS系统作用机制[4]
激肽作为KKS的终末效应物质存在于许多组织器官中,参与器官功能调节和多种病理生理过程。KKS除了对机体心血管系统、凝血系统、纤溶系统和肾功能等正常生理过程有调节作用外,在高血压、炎症、疼痛、血管生成、细胞增殖、凋亡和肿瘤发生等诸多的病理生理过程中也有着不可替代的作用。KBP通过与KLK结合,阻止HK转化为缓激肽,从而降低内皮细胞释放的组织纤溶酶原激活物、NO、前列腺素I2等因子水平,通过阻断KKS,在一定程度上产生一系列生物学反应[5]。
3KBP生物学作用
KBP具有不依赖于激肽释放酶的功能。①KBP对血压有调控作用:Chen等[6]报道KBP转基因小鼠的动脉血压显著降低,外源性给予KBP蛋白药物也可以显著降低小鼠的血压。在自发性高血压大鼠中,KBP水平明显下降[7]。②KBP能抑制新生血管的生成:研究发现KBP能抑制脉络膜新生血管的生成[8],还可以抑制银屑病皮损内血管的增生[9],KBP通过与受体结合后下调血管内皮生长因子表达,从而抑制新生血管的生成,减少血管渗漏[10]。③抑制肿瘤细胞增生:Lu等[11]和Zhu等[12]研究发现,KBP一方面可通过诱导新生血管内皮细胞凋亡,从而抑制肿瘤新生血管,另一方面通过下调低氧诱导因子α/血管内皮生长因子信号通路抑制肿瘤细胞的旁分泌,从而抑制胃癌、肝癌的生长。④KBP能促进视神经的再生:KBP对视神经损伤后视网膜神经节细胞具有保护作用[13]。⑤KBP能促进生长发育:Hatcher 等[14]的实验提示,KBP可能参与机体生长激素的调控。KBP还有助于细胞分化和神经发育[15]。⑥KBP有抗炎作用:Ma等[7]发现,KBP基因启动子区域含有激活子蛋白1结合位点和白细胞介素(interleukin,IL)6反应原件,提示KBP可能与炎症反应存在相关性。
大量的实验研究表明,KBP负调控炎症反应,它可以从多种途径抑制炎症反应。KBP可以抑制关节炎模型大鼠的炎症反应并降低关节肿胀程度[5]。与α-抗胰凝乳蛋白酶介导的急性期反应相比较,KB是负急性期反应物,在脓毒性休克大鼠急性炎症期中,KBP的信使RNA水平在肝脏中呈时间依赖性下降[16]。且雄性大鼠中的KBP信使RNA水平相对高于雌性大鼠[1],由此考虑KBP与炎症发生的相关性。在转基因大鼠过表达KBP时,脂多糖介导的炎症反应的发生率会有所下降[1,17]。KBP还可以通过抑制肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)诱导的炎症反应,从而抑制血管炎症反应,同时也抑制肿瘤细胞的增生[18]。
4KBP作用于炎症的机制
4.1抑制KKSKBP可通过抑制KKS,最终抑制激肽的生成来抑制炎症。阳艾珍和武艺[19]发现,血浆激肽酶-激肽系统的活化可促进关节炎内皮祖细胞归巢,当给予血浆激肽释放酶抑制剂后发现植入的内皮祖细胞在关节炎急性期向炎性滑膜的募集被显著抑制,提示KKS的活化可介导关节炎的发生和发展,当KBP通过抑制KLK阻断KKS,可有效降低炎症反应的发生率。研究发现,调控KLK对炎症的进展至关重要。作为Serpins家族的成员,KBP通过与激肽释放酶结合形成共价复合物,并扭转复合物中蛋白酶的结构,使酶的活性位点转变,通过水解作用抑制复合物中蛋白酶释放[20]。KBP与KLK结合,抑制HK转化为激肽,减少激肽对调控炎性因子释放的刺激作用,从而降低血浆中炎性因子水平,起到抑制炎症的作用。
4.2促进巨噬细胞细胞因子信号抑制子(suppressor of cytokine signaling,SOCS)3的表达SOCS是各种细胞因子的负性调控蛋白,其家族共有8个成员,其中SOCS1和SOCS3参与脂多糖-Toll样受体4信号通路的负性调节。SOCS3是KBP抑制炎症反应的关键分子。实验发现,KBP预处理脂多糖介导的脓毒性休克模型可降低TNF-α的释放,而将SOCS3基因敲除,此时KBP不能抑制TNF-α蛋白的分泌。SOCS3增多将阻断脂多糖-Toll样受体通路4引起的级联信号,最终导致TNF-α等促炎因子的下调。
进一步明确KBP对SOCS3的作用,发现SOCS3在正常情况下主要分布在细胞质,细胞核内很少,经脂多糖处理后,核内SOCS3增多,而经KBP干预后,胞质SOCS3明显增多,细胞形态恢复到正常情况[21],提示KBP对SOCS3有调控作用,KBP通过调控SOCS3来进一步抑制炎性因子的释放。
Qasimi等[22]发现,脂多糖刺激所产生的IL-10能显著上调SOCS3。KBP单独处理小鼠不能上调IL-10,只有在脂多糖刺激的前提下才更明显上调IL-10的水平,所以KBP可能通过IL-10/STATE3的信号通路上调SOCS3的表达。
4.3抑制氧化应激大量的实验表明炎症和氧化应激是相互关联的。活性氧类激活p38丝裂原激活蛋白激酶和核因子κB的活性导致炎性因子的释放和炎性细胞的聚集[23]。NO是有效的抗氧化剂,通过直接作用于还原型辅酶Ⅱ的细胞膜,组成并募集还原型辅酶Ⅰ/还原型辅酶Ⅱ氧化物的亚基,从而抑制中性粒细胞超氧化阴离子的产生。实验表明,当给予达尔-盐敏感性大鼠高盐饮食后,NO合酶的活性降低,导致NO产生受抑制,其作用于还原型辅酶Ⅱ氧化物的途径受阻,肾脏还原型辅酶Ⅱ的活性升高,达尔-盐敏感型大鼠尿H2O2、血栓素B2的分泌增加[24],氧化应激通过刺激促炎分子和促纤维化分子的表达而介导大鼠肾损伤[25]。所以增加NO水平和降低氧化应激对于抑制肾脏炎症和纤维化至关重要。KBP干预可以修复内皮NO合酶的表达,从而增加NO的水平,并可以有效减少肾脏还原型辅酶Ⅱ氧化物的活性和超氧化物的产生,通过抑制活性氧的形成,阻断了TNF-α通路,减少TNF-α、细胞间黏附分子1和血管细胞黏附分子1等促炎介质的表达,起到抑制炎症作用[17]。KBP是分泌型蛋白,其抗炎作用也可以是通过受体介导。Zhang等[26]发现,KBP能与视网膜神经胶质细胞表面特异性结合,且有一定的饱和性,提示KBP可能结合细胞表面的分子抑制氧化应激。
4.4KBP抑制炎性因子释放KBP通过抑制KKS、促进SOCS3的表达、抑制氧化应激等途径,最终都通过调节炎性因子抑制炎症反应,所以KBP的水平在很大程度上影响炎症的严重程度。戴智育[27]用脂多糖诱导急性炎症反应并将其作为炎症动物模型,给予KBP干预后,检测细胞TNF-α的表达情况,发现KBP预处理组TNF-α上调的水平明显减弱,炎性因子释放明显降低。Chen等[6]发现,用LPS介导大鼠炎症反应模型后,转基因过表达KBP的大鼠比非转基因大鼠脓毒性休克病死率低,提示KBP的水平在很大程度上影响脓毒性休克的严重程度。
5小结与展望
多项研究证实KBP与炎症反应的调控密不可分。KBP可以通过抑制激肽生成进一步降低脓毒性休克的发生率和严重程度。KBP可以通过上调SOCS治疗免疫性、炎症性疾病[28]。KBP可通过有效的抗氧化作用,治疗氧化应激的损伤[17]。总之,KBP作为serpins家族成员,其抗炎作用越来越受到重视。KBP可以通过多种抗炎机制,阻断炎症反应通路,从而有望成为治疗炎症性疾病的新靶点。
参考文献
[1]Chao J, Chai KX,Chen LM,etal.Tissue kallikrein-binding protein is a serpin. I. Purification,characterization, and distribution in normotensive and spontaneously hypertensive rats[J].J Biol Chem,1990,265(27):16394-16401.
[2]Chai KX,Ward DC,Chao J,etal.Molecular cloning, sequence analysis,and chromosomal localization of the human protease inhibitor 4 (kallistatin) gene (PI4) [J].Genomics,1994,23(2):370-378.
[3]汪涛,康毅,娄建石,等.激肽释放酶-激肽系统的心血管领域研究进展[J].中国药理学与毒理学杂志,2003,17(6):466-470.
[4]Scharfstein J,Andrade D,Svensj E,etal.The kallikrein-kinin system in experimental Chagas disease:a paradigm to investigate the impact of inflammatory edema on GPCR-mediated pathways of host cell invasion by Trypanosoma cruzi[J].Front Immunol,2013,3:396.
[5]Wang CR,Chen SY,Wu CL,etal.Prophylactic adenovirus-mediated human kallistatin gene therapy suppresses rat arthritis by inhibiting angiogenesis and inflammation[J].Arthritis Rheum,2005,52(4):1319-1324.
[6]Chen LM,Ma JX,Liang YM,etal.Tissue kallikrein-binding protein reduces blood pressure in transgenic mice[J].Biol Chem,1996,271(44):27590-27594.
[7]Ma JX,Chao J,Chao L.Identification and characterization of two promoters of rat kallikrein-binding protein gene[J].Biochim Biophys Acta,1996,1307(3):285-293.
[8]席晓婷,陈前波,唐志萍,等.激肽释放酶结合蛋白对脉络膜新生血管抑制作用研究[J].中华眼底病杂志,2012,28(6):610-614.
[9]李群,谭国珍,石臻睿,等.激肽释放酶结合蛋白对银屑病动物模型的治疗作用观察[J].皮肤性病诊疗学杂志,2014 (1):11-15,25.
[10]Gao G,Shao C,Zhang SX,etal.Kallikrein-binding protein inhibits retinal neovascularization and decreases vascular leakage[J]. Diabetologia,2003,46(5):689-698.
[11]Lu L,Yang Z,Zhu B,etal.Kallikrein-binding protein suppresses growth of hepatocellular carcinoma by anti-angiogenic activity[J].Cancer Lett,2007,257(1):97-106.
[12]Zhu B,Lu L,Cai W,etal.Kallikrein-binding protein inhibits growth of gastric carcinoma by reducing vascular endothelial growth factor production and angiogenesis[J].Mol Cancer Ther,2007,6(12 Pt 1):3297-3306.
[13]金顺祥,曾勇,万静,等.激肽释放酶结合蛋白对大鼠视神经不完全损伤后视网膜神经细胞的保护作用及轴突再生的研究[J].南方医科大学学报,2010,30(4):738-741.
[14]Hatcher HC,Wright NM,Chao J,etal.Kallikrein-binding protein is induced by growth hormone in the dwarf rat[J].FASEB J,1999,13(13):1839-1844.
[15]Lyons DA,Naylor SG,Mercurio S,etal.KBP is essential for axonal structure,outgrowth and maintenance in zebrafish, providing insight into the cellular basis of Goldberg-Shprintzen syndrome[J].Development,2008,135(3):599-608.
[16]Chen LM,Chao L,Chao J.Beneficial effects of kallikrein-binding protein in transgenic mice during endotoxic shock[J].Life Sci,1997,60(17):1431-1435.
[17]Shen B,Hagiwara M,Yao YY,etal. Salutary effect of kallistatin in salt-induced renal injury, inflammation, and fibrosis via antioxidative stress[J].Hypertension,2008,51(5):1358-1365.
[18]Yin H,Gao L,Shen B,etal.Kallistatin inhibits vascular inflammation by ntagonizing tumor necrosis factor-alpha-induced nuclear factor kappaB activation[J]. Hypertension,2010,56(2):260-
267.
[19]阳艾珍,武艺.血浆激肽释放酶-激肽系统的活化促进关节炎内皮祖细胞归巢[J].南通大学学报:医学版,2012,32(2):96-99.
[20]Fischer J,Meyer-Hoffert U.Regulation of kallikrein-related peptidases in the skin-from physiology to diseases to therapeutic options[J].Thromb Haemost,2013,110(3):442-449.
[21]Dai Z,Lu L,Yang Z,etal. Kallikrein-binding protein inhibits LPS-induced TNF-α by upregulating SOCS3 expression[J].Cell Biochem,2013,114(5):1020-1028.
[22]Qasimi P,Ming-Lum A,Ghanipour A,etal.Divergent mechanisms utilized by SOCS3 to mediate interleukin-10 inhibition of tumor necrosis factor alpha and nitric oxide production by macrophages[J].J Biol Chem,2006,281(10):6316-6324.
[23]Gloire G,Legrand-Poels S,Piette J.NF-kappaB activation by reactive oxygen species:fifteen years later[J].Biochem Pharmacol,2006,72(11):1493-505.
[24]Taylor NE,Glocka P,Liang M,etal.NADPH oxidase in the renal medulla causes oxidative stress and contributes to salt-sensitive hypertension in Dahl S rats[J].Hypertension,2006,47(4):692-698.
[25]Yoshihara F,Suga S,Yasui N,etal.Chronic administration of adrenomedullin attenuates the hypertension and increases renal nitric oxide synthase in Dahl salt-sensitive rats[J].Regul Pept,2005,128(1):7-13.
[26]Zhang B, Abreu JG, Zhou K,etal. Blocking the Wnt pathway, a unifying mechanism for an angiogenic inhibitor in the serine proteinase inhibitor family[J].Proc Natl Acad Sci U S A,2010,107(15):6900-6905.
[27]戴智育.Serpins家族成员PEDF调控脂代谢和KBP抗炎作用和机制研究[D].广州:中山大学,2013.
[28]Alexander WS,Hilton DJ.The role of suppressors of cytokine signaling (SOCS) proteins in regulation of the immune response[J].Annu Rev Immunol,2004,22:503-529.
The Mechanism of Action of KBP in Inflammation and Its Research ProgressHEMeng-mei,YUJing. (DepartmentofOphthalmology,TongjiUniversityAffiliatedShanghaiTenthPeople′sHospital,Shanghai200072,China)
Abstract:Plasmakinin,the terminal effective substance of Kallikrein-kinin system,exsists in many tissues and organs,and regulats a variety of biological functions.Kallikrein-binding protein(KBP) is previously identified as a kind of special inhibitor of kallikrein,which inhibits the biological response via preventing the release of plasmakinin. Suppressing inflammation is one of the most important effects of KBP. It inhibits the inflammatory response by preventing the release of plasmakinin,promoting the expression of SOCS3 of macrophage,and suppressing the oxidative stress,and ultimately,it regulates the level of cytokine and thus suppresses inflammation effectively.
Key words:Kallikrein-binding protein; Inflammation; Kallikrein-kinin system
收稿日期:2014-12-08修回日期:2015-02-26编辑:相丹峰
基金项目:国家自然基金面上项目(81470648);上海市卫生系统优秀青年人才培养计划(XYQ2011067)
doi:10.3969/j.issn.1006-2084.2015.18.002
中图分类号:R773.4; R771.2
文献标识码:A
文章编号:1006-2084(2015)18-3268-04
