摄食行为对单纯性肥胖症胃排空与自主神经功能的影响
2015-03-07刘红芬刘丽常丽丽范亚坤
刘红芬,刘丽,常丽丽,范亚坤
摄食行为对单纯性肥胖症胃排空与自主神经功能的影响
刘红芬,刘丽,常丽丽,范亚坤
目的 观察不同摄食行为单纯性肥胖症胃排空速率和自主神经活动特征,探讨摄食行为与胃排空异常的关系。方法 将50例单纯性肥胖症患者根据饮食行为分为暴食症组(A组,n=18)、正常饮食组(B组,n=19)、功能性消化不良组(C组,n=13),并设健康对照组(D组,n=20)。各组进食99Tcm-DTPA标记的实验餐后采用单光子发射计算机扫描(SPECT)采集胃部图象,计算胃半排空时间及胃排空率。采用十二导联动态心电记录仪记录进餐前30min、餐后30min心电信号,分别进行心率变异性分析,时域参数包括RR间期的标准差(SDNN)、相邻正常R-R间期差值的均方根(RMSSD)、24h内每5min正常R-R间期标准差的平均值(SDNNindex);频域参数包括超低频功率(VLF)、低频功率(LF)、高频功率(HF)。结果 与D组比较,A组胃半排空时间显著缩短、排空率显著增高(P<0.01);B组无明显差异(P>0.05);C组半排空时间明显延迟、排空率下降(P<0.05)。餐前A组RMSSD、SDNN、SDNNindex、VLF、HF、LF高于D组(P<0.05,P<0.01),迷走、交感神经均活跃;B组LF低于D组(P<0.05),交感神经活性低;与餐前相比,餐后D组SDNN、HF降低,SDNNindex、RMSSD、VLF、LF增加,交感神经活跃;A组、B组SDNNindex、SDNN、VLF、LF降低,RMSSD、HF增高(P<0.01),迷走神经明显活跃,交感神经活性降低;C组RMSSD、SDNN降低,VLF、LF、HF增加(P<0.01),交感、迷走神经均活跃。结论 单纯性肥胖不同摄食行为者均存在自主神经异常,均存在餐后迷走神经活跃,但其胃排空情况却不同,表明胃排空能是导致肥胖的主要原因之一,但并非惟一因素,自主神经活动可影响胃排空。
单纯性肥胖;不同摄食行为;胃排空;自主神经
【DOI】 10.3969 /j.issn.1671-6450.2015.03.009
肥胖症在全球发病率呈逐年上升趋势,带来严重的健康影响和社会经济负担。肥胖症中最常见的是单纯性肥胖症,约占95%。食物摄入超过能量消耗是肥胖症发生的关键,决定食物摄入量的主要因素是胃容量及胃排空速度,尤以后者为主[1,2]。但目前对单纯性肥胖症胃排空速率的研究结果不一,多数报道显示胃排空有加快趋势[3],也有研究者得出胃排空延缓的相反结果[4],另外一些研究则显示与正常人相比无明显变化[5]。我们分析这种差异的产生或与入选的肥胖者饮食行为习惯存在差异有关。据报道单纯性肥胖者可存在不同的摄食行为,包括(1)暴食症者:表现为进餐速度快且一次进餐量大于正常体质量者,或进餐次数多、易饥饿,无自引呕吐行为;(2)饮食正常者:进餐速度和进餐量与正常体质量者相似;(3)功能性消化不良者:表现为早饱、腹胀、进餐量小于正常者。不同的摄食行为可能影响胃的排空速率。因此,本研究将观察不同摄食行为对单纯性肥胖者胃排空的影响。同时,胃排空速率还可受到自主神经(交感神经与迷走神经)活性的影响,因此,本研究还通过心率变异性(heart rate variability, HRV)分析观察单纯性肥胖症者进餐前后自主神经功能的变化,并分析其与胃排空的关系,旨在进一步探讨肥胖发病机制,为控制肥胖提供新思路。
1 资料与方法
1.1 临床资料 选取2011年7月—2013年6月于石家庄市第一医院内科就诊的单纯性肥胖症患者50例,入选标准为体质量指数(BMI)≥30 kg/m2,排除标准:(1)继发性肥胖;(2)胃镜检查有上消化道器质性疾病;(3)妊娠期、哺乳期、月经期女性;(4)有严重心、肝、肾、造血系统等原发病、内分泌疾病。将入选者根据摄食行为分为暴食症组(A组)、正常饮食组(B组)和功能性消化不良组(C组)。其中,暴食症诊断标准[6]为:周期性暴食,但不存在神经性贪食患者的极端补偿行为如自引呕吐;功能性消化不良的诊断参考罗马III标准[7]。其中A组18例,男女各9例,平均年龄(24.6±6.1)岁,BMI(35.19±4.25)kg/m2;B组19例,男9例,女10例 平均年龄(25.9±5.8)岁,BMI(34.98±4.96)kg/m2;C组13例,男6例,女7例,平均年龄(25.8±7.0)岁,BMI(35.68±3.95)kg/m2;以同期石家庄市第一医院工作人员及家属中的正常体质量者20例作为健康对照组(D组),男女各10例,平均年龄(25.5±6.3)岁,BMI(23.46±1.57 )kg/m2。各组的性别、年龄差异无统计学意义(P>0.05)。所有入选者签署书面知情同意书。研究方案由石家庄市第一医院伦理委员会批准。
1.2 研究方法
1.2.1 胃排空测定: 采用单光子发射计算机断层成像术(SPECT)测定胃排空速率。受试前1 周内禁用胃肠动力药,检测前禁食8h,于检测当日晨8∶00在10min内摄入99Tcm-DTPA标记的试餐。试餐总热量为400kJ,进食后,立即应用SPECT准直器(美国GEStarcam4000iXR)以胃部为中心进行平面采集,每隔15min采集一帧,共采集2h。将胃部感兴趣区(ROI)选择在第一帧,计算出每帧计数,计算机程序绘制放射性活度—时间图,计算胃半排空时间及排空率。勾画出胃的轮廓对ROI采集资料,并按下述公式计算各时相的胃排空率:GEt(%)=[(Cmax-Ct/k)/Cmax]×100% (GEt:时间t时的胃排空率;Cmax:胃区内最大计数率;Ct:时间为t时胃区计数;k:衰减校正常数)。
1.2.2 自主神经功能测定:SPECT检查次日,通过心率变异性(HRV)分析观察全部受试者进餐前后自主神经功能的改变。检查前禁食8h。检查日晨7∶30采用十二导联动态心电记录仪(美国PreidealInstruments公司)记录餐前30min的心电波形,然后在10min内进食完毕标准餐(成分和热量同SPECT检查试餐,但无99Tcm-DTPA标注),进餐后静卧10min,记录餐后30min的心电波形。手工剔除分析异常的RR间期后,将心电信号输入计算机,采用HRV分析软件获得时域和频域参数。时域参数包括RR间期的标准差(SDNN)、相邻正常R-R间期差值的均方根(RMSSD)、24h内每5min正常R-R间期标准差的平均值(SDNNindex);频域参数包括超低频功率(VLF)、低频功率(LF)、高频功率(HF)。
1.3 统计学处理 采用SPSS13.0软件处理数据。计量资料以均数±标准差表示,餐前各组间比较采用完全随机设计资料的方差分析,两两比较用LSD检验;餐后与餐前的差值用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 胃排空速度比较SPECT检查后计算各组胃排空速率,A组的胃排空率明显高于D组(P<0.01);B组与D组胃排空率差异无统计学意义(P>0.05);C组胃排空率慢于D组(P<0.05),可见,与正常人相比,不同摄食行为的单纯性肥胖者的胃排空速度也有所不同。A组胃排空率快于B组,但差异无统计学意义(P>0.05);C组胃排空率慢于B组,差异有统计学意义(P<0.05,P<0.01)。见表1。
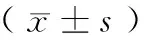
表1 各组的胃排空速度比较
注:与D组比较,aP<0.05,bP<0.01;与B组比较,cP<0.05,dP<0.01
2.2 进餐前后自主神经活动的改变
2.2.1HRV时域指标改变: 餐前与D组比较,A组RMSSD、SDNNindex、SDNN均增高(P<0.05,P<0.01);B组、C组无明显差异(P>0.05);与餐前比较,餐后D组表现为SDNN降低,SDNNindex、RMSSD增加,但在单纯性肥胖症患者中,A组和B组的变化趋势一致,表现为SDNNindex、SDNN降低,RMSSD增高,即餐后迷走神经活跃,尤其以A组明显;C组表现为餐后交感及迷走神经均活跃,RMSSD、SDNN降低,SDNNindex升高(P<0.01)。
各肥胖组间变化趋势也不完全一致,餐前A组、C组与B组比较各参数均无显著差异,餐后与餐前的差值,A组较B组SDNNindex降低显著(P<0.01),RMSSD增高显著(P<0.01);C组餐后SDNNindex为增高趋势,与B组相反(P<0.01),RMSSD为下降趋势,与B组相反(P<0.01)。见表2。
2.2.2HRV频域指标改变: 餐前与D组比较,A组VLF、LF、HF均增高(P<0.05),B组仅LF低于D组(P<0.05),其他参数与D组相比无明显差异。C组餐前的HRV频域参数较D组均无显著差异。与餐前比较,餐后D组表现为HF降低,VLF、LF增加;但在单纯性肥胖症患者中,A组和B组的变化趋势一致,与D组比较表现为VLF、LF降低(P<0.05),HF显著增高(P<0.01),即餐后迷走神经活跃,尤其以A组明显;C组表现为VLF、LF、HF显著增加(P<0.01)。
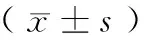
表2 各组餐前、餐后HRV时域指标比较
注:与D组比较,aP<0.05,bP<0.01;与B组比较,cP<0.05,dP<0.01
各肥胖组之间比较,A组与B组比较餐前VLF、LF显著增高(P<0.05,P<0.01);C组餐前各参数与B组均无显著差异。餐后与餐前变化差值A组与B组比较变化趋势相同,但变化幅度不同,VLF、LF降低(P<0.05,P<0.01),HF显著增高(P<0.01),C组与B组比较VLF、LF变化趋势相反(P<0.01),HF增加幅度较B组小(P<0.01)。见表3。
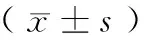
表3 各组餐前、餐后HRV频域指标参数比较
注:与D组比较,aP<0.05,bP<0.01;与B组比较,cP<0.05,dP<0.01
3 讨 论
单纯性肥胖的发生受多种因素影响,研究显示,胃排空是机体控制能量稳态的关键因素,因此,调控胃排空率或可成为预防肥胖的关键。放射性核素法测定的胃半排空时间被认为是胃排空定量分析中的金指标[8],本研究应用放射性核素法测定了单纯性肥胖者胃排空时间,并首次将摄食行为作为影响胃排空的重要因素纳入分析。由于近年社会竞争激烈,人群精神压力大,暴食症者逐渐增多,可导致急剧肥胖。我们的结果显示,肥胖伴暴食症患者胃半排空时间较正常体质量者明显缩短,1h及2h排空率明显加快。而肥胖伴饮食正常者的胃半排空时间、1h及2h排空率较正常体质量者均无明显差别。肥胖伴功能性消化不良者在肥胖者中也占有一定的比例,我们发现此类人群的胃半排空时间较正常体质量者延长,1h及2h排空率减慢,与既往报道功能性消化不良患者有明显胃动力障碍、主要表现为固体食物排空延迟结果一致[9]。同时,既往研究多认为肥胖者胃排空加速,引发饥饿感,导致进餐增多,引起肥胖,而本研究中肥胖伴功能性消化不良者的胃排空延迟,提示胃排空并非引起肥胖的惟一因素,胃肠激素、胃容量及胃容受性异常及遗传因素等均参与了肥胖的发生。
心率变异性作为分析自主神经系统活动的敏感性评价手段,能有效评估人类或其他动物的应激状态、情绪变化和病理进程[10,11]。胃的排空受交感神经与迷走神经的双重支配。交感神经兴奋时,乙酰胆碱酯酶活性低于正常,抑制胃运动;迷走神经兴奋时,乙酰胆碱酯酶活性高于正常,可促进胃运动。正常人进餐后交感神经兴奋,与本研究对照组的结果相符。
有文献报道,交感神经活动异常或迷走神经活动抑制可能是引起动物采食及体质量发生异常的主要原因之一[12]。肥胖可以直接影响儿童生理条件下的迷走神经张力及迷走神经与交感神经的平衡关系[13]。在本研究中,我们首次将胃排空与自主神经功能结合起来分析二者的变化规律。我们的结果显示,基础状态下,肥胖伴暴食症者餐前迷走神经及交感神经兴奋性均增高,以迷走神经兴奋为主,存在自主神经功能紊乱;而饮食正常及伴功能性消化不良的单纯性肥胖者的自主神经无明显异常。肥胖伴功能性消化不良者与伴暴食症者相比,迷走神经功能减退,但与正常体质量者相比,迷走神经功能并无减退。餐后3组均存在迷走神经活跃,迷走神经活性增加可导致胃排空加速,既往动物实验表明长期膈下迷走神经刺激可模拟由进食引起的饱足感信号并传送至下丘脑摄食调节中心,调节促进和抑制摄食神经肽的表达,使大鼠进食减少,从而导致体质量增加量减小[14]。这与既往研究结果一致,肥胖伴暴食症者迷走神经活跃更为明显,但伴功能性消化不良者餐后交感及迷走神经均活跃,胃排空却较正常体质量者延迟。既往研究发现正常体质量或消瘦体型的功能性消化不良患者可能存在迷走神经功能减退[15,16],与本研究结果不完全相符。我们推测可能系肥胖导致迷走神经活跃,也不排除样本量较小、结果或有偏倚。肥胖的发生机制众多,未来需要扩大样本量和进行多因素测定后综合分析,揭示肥胖者胃排空更多的影响因素,为肥胖的治疗提供更有效的指导。
1 周吕,柯美云.神经胃肠病学与动力[M].北京:科学出版社,2005:436-440.
2GuanX,ShiX,LiX,etal.GLP-2receptorinPOMCneuronssuppressesfeedingbehaviorandgastricmotility[J].AmJPhysiolEndocrinolMetab,2012,303(7):E853-E864.
3CleggM,ShafatA.Conferenceon"Multoidisciplinaryapproachestonutritiondproblems".PostgraduateSymposium.Theroleoffatingastricemptyingandsatiety:acuteandchroniceffects[J].ProcNutrSoc,2009,68(1):89-97.
4JacksonSJ,LeahyFE,McgowanAA,etal.Delayedgastricemptyingintheobese;anassessmentusingthenon-invasive(13)C-octanoicacidbreathtest[J].DiabetesObesMetab,2004,6(4):264-270.
5FrenchSJ,MurrayB,RumseyRD,etal.Preliminarystudiesonthegastrointestinalresponsestofattymealsinobesepeople[J].IntJObesRelatMetabDisord,1993,17(5):295-300.
6 张衍,席居哲.暴食症的诊断、治疗及其疗效[J].心理科学,2011,34(6):1508-1511.
7TackJ,TalleyNJ,CamilleiM,etal.Functionalgastroduodenaldisorders[J].Gastrointestinal,2006,130(5):1466-1479.
8 翟宏丽.胃动力检测方法的研究新进展[J].胃肠病学和肝病学杂志,2004,13(2):207-208.
9CuomoR,SarnelliG,GrassoR,etal.Functionaldyspepsiasymptoms,gastricemptyingandsatietyprovocativetest:analysisofrelationships[J].ScandJGastroenterol,2001,36(10):1030-1036.
10 潘永明,何欢,陈亮,等.心率变异性评估运输应激对Beagle犬自主神经功能的影响[J].中国实验动物学报,2011,19(1):69-73.
11DeJongIC,SgoifoA,LambooijE.Effectsofsocialstressonheartrateandheartratevariabilityingrowingpigs[J].CanJAnimSci,2000,80:273-280.
12 潘永明,陈亮,何欢,等.摄食行为对小型猪心脏自主神经功能的影响[J].中国比较医学杂志,2012,22(1):43-47.
13 王国祥,刘殿玉.肥胖儿童心脏自主神经变化特征及有氧运动的干预作用[J].中国妇幼保健,2011,26(21):3253-3255.
14 于亭亭,陈霞,李昌阳,等.长期迷走神经电刺激对肥胖鼠摄食和体重的影响[J].中国微创外科杂志,2012,12(1):79-82.
15LorenaSL,FigueiredoMJ,AlmeidaJR,etal.Autonomicfunctioninpatientswithfunctionaldyspepsiaassessedby24-hourheartratevariability[J].DigDisSci,2002,47(1):27-31.
16ParkDI,RheePL,KimYH,etal.Roleofautonomicdysfunctioninpatientswithfunctionaldyspepsia[J].DigLiverDis,2001,33(6):464-471.
Feeding behavior affect gastric emptying and autonomic nerve activity in the simple obesity
LIUHongfen*,LIULi,CHANGLili,FANYakun.
*DepartmentofGastroenterology,FirstHospitalofShijiazhuang,Shijiazhuang050011,ChinaCorrespondingauthor:LIULi,E-mail:loraliu@163.com
Objective To observe the effect of different feeding behavior of simple obesity rate of gastric emptying and autonomic nervous activity characteristics, to explore the relationship between dietary behavior and abnormal gastric emptying.Methods According to diet behavior, 50 cases of simple obesity patients were divided into bulimia group (group A,n=18),normaldietgroup(groupB,n=19),functionaldyspepsiagroup(groupC,n=13)andhealthcontrolgroup(groupD,n=20).Allsubjectseatingmealswhichcontain99TcmDTPAmarkers,andthenusingsinglephotonemissioncomputedtomography(SPECT)toscanstomach,calculatedgastricemptyinghalftimeandgastricemptyingrate.UsingtwelveleadECGrecorderrecordstheECGsignal30minbeforemeal, 30minaftermeal,heartratevariabilityanalysisoftimedomainparametersincludingthestandarddeviationofRRintervals(SDNN),rootmeansquareadjacentnormalR/Rintervaldifference(RMSSD), 24hoursevery5minutesR/Rintervalstandarderrorofthemean(SDNNindex);frequencydomainparametersincludingultra-lowfrequencypower(VLF),lowfrequencypower(LF),highfrequencypower(HF)wereperformed.Results Compared with group D, group A’s gastric half emptying time is obviously shortened, emptying rate increased significantly (P<0.01);nosignificantdifferencesofgroupB(P>0.05);groupC’shalfemptyingtimewassignificantlydelayed,emptyingratedecreased(P<0.05).Beforethemeal,groupA’sRMSSDSDNN,SDNNindex,VLF,HF,LFhigherthanthatofgroupD(P<0.05,P<0.01),vagus,sympatheticnervewereactive;groupB’sLFlowerthangroupD(P<0.05),sympatheticnerve’sactivitywaslow;comparedwithbeforethemeal,postprandialgroupD’sSDNN,HFreduces,SDNNindex,RMSSD,VLF,LFincreased,sympatheticnervewasactive;groupAandgroupB’sSDNNindex,SDNN,VLF,LFdecreased,RMSSDandHFincreased, (P<0.01),vagusnervewasactive,sympatheticnerve’sactivityreduced;groupC’sRMSSD,SDNNweredecreased,VLF,LF,HFwereincreased(P<0.01),sympathetic,vagusnervewereactive.Conclusion Simple obesity of different feeding person are autonomic neuropathy, vagus nerve are active after the meal, but the gastric emptying was different, gastric emptying is one of the leading causes of obesity, but it is not the only factor, autonomic activities can affect gastric emptying.
Simple obesity; Different feeding behavior; Gastric emptying; Autonomic nerve
河北省卫生厅重点科技研究计划资助项目(No.20090596)
050011 石家庄市第一医院消化内科(刘红芬、常丽丽),干部科(范亚坤); 050051 石家庄,河北医科 大学第二医院消化内科(刘丽)
刘丽,E-mail:loraliu@163.com
2014-10-26)
