体外诊断试剂519例可疑不良事件报告分析
2015-03-06王新敏卞蓉蓉张苏琳江苏省药品不良反应监测中心南京000江苏省食品药品监督管理局认证审评中心南京000
李 尧,王新敏,卞蓉蓉,孙 骏,张苏琳江苏省药品不良反应监测中心,南京 000;江苏省食品药品监督管理局认证审评中心,南京 000
体外诊断试剂519例可疑不良事件报告分析
李 尧1,王新敏1,卞蓉蓉1,孙 骏1,张苏琳2
1江苏省药品不良反应监测中心,南京 210002;2江苏省食品药品监督管理局认证审评中心,南京 210002
采用回顾性分析的方法,对近3年江苏省药品不良反应监测中心收集的519例体外诊断试剂的可疑不良事件报告进行统计分析。发现体外诊断试剂的可疑不良事件报告存在使用单位上报意识薄弱、Ⅱ类产品报告数量较多、风险信号较为隐蔽等问题。监管部门和有关单位应加强风险责任意识,建立健全监测相关的工作制度,保障公众使用体外诊断试剂的安全。
体外诊断试剂;医疗器械不良事件监测;风险因素;分析
体外诊断试剂,是指医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。根据产品风险程度由低到高,体外诊断试剂分为第Ⅰ类、第Ⅱ类、第Ⅲ类产品[1]。目前我国按医疗器械受理审评的体外诊断试剂共有766种,其中第Ⅰ类84种,第Ⅱ类433种,第Ⅲ类249种。
江苏省药品不良反应监测中心近3年收集到的体外诊断试剂的可疑不良事件报告,通过对报告数据的临床表现形式等的分析,归纳出我省体外诊断试剂的不良事件监测工作存在的问题,以期向监管部门、使用单位和经营企业提出合理化建议。
1 资料来源
2011年11月31日~2014年11月31日江苏省药品不良反应监测中心收集到的519例体外诊断试剂的可疑不良事件报告。
2 方法与结果
采用描述性分析方法,参考国家食品药品监督管理局制定的《体外诊断试剂分类子目录》,依托江苏省药品不良反应监测中心病例数据库,检索出体外诊断试剂的可疑不良事件报告,包括试剂盒、校准品、试剂、微生物培养基、染色液等[2];对报告来源(见表1)、管理类别(见表2)、使用场所(见表3)、操作人员类别(见表4)、排名前10的体外致不良事件的诊断试剂名称(见表5)、体外诊断试剂主要质量问题(见表6)及造成主要伤害(见表7)等进行统计和分析。

表1 不同类别单位提供报告情况

表2 体外诊断试剂风险管理类别

表3 体外诊断试剂可疑不良反应发生场所
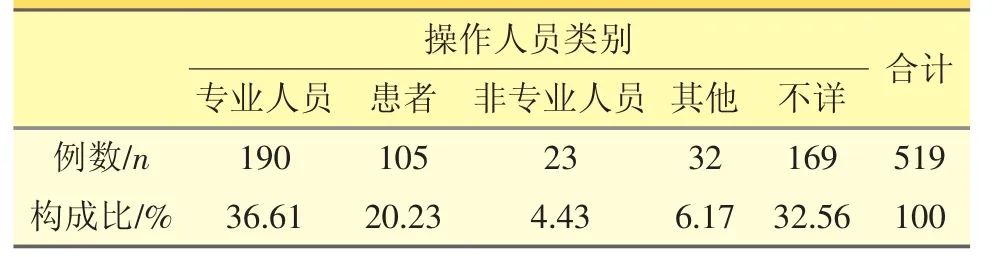
表4 体外诊断试剂发生可疑不良反应操作人员类别情况
3 讨 论
通过统计分析,我省体外诊断试剂的可疑不良事件报告存在以下问题:
3.1 使用单位上报意识薄弱

表5 可疑不良事件排名前10的体外诊断试剂名称
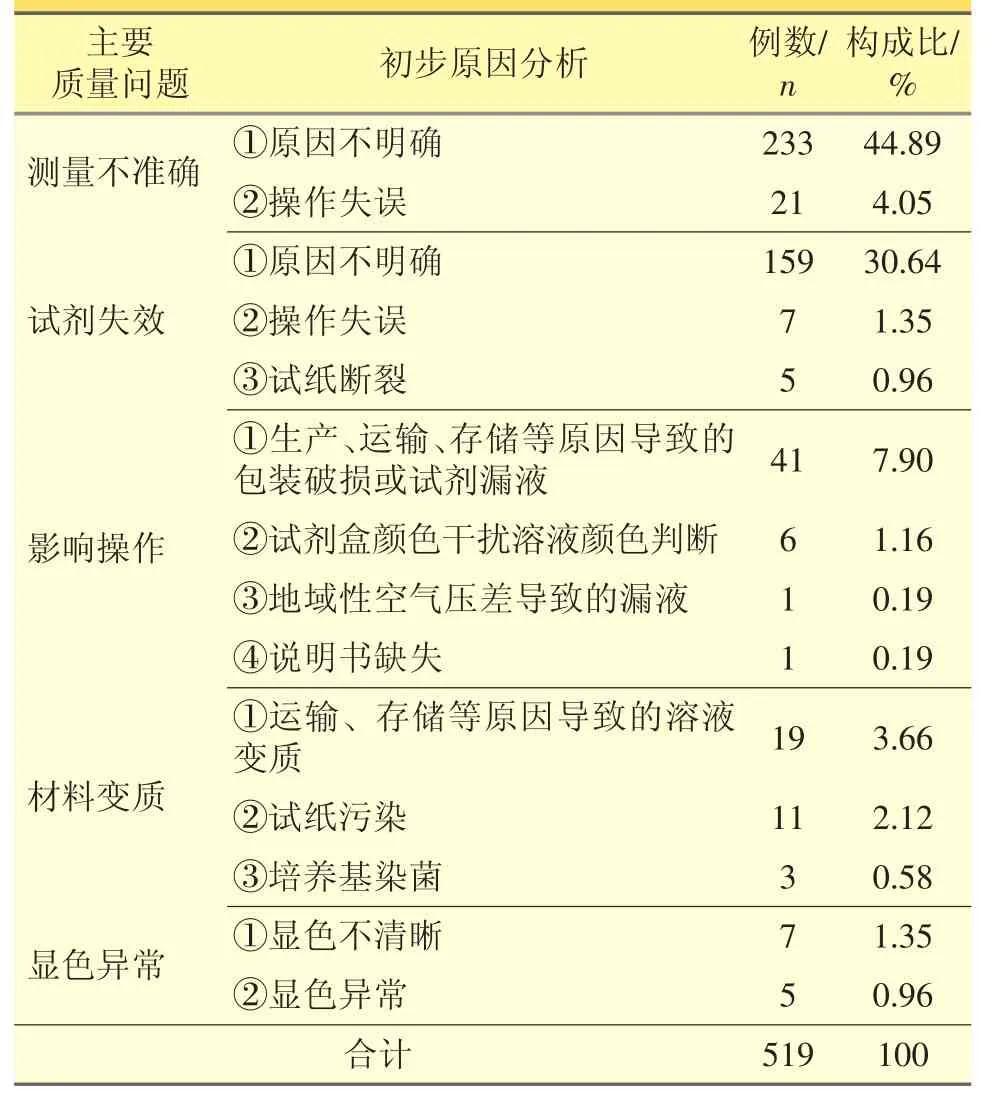
表6 体外诊断试剂主要质量问题和初步原因分析

表7 可疑不良事件排名前3的体外诊断试剂所致主要伤害及初步原因分析
根据上述统计,使用场所为医疗机构的报告占35.84%,但通过医疗机构上报的数量仅占14.84%;上报单位集中在经营企业,报告数量占67.44%;有392份报告未对可疑不良事件进行初步原因分析,其中包括来自医疗机构、操作人员的报告。例如,1份由经营企业上报的病例报告所示,抢救农药中毒患者时急需检测血清胆碱酯酶含量,由于发生诊断试剂无效的情况,延误了危重病情的治疗。该起不良事件发生后未见医技人员主动上报,也未对不良事件原因进行分析,仅告诉经销商要求退换产品。
由此可见,使用单位医技人员主动监测与上报体外诊断试剂不良事件的责任意识不强,导致此类许多可疑不良事件漏报或者简化上报。体外诊断试剂风险来源复杂,如样本收集储备是否符合条件、校准品是否超出偏差规范、检测过程中是否混入干扰物质、检测人群是否具有资质等。经营单位从业人员可能无法科学合理地判断不良事件的发生原因,而使用单位医技人员为诊断试剂的操作者,理应具备丰富的临床经验和合格的操作技能,假如他们能提高上报的主动性,将有助于客观、准确地分析体外诊断试剂可疑不良事件的发生原因。
3.2 Ⅱ类产品报告数量较多
上述病例报告中,Ⅱ类产品报告占86.51%,体外诊断试剂的使用场所为家庭,占31.41%,操作人员为患者和非专业人员,占24.66%。发生不良事件产品的名称排名前3位的使用场所通常为“家庭”。其中,有关孕检的人绒毛膜促性腺素检测试纸、促黄体生成素检测试纸的相关病例报告占总报告数的43.35%,表明对孕妇存在较大风险;血糖试纸测量不准确的病例报告占15.03%,结果大多导致糖尿病患者自我用药过度,发生恶心、呕吐、低血糖休克等不良事件。报告人填报的不良事件初步原因有试纸断裂、试纸污染、使用者操作不当等,但原因分析不详的报告超过50%。
体外诊断试剂的可疑不良事件中Ⅱ类产品报告数量较多,但与其它医疗器械相比,体外诊断试剂的操作者使用前未经专业培训的可能性大得多,测量结果更易受到操作方法和主观判断等因素的影响,也无法对可疑不良事件发生的原因做出准确分析。因此,使用群体中非专业人士居多,成为体外诊断试剂的使用风险因素之一。
3.3 风险信号较为隐蔽
分析上述可疑不良事件的初步原因主要为测量结果不准确或失效,分别占比48.94%和32.95%;同时可疑不良事件报告表中体外诊断试剂的批号、有效期的填写不规范,无法对怀疑试剂开展深入的调查。例如,某医院为心绞痛患者使用心肌肌钙蛋白检测试剂盒,测试结果和临床表现明显不符,造成二次采血,延误了疾病治疗,加重了患者的痛苦。
体外诊断试剂一般不直接对人体造成伤害,但其造成的间接伤害不容忽视。比如:造成服用降血压、降血糖类药物剂量上的错误;因艾滋病、恶性肿瘤、意外妊娠等误诊而造成患者的精神伤害,或者二次取血的额外痛苦等;也可能影响医师对患者病情程度的把握、病灶位置的确定、治疗方案的筛选以及治疗预后的评判等,影响患者生命安全。由于这些伤害事件的间接性、延时性和事件原因的不确定性,多数体外诊断试剂的可疑不良事件可能未被上报,难以形成聚集性风险信号。
4 建 议
4.1 对监管部门
医疗器械监管部门其工作应着眼多个环节,不仅应该联合同级卫生主管部门开展对使用单位采购、储存和使用体外诊断试剂的规范性检查,督促其搜集、核实和上报相关不良事件;还应该统一并提高产品注册标准、严格控制产品质量安全、规范体外诊断试剂的包装标识。各级监测技术机构应及时统计分析辖区内体外诊断试剂不良事件监测数据,应用信息化技术手段发现和处理风险信号,开展不良事件现场调查和原因分析,为有关方面提供技术支持,保障人民群众的使用安全。
4.2 对使用单位
使用单位应制定相关工作制度和程序,保证体外诊断试剂的购进审核、贮存条件、定期质控和使用记录的可追溯性;加强医学检验部门和临床科室的沟通,及时排查诊断试剂质量问题、操作失误等因素导致诊断数据异常的情况;积极开展培训,确保医技人员能正确区分体外诊断试剂的类别和掌握其基本特性[3];提高可疑不良事件报告的数量和质量,上报时尽量将产品名称、产品批号、有效期等项目填写完整。
4.3 对生产和经营企业
生产和经营企业应依据有关法规和注册标准,提高产品质量,完备产品包装、标签和说明书,保证产品在运输、储存等环节的稳定性,杜绝进口产品分装后新标注的保质期限超过原装期限。企业还应该主动搜集上报体外诊断试剂不良事件,并结合产品特性,开展针对性强的宣传活动和提高售后服务质量的举措。
5 结 语
体外诊断试剂具有多样性、复杂性、专业跨度大、发展更新快等特点,而且其技术原理、生产运输、保存使用等条件都有较大差异,使得体外诊断试剂的可疑不良事件所涉及的因素众多,关联性评价相对复杂。目前体外诊断试剂市场日益发展壮大,进一步加强该类产品的可疑不良事件监测已经成为迫在眉睫的工作,但在重视程度、管理方式、理论技术等方面还存在诸多欠缺,各级食品药品监督部门、卫生行政管理部门、技术监测机构、基层报告单位需要通力合作,才能保障公众使用体外诊断试剂的安全、高效。
[1] CFDA.《体外诊断试剂注册管理办法》(EB/OL).(2014-7-30)[2015-8-10].http://www.sfda.gov.cn/WS01/CL0053/ 103757.html.
[2] CFDA.《体外诊断试剂分类子目录》(EB/OL).(2013-11-26)[2015-8-10].http://www.sda.gov.cn/WS01/CL0845/ 94641.html.
[3] 章宏法,张敏红.医疗机构体外诊断试剂使用管理现状调查及思考[J].中国医疗设备,2010,25(11):10-3.
Analysis of 519 Reports of Suspicious Adverse Events Associated with In Vitro Diagnostics(IVD)Medical Devices
LI Yao1,WANG Xin-min1,BIAN Rong-rong1,SUN Jun1,ZHANG Su-lin2
1Center for ADR Monitoring of Jiangsu,Nanjing 210002,China;2Center for Certification&Evaluation, Jiangsu Food and Drug Administration,Nanjing 210002,China
A retrospective case study was conducted,to analyze 519 reports of suspicious adverse events in last three years onin vitrodiagnostics (IVD)medical devices.Reporting of IVD suspicious adverse events is mostly neglected by users.Reports on classⅡ IVD are more than the others.The risk signals of using IVD are subtle.IVD monitoring is suggested to be strengthened consciously and institutionally to promote public safety.
In Vitrodiagnostics;Medical device adverse events monitoring;Risk factor;Analysis
R981
A
1673-7806(2015)06-593-03
李尧,男,硕士 E-mail:474006289@qq.com
2015-08-14
2015-10-05
