乳腺癌细胞源Exosomes在促肿瘤血管生成中的作用及机制
2015-03-05谢莹珊王亚平
隆 霜,谢莹珊,陈 黎,姜 蓉,王亚平,沈 宜
(重庆医科大学基础医学院病理生理教研室干细胞与组织工程研究室,重庆 400016)
促血管生成是肿瘤的基本特征之一,新生血管不仅促进肿瘤细胞的增殖,也为肿瘤的远处转移提供途径。内皮细胞是肿瘤微环境的重要组成部分,是肿瘤血管生成的效应细胞,其与肿瘤细胞的相互作用机制尚不完全清楚。Exosomes是一种由活细胞分泌的膜性小囊泡,直径40~100 nm,通过携带蛋白质、核酸等生物大分子在不同细胞间传递信息,调控受体细胞的多种功能[1]。肿瘤来源的Exosomes不仅抑制免疫,协助肿瘤逃避免疫监视,并且具有促进肿瘤增殖的作用[2-4]。肿瘤细胞通过以分泌Exosomes的方式调控微环境,能否影响血管内皮细胞的生物学特性,并参与肿瘤病理性血管生成过程?本文通过提取乳腺癌细胞源Exosomes与脐静脉内皮细胞HUVECs进行体外共培养,观察Exosomes对HUVECs的生物学效应,并研究Exosomes发挥作用的具体机制。
1 材料与方法
1.1 材料
乳腺癌MDA-MB-231细胞、人脐静脉内皮细胞株(HUVECs)(中国科学院上海细胞库);DMEM、RPMI-1640培养基及新生牛血清(Gibco公司);Western blot试剂盒(碧云天生物技术公司);兔抗人EGFR、ERK、p-ERK、VEGF、VEGFR2 和 p-VEGFR2抗体(Santa Crus公司);兔抗人 Akt、p-Akt抗体(Cell Signaling公司);免疫组化试剂盒(武汉博士德生物工程有限公司);反转录PCR试剂盒(Takara公司);EGFR、VEGF、GAPDH 及 β-actin引物(成都天泰公司);Transwell小室(Millpore公司);VEGF ELISA定量检测试剂盒(R&D公司);Matrigel胶(BD公司)。
1.2 方法
1.2.1 细胞培养及Exosomes提取:MDA-MB-231细胞(10%新生牛血清RPMI-1640)与HUVECs细胞(10%新生牛血清DMEM)置入37℃、5%CO2培育箱孵育,收集MDA-MB-231细胞培养上清液。通过超速离心及密度梯度离心,参照文献[5]步骤提取纯化MDA-MD-231源Exosomes。
1.2.2 MTT法检测细胞增殖:5×104个/mL HUVECs接种96孔板,设实验组、对照组及空白组。孵育12 h后重新加入含 50、100、200 和 400 μg/mL Exosomes的培养液 200 μL,培养24、48 和72 h 后,每孔分别加入5 g/L MTT溶液20 μL培养4 h,弃上清并加入200 μL DMSO,酶标仪测定570 nm A值计算增殖率。计算公式:增殖率(%)=(实验组平均A值-空白组平均A值)/(对照组平均A值-空白组平均A值)×100%。
1.2.3 流式细胞仪分析细胞周期:以含1% 新生牛血清DMEM培养HUVECs进行同步化。实验组加入含200 μg/mL Exosomes的新鲜培养液,设对照组,24 h后收集细胞并固定24 h,加入RnaseA及碘化丙啶染液后,应用流式细胞仪分析细胞周期。
1.2.4 Transwell小室法检测迁移能力:以5×104个/孔的HUVECs加入Transwell小室的上室,实验组加入 200 μg/mL Exosomes,培养 24 h 后,洗涤,固定,苏木精染色封片,显微镜下随机选取5个视野计算迁移细胞数。
1.2.5 体外成管实验:将含Matrigel胶的24孔板进行冻融,以1∶1的比例将Matrigel胶与DMEM加入24孔板,孵育1 h成胶。按5×105个/孔的HUVECs接种至24孔板,加入200 μg/mL Exosomes继续培养24 h,显微镜观察,随机选取3处管腔密集处计数[6]。
1.2.6 Western blot检测相关蛋白表达:收集MDAMB-231及Exosomes提取总蛋白。以200 μg/mL Exosomes处理HUVECs为实验组,设对照组,培养24、48和72 h后提取总蛋白。按常规实验步骤进行电泳、转膜、封闭、孵育抗体及显色。
1.2.7 RT-PCR检测相关基因表达:收集MDA-MB-231和HUVECs细胞提取总RNA。HUVECs加入含200 μg/mL Exosomes的培养液为实验组,设对照组,孵育24 h后提取总RNA。按说明书操作步骤进行反转录,应用特定引物进行扩增反应(表1)。RT-PCR和Western blot检测mRNA和蛋白,以目的基因(蛋白)与内参照吸光度比值的均数±标准差(±s)表示(n=3)。

表1 各引物序列及扩增产物长度Table 1 Primer sequences and fragment
1.2.8 ELISA检测 VEGF含量:以5×104个/孔HUVECs细胞接种至24孔板,孵育24 h后换液,实验组加入含200 μg/mL Exosomes无血清DMEM,对照组加入无血清DMEM,孵育24 h后收集培养液,离心取上清。按说明书步骤进行实验。于酶标仪测定450 nm处A值。
1.3 统计学分析
实验结果采用SPSS 17.0软件做数据处理,数据以均数±标准差(±s)表示,两两比较采用t检验进行统计学分析。
2 结果
2.1 乳腺癌MDA-MB-231细胞源Exosomes对HUVECs增殖的影响
Exosomes呈时间-剂量依赖性促HUVECs增殖(P<0.05)(图1)。
2.2 乳腺癌MDA-MB-231细胞源Exosomes对HUVECs细胞周期的影响
200 μg/mL Exosomes作用 HUVECs细胞 24 h,G1期细胞比例下降,S期细胞比例增加,G1/S期细胞比例下降(P<0.05)(表2)。

图1 Exosomes促进HUVECs细胞的增殖Fig 1 Exosomes significantly increased HUVECs proliferation
表2 各组HUVECs细胞周期分布Table 2 Cells cycle distribution in HUVECs of each group(±s,%,n=3)

表2 各组HUVECs细胞周期分布Table 2 Cells cycle distribution in HUVECs of each group(±s,%,n=3)
*P < 0.05 compared with control.
group G1/% S/% G2/% G1/S/%control 71.39±3.97 15.34±0.71 13.27±3.27 4.67±0.47 exosomes 60.90±3.28*27.80±3.37*11.30±0.60 2.22±0.37*
2.3 乳腺癌MDA-MB-231细胞源Exosomes对HUVECs细胞迁移、体外成管能力的影响
200 μg/mL Exosomes作用 HUVECs细胞 24 h后,迁移细胞数为51.40±8.93显著高于对照组的28.4±5.07(P<0.05)(图2),管腔形成数为9.40±1.07显著高于对照组的4.60±0.93(P<0.05)。
2.4 乳腺癌MDA-MB-231细胞源Exosomes对HUVECs细胞EGFR表达的影响
乳腺癌MDA-MB-231细胞及其Exosomes均存在EGFR蛋白表达(图3),Exosomes作用HUVECs细胞24 h后,EGFR蛋白表达为0.30±0.03,显著高于对照组的0.11±0.02(P<0.01)(图4),而EGFR mRNA表达为0.11±0.01,显著低于对照组的0.60±0.02(P<0.01)(图5)。
2.5 乳腺癌MDA-MB-231细胞源Exosomes对ERK和Akt活性的影响
Exosomes作用于HUVECs细胞的时间逐渐延长,ERK和Akt蛋白磷酸化水平逐渐上升(图6,表3)。
2.6 乳腺癌MDA-MB-231细胞源Exosomes对HUVECs细胞VEGF/VEGFR2的影响
Exosomes作用HUVECs细胞24 h后,上清液中VEGF含量为(110.85±18.40)pg/mL,显著高于对照组的(60.86±7.71)pg/mL(P<0.05)。同时 VEGF蛋白表达为0.88±0.05高于对照组的0.31±0.04(P<0.05),VEGF mRNA表达为0.58±0.03高于对照组0.28±0.02(P<0.05)。同时VEGFR2蛋白的磷酸化水平上升(图7~9)(表4)。
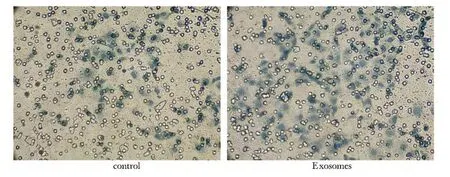
图2 Exosomes对HUVECs细胞迁移能力的影响Fig 2 Effect of Exosomes on migration in HUVECs(×200)

图3 MDA-MB-231及其来源Exosomes EGFR蛋白表达Fig 3 Expression of EGFR in MDA-MB-231&Exosomes

图4 HUVECs细胞EGFR蛋白表达Fig 4 Expression of EGFR in HUVECs
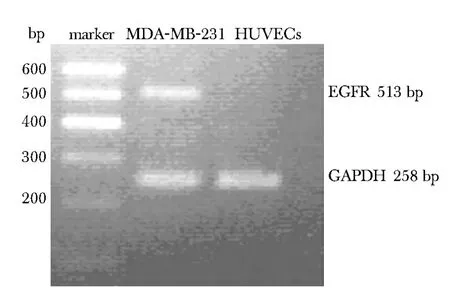
图5 HUVECs细胞EGFR mRNA表达Fig 5 Expression of EGFR mRNA in HUVECs
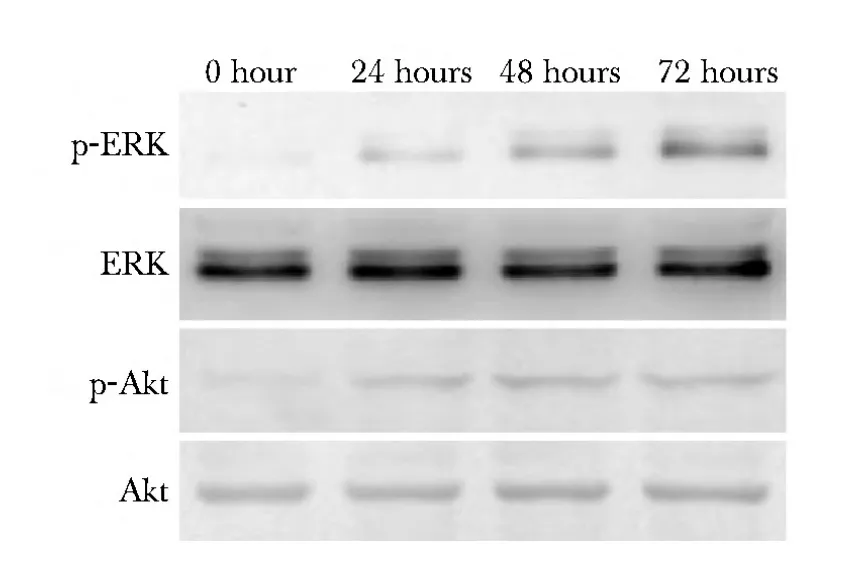
图6 Exosomes对HUVECs细胞ERK和Akt活性的影响Fig 6 Effects of exosomes on activity of ERK and Akt in HUVECs
表3 各组HUVECs细胞ERK1/2与Akt蛋白活性水平比较Table 3 The comparison of ERK1/2&Akt protein activity in each group(±s,n=3)
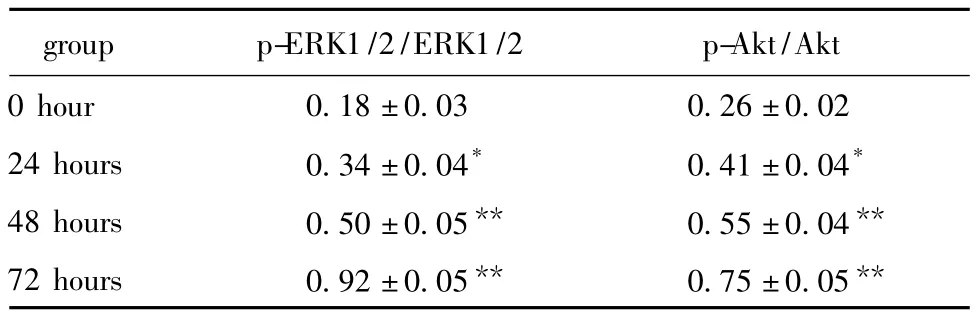
表3 各组HUVECs细胞ERK1/2与Akt蛋白活性水平比较Table 3 The comparison of ERK1/2&Akt protein activity in each group(±s,n=3)
*P <0.05,**P <0.01 compared with 0 hour.
group p-ERK1/2/ERK1/2 p-Akt/Akt 0 hour 0.18±0.03 0.26±0.02 24 hours 0.34±0.04* 0.41±0.04*48 hours 0.50±0.05** 0.55±0.04**72 hours 0.92±0.05** 0.75±0.05**
3 讨论
促血管生成是肿瘤发展、远处转移的重要条件,也是影响肿瘤患者预后的因素之一。内皮细胞是血管新生的基础,研究证实,在实体肿瘤中,肿瘤细胞通过释放生长因子作用于血管内皮细胞表面相应的受体,并促进其增殖、迁移及管腔的形成,是调控促肿瘤血管生成的重要机制[7-8]。Exosomes的研究已有30年,直到2007年才发现其在细胞间的物质转运中扮演重要角色。截至2014年9月,通过Exosomses数据库(www.exocarta.org)可知,146 项研究共确定有13 333种蛋白、2 375种 mRNA、764种miRNA存在于不同细胞来源的Exosomes。本研究以乳腺癌MDA-MB-231细胞及HUVECs细胞为研究对象,观察肿瘤细胞是否以Exosomes介导的方式参与肿瘤血管生成的调控。

图7 Exosomes对HUVECs细胞VEGF蛋白表达的影响Fig 7 Effects of Exosomes on expression of VEGF in HUVECs
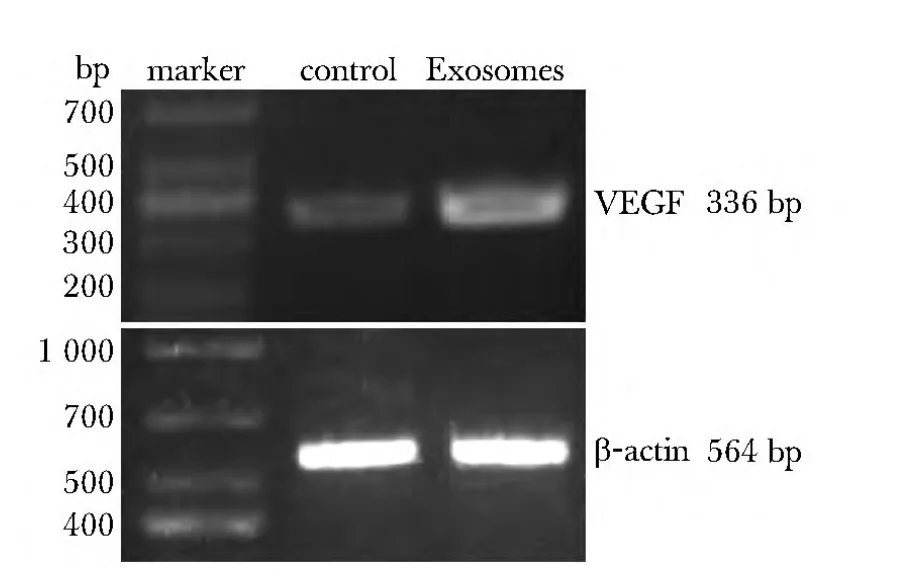
图8 Exosomes对HUVECs细胞VEGF mRNA表达的影响Fig 8 Effects of Exosomes on expression of VEGF mRNA in HUVECs

图9 Exosomes对HUVECs细胞VEGFR2活性的影响Fig 9 Effects of Exosomes on activity of VEGFR2 in HUVECs
表4 各组HUVECs细胞VEGFR2与p-VEGFR2蛋白表达水平比较Table 4 The comparison of VEGFR2&p-VEGFR2 expression in each group(±s,n=3)

表4 各组HUVECs细胞VEGFR2与p-VEGFR2蛋白表达水平比较Table 4 The comparison of VEGFR2&p-VEGFR2 expression in each group(±s,n=3)
*P < 0.01 compared with control.
group VEGFR2/β-actin p-VEGFR2/VEGFR2 control 0.64±0.02 0.11±0.01 Exosomes 0.66±0.02 0.79±0.04*
本研究显示,乳腺癌MDA-MB-231细胞源Exosomes能以时间-剂量依赖性的方式促进HUVECs细胞的增殖,HUVECs细胞S期细胞比例增加,G1/S期细胞比例下降,与此同时,还进一步观察到HUVECs细胞的迁移、体外成管能力在Exosomes作用下明显提高。以上研究初步显示乳腺癌MDAMB-231细胞通过分泌Exosomes并作用于HUVECs细胞,对血管新生过程具有一定的生物学意义,表明乳腺癌细胞可能通过分泌Exosomes优化肿瘤微环境,调控血管病理性新生,从而促进肿瘤自身增殖。
分子异质性是实体肿瘤中的内皮细胞区别于正常内皮细胞的一大特点,是受肿瘤微环境中多种因素的影响而产生的。研究发现,实体肿瘤中的内皮细胞选择性地过表达EGFR,而正常内皮细胞不表达,其具体机制尚不清楚[9]。Exosomes介导细胞间的物质转运作用,其是否与内皮细胞异常表达EGFR具有相关性。本研究证明高表达EGFR的乳腺癌MDA-MB-231细胞分泌的Exosomes携带EGFR蛋白,通过作用HUVECs细胞后,促进后者EGFR蛋白表达增加,而RT-PCR实验显示HUVECs细胞EGFR mRNA不表达,以上实验数据间接证明Exosomes携带EGFR,与HUVECs细胞相互作用后将其转移至HUVECs细胞,而 HUVECs细胞并无内源基因的表达。
EGFR与肿瘤的发生发展具有重要影响,通过激活多条与增殖、凋亡相关信号通路发挥作用[10-11]。有学者利用中和性抗体抑制细胞EGFR表达后,发现 VEGF mRNA及蛋白表达均下调[12],还有研究证明肿瘤细胞中的EGFR通过激活MAPK与Akt信号能促进VEGF的分泌[13]。本研究进一步检测EGFR相关的信号分子,以确定转移的EGFR蛋白是否具有功能。实验表明,HUVECs在Exosomes作用后,ERK与Akt蛋白的磷酸化水平增高,呈时间依赖性,同时VEGF分泌增加,并进一步活化了VEGFR2受体。以上结果证明MDA-MB-231通过释放携带EGFR蛋白的Exosomes,作用于肿瘤微环境中的血管内皮细胞,介导了EGFR的转移,并激活了相关信号传导通路,在促血管生成过程中具有一定的作用[14]。
综上所述,乳腺癌细胞源Exosomes在肿瘤微环境中具有一定的促血管生成作用,通过介导EGFR向内皮细胞的转移,并激活下游相关重要信号分子,提示了肿瘤细胞源Exosomes在促血管生成方面具有重要调控作用,随着研究和认识的深入,肿瘤细胞通过分泌携带特定分子的Exosomes,并远距离调控受体细胞的方式会被进一步发现,也为后续开发以Exosomes为治疗载体的新型治疗方式奠定基础。
[1]Record M,Carayon K,Poirot M,et al.Exosomes as new vesicular lipid transporters involved in cell-cell communication and various pathophysiologies[J].Biochim Biophys Acta,2014,1841:108-120.
[2] Mincheva-Nilsson L,Baranov V.Cancer exosomes and NKG2D receptor-ligand interactions.Impairing NKG2D-mediated cytotoxicity and anti-tumour immune surveillance[J].Semin Cancer Biol,2014,28:24-30.
[3]Qu JL,Qu XJ,Zhao MF,et al.Gastric cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation[J].Dig Liver Dis,2009,41:875-880.
[4]Skog J,Wurdinger T,van Rijn S,et al.Glioblastoma microvesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J].Nat Cell Biol,2008,10:1470-1476.
[5]李静,沈宜,汤为学,等.小鼠肝癌细胞H22源exosomes的制备及其免疫相关蛋白的初步研究[J].中华肝脏病杂志,2007,15:437-440.
[6]马颖,杨向红.肺癌细胞培养上清液对内皮祖细胞功能和活性影响的观察[J].中华肿瘤防治杂志,2009:336-339.
[7]Kerbel RS.Tumor angiogenesis[J].N Engl J Med,2008,358:2039-2049.
[8]Goel HL,Mercurio AM.VEGF targets the tumour cell[J].Nat Rev Cancer,2013,13:871-882.
[9]Amin DN,Hida K,Bielenberg DR,et al.Tumor endothelial cells express epidermal growth factor receptor(EGFR)but not ErbB3 and are responsive to EGF and to EGFR kinase inhibitors[J].Cancer Res,2006,66:2173-2180.
[10]Dent P.Crosstalk between ERK,AKT,and cell survival[J].Cancer Biol& Ther,2014,15:245-246.
[11] Klein S,Levitzki A.Targeting the EGFR and the PKB pathway in cancer[J].Curr Opin Cell Biol,2009,21:185-193.
[12]Petit AM,Rak J,Hung MC,et al.Neutralizing antibodies against epidermal growth factor and ErbB-2/neu receptor tyrosine kinases down-regulate vascular endothelial growth factor production by tumor cells in vitro and in vivo:angiogenic implications for signal transduction therapy of solid tumors[J].Am J Pathol,1997,151:1523-1530.
[13]Feldkamp MM,Lau N,Rak J,et al.Normoxic and hypoxic regulation of vascular endothelial growth factor(VEGF)by astrocytoma cells is mediated by Ras[J].Int J Cancer,1999,81:118-124.
[14]Lee S,Chen TT,Barber CL,et al.Autocrine VEGF signaling is required for vascular homeostasis[J].Cell,2007,130:691-703.
