CD44促进HUVECs增殖和黏附
2015-03-05石歆
石 歆
(河南中医学院第一附属医院内科,河南郑州 450000)
脑血管内皮细胞损伤是高血压、脑卒中及脑梗阻等多种脑血管疾病的病理基础之一,血管内皮细胞的增殖和黏附是血管内皮修复的一个重要步骤。因此,揭示内皮细胞增殖和黏附机制是修复血管的关键。CD44(cluster of differentiation 44)是一类相对分子质量在80~200 ku之间的单链跨膜糖蛋白,是广泛表达于细胞表面的透明质酸受体[1]。CD44最早是作为一种细胞黏附因子被发现的,后来发现CD44还能够促进内皮细胞的增殖[2],在维护血管完整性中扮演重要作用[3]。但CD44在内皮细胞增殖和黏附中的作用机制研究较少。本文研究CD44在血管内皮细胞增殖和黏附中的作用及其机制。
1 材料与方法
1.1 材料
DMEM培养基(Gibco公司);pcDNA3.1、Trizol试剂和LipofectamineTM2000转染试剂(Invitrogen公司);oligo-dT引物和PrimeScript® RT试剂盒(Takara公司);FuGENE HD转染试剂盒(Roche,美国);MTT、RIPA裂解液和ECL标记的二抗(碧云天,江苏);CD44抗体(Abcam公司);Akt抗体、p-Akt抗体、PECAM1抗体、Ki67抗体、β-actin抗体、Akt siRNA、PECAM1 siRNA和对照siRNA(Santa Cruz公司)。
1.2 方法
1.2.1 人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)的培养:HUVECs置于含5% 胎牛血清的DMEM培养基中,于37℃,8%CO2培养箱中培养。3 d胰蛋白酶消化传代1次。
1.2.2 过表达载体的构建及细胞转染:将HUVECs分为3组:1)对照组不做任何处理,2)空载体组HUVECs进行空载体转染,3)CD44转染组HUVECs进行CD44过表达载体转染。采用Trizol试剂提取细胞总 RNA。使用 oligo-dT引物和 PrimeScript®RT试剂盒将总RNA反转录成cDNA。参照文献[4]引物克隆CD44 cDNA,将CD44 cDNA插入载体pcDNA3.1中,获取 pcDNA3.1-CD44重组表达载体,以空载体为阴性对照。待细胞增殖至汇合度为60%时,使用FuGENE HD转染试剂盒进行转染,具体过程参照试剂说明书进行。
1.2.3 细胞增殖测定:收集细胞,胰蛋白酶消化并计数。以每孔约2×103个接种于96孔板。加入MTT溶液孵育4 h,最后加入DEMO继续孵育至结晶全部溶解,测定560 nm吸光度(A)值。
1.2.4 细胞黏附测定:以每孔1×105个接种于96孔培养板,于37℃,5%CO2条件下培养。分别在接种3、6 h后冲洗除去未真正黏附于培养板孔底的细胞,胰蛋白酶消化后置于倒置显微镜下计数。细胞黏附率=黏附细胞数/总细胞数×100%。
1.2.5 siRNA干扰:提前24 h将5×104个细胞接种在24孔板上。待细胞增殖至30% ~50%时,使用LipofectamineTM2000转染试剂进行转染,操作过程参照试剂说明书。
1.2.6 RT-PCR:总RNA提取及cDNA的反转录如前所述。CD44引物参照参考文献[4],PECAM1引物参照文献[5],β-actin引物为5'-CAACTTGATGT ATGAAGGCTTTGGT-3'(上游),5'-ACTTTTATTGG TCTCAAGTCAGTGTACAG-3'(下游)。采用RT-PCR试剂盒SYBR® Premix Ex TaqTMⅡ,反应总体系为25 μL,含 20 ng cDNA、引物 0.4 μmol/L。在 Bio-Rad iQ5实时定量 PCR仪中进行,循环参数为:95℃ 15 min预变性;95℃ 15 s,58℃ 60 s,72℃60 s进行40个循环。相对表达量计算参照文献[6],所有实验均重复3次。
1.2.7 Western blot:采用RIPA裂解液提取细胞总蛋白。采用聚丙烯凝胶电泳进行蛋白分离,以湿转法进行转PVDF膜,转膜后置于含5%牛血清蛋白室温封闭4 h。加入一抗孵育1 h,TBST清洗之后加入ECL标记的二抗孵育30 min,TBST洗膜,ECL试剂盒进行显色反应[7]。
1.3 统计学分析
采用SPSS19.0软件进行分析,多组比较采用单因素方差分析,两两比较采用t检验。
2 结果
2.1 CD44过表达效果
空载体组中CD44的蛋白及mRNA水平较对照组无显著差异,而CD44转染组CD44的蛋白及mRNA水平显著高于对照组(P<0.05)(图1)。
2.2 CD44对HUVECs细胞增殖的影响
空载体组中Ki67的蛋白水平较对照组无显著差异,而CD44转染组中Ki67的蛋白水平显著高于对照组(P<0.05);空载体组HUVECs的增殖较对照无显著差异,CD44转染组的细胞增殖较对照显著上升(P<0.05)(图2)。
2.3 CD44对Akt磷酸化的影响
空载体组中Akt的磷酸化(p-Akt)与Akt总蛋白水平的比值(p-Akt/Akt)较对照组无显著差异,CD44转染组p-Akt/Akt值显著高于对照组;对照siRNA对CD44诱导的HUVECs增殖无显著影响,Akt siRNA显著降低了CD44诱导的HUVECs增殖(P<0.05)(图3)。
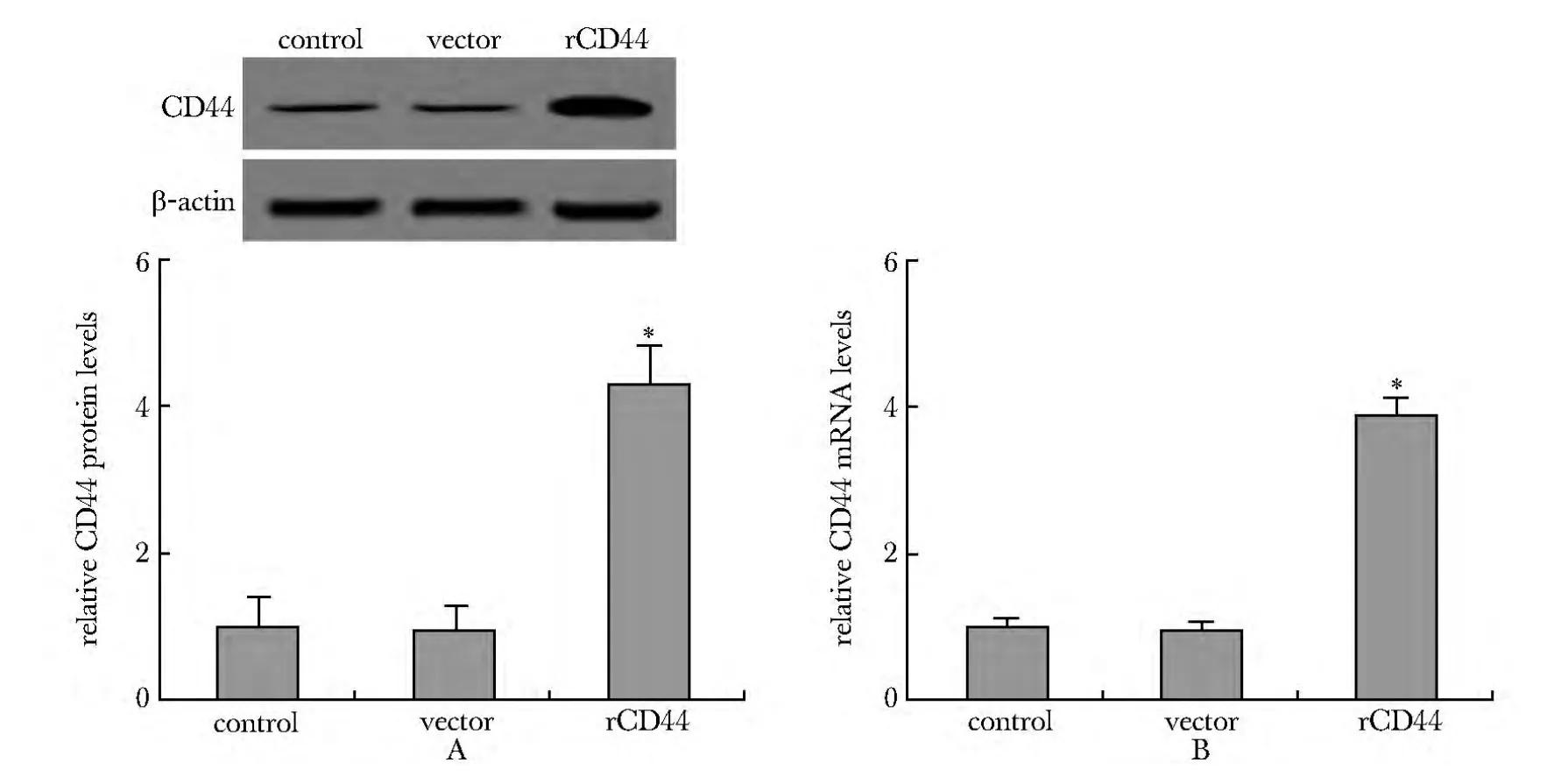
图1 CD44转染后HUVECs中CD44蛋白表达及CD44 mRNA水平Fig 1 CD44 protein expression and CD44 mRNA levels of HUVECs after CD44 transfection

图2 CD44对HUVECs中Ki67蛋白表达及HUVECs增殖的影响Fig 2 The effect of CD44 on the ki67 expression and HUVECs proliferation
2.4 CD44对HUVEC细胞黏附的影响
空载体组的细胞的黏附率较对照无显著差异,而CD44转染组中的细胞黏附率显著高于对照(P<0.05)(图4)。
2.5 CD44对PECAM1表达的影响
空载体组中PECAM1的蛋白及mRNA水平较对照差异不显著,CD44转染组PECAM1的蛋白及mRNA水平显著高于对照组(P<0.05)(图5)。
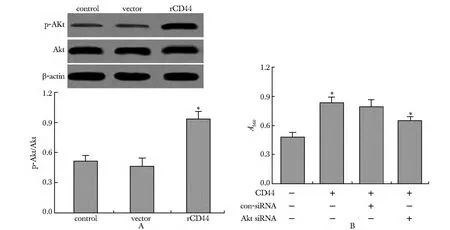
图3 CD44对Akt磷酸化和Akt siRNA对HUVECs细胞增殖的影响Fig 3 The effects of CD44 on Akt phosphorylation and Akt siRNA on HUVECs cell proliferation

图4 CD44转染对细胞黏附的影响Fig 4 The effect CD44 transfection on HUVECs cell adhesion
2.6 PECAM1 siRNA对HUVECs细胞黏附的影响
对照siRNA组中PECAM1的蛋白水平较对照无显著差异,PECAM1 siRNA组中PECAM1的蛋白水平显著低于对照(P<0.05);对照siRNA对CD44诱导的细胞的黏附率无显著影响,PECAM1 siRNA显著降低了CD44诱导的细胞的黏附率(P<0.05)(图6)。
3 讨论
CD44是一种广泛分布的细胞表面蛋白,是透明质酸在细胞膜上的主要受体,曾被认为是一种细胞黏附因子[1]。有报道指出,CD44介导细胞附着到胞外基质成分或特定的细胞表面配体。其主要作用是通过参与细胞—细胞、细胞—分子基质间的相互作用来维持组织和器官的稳定性[8]。CD44在维护血管内皮的完整性中具有重要作用,CD44及其配体透明质酸能够介导淋巴细胞和血管内皮细胞的黏附[9]。而对于CD44促进血管内皮细胞的黏附及其在维护血管内皮的完整性中的作用机制较少报道,本文发现CD44促进了血管内皮细胞的增殖及血管内皮细胞间的黏附,提示CD44血管修复中具有重要作用。
Akt是细胞增殖的主要调控者[10]。在肿瘤细胞中,CD44能够部分通过Akt介导的信号通路调节细胞的生长[11]。本研究发现CD44过表达HUVECs中Akt的磷酸化水平显著上升。采用siRNA沉默细胞中的Akt,发现CD44诱导的HUVECs增殖显著下降但并未完全消失,提示CD44促进血管内皮细胞的增殖部分通过激活Akt信号通路来实现。
血小板内皮细胞黏附因子PECAM1又被称CD31,是血小板表面上一种整合膜糖蛋白,体外培养时集中在内皮细胞间连接处,能够促进细胞黏附[12]。为进一步研究CD44促进血管内皮细胞黏附的作用机制,检测了 CD44过表达 HUVECs中 PECAM1 mRNA和蛋白水平。发现,在CD44过表达显著上调了PECAM1的mRNA和蛋白水平。采用siRNA对PECAM1进行沉默后发现CD44诱导的HUVECs间黏附显著降低,提示CD44通过上调PECAM1的表达来促进血管内皮细胞黏附。

图5 CD44对PECAM1蛋白及PECAM1 mRNA表达的影响Fig 5 The effects of CD44 on expression of PECAM1 protein and PECAM1 mRNA
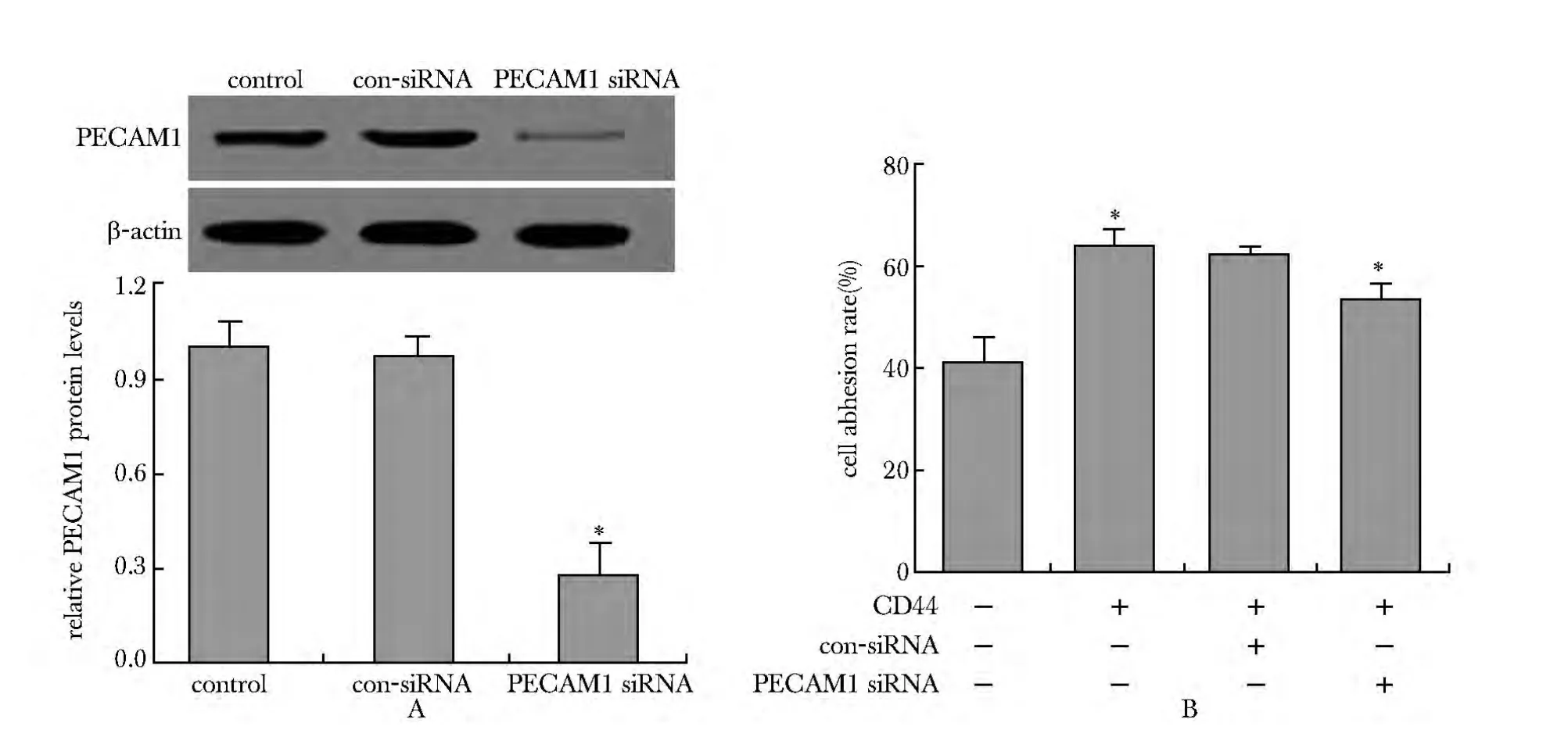
图6 PECAM1蛋白水平(A)和PECAM1 siRNA与CD44共转染对HUVECs细胞粘附率的影响(B)Fig 6 The protein levels of PECAM1 and the effect of PECAM1 siRNA and CD44 co-transfection on HUVECs adhesion
综上所述,本文发现CD44能够促进血管内皮细胞增殖和黏附,提示CD44在血管内皮细胞增殖和修复过程中扮演重要角色。
[1]Arpicco S,De Rosa G,Fattal E.Lipid-based nanovectors for targeting of CD44-overexpressing tumor cells[J].J Drug Deliv,2013,2013:1-8.doi:10.1155/2013/860780.
[2]Flynn KM,Michaud M,Canosa S,et al.CD44 regulates vascular endothelial barrier integrity via a PECAM-1 dependentmechanism [J]. Angiogenesis, 2013, 16:689-705.
[3]Singleton PA,Salgia R,Moreno-Vinasco L,et al.CD44 regulates hepatocyte growth factor-mediated vascular Integrity:role of c-Met,Tiam1/Rac1,dynamin 2,and cortactin[J].J Biol Chem,2007,282:30643-30657.
[4]Mima K,Okabe H,Ishimoto T,et al.CD44s regulates the TGF-β-mediated mesenchymal phenotype and is associated with poor prognosis in patients with hepatocellular carcinoma[J].Cancer Res,2012,72:3414-3423.
[5]Tang DG,Chen YQ,Newman PJ,et al.Identification of PECAM-1 in solid tumor cells and its potential involvement in tumor cell adhesion to endothelium[J].J Biol Chem,1993,268:22883-22894.
[6]曲连悦,蔡爽,姜明燕.人重组蛋白胸腺素B10促进卵巢癌细胞系SKOV3凋亡[J].基础医学与临床,2014,34:707-708.
[7]李天佳,刘暴,倪冷,等.巨噬细胞增强H2O2抑制人血管内皮细胞和兔血管平滑肌细胞的增殖[J].基础医学与临床,2013,33:849-853.
[8]Goodison S,Urquidi V,Tarin D.CD44 cell adhesion molecules[J].Mol Pathol,1999,52:189-196.
[9]DeGrendele HC,Estess P,Picker LJ,et al.CD44 and its ligand hyaluronate mediate rolling under physiologic flow:a novel lymphocyte-endothelial cell primary adhesion pathway[J].J Exp Med,1996,183:1119-1130.
[10]Lawlor MA,Alessi DR.PKB/Akt:a key mediator of cell proliferation,survival and insulin responses?[J].J Cell Sci,2001,114:2903-2910.
[11]Jijiwa M,Demir H,Gupta S,et al.CD44v6 regulates growth of brain tumor stem cells partially through the AKT-mediated pathway[J].PLoS One,2011,6:e24217.doi:10.1371/journal.pone.0023217.
[12] Dunleavey JM,Xiao L,Thompson J,et al.Vascular channels formed by subpopulations of PECAM1+melanoma cells[J].Nat Commun,2014,5:1-16.doi:10.1038/communs6200.
