LINE1-ORF1抗体的制备及神经祖细胞分化中LINE-1转座水平的检测
2015-03-05张海燕陆菁菁
张海燕,陆菁菁
(1.首都医科大学丰台教学医院神经内科,北京 100071;2.首都医科大学附属北京天坛医院神经内科,北京 100050)
长散布元件(long interspersed element-1,LINE-1)是具有自主转座活性的转座子(transposable elements,TE),全长约为6.5 kb(图1),包含一个5'非编码区,两个开放读码框即ORF1和ORF2,以及3'非编码区[1]。LINE-1与很多重大疾病具有密切关系,如血友病,恶性肿瘤和自身免疫等疾病[2-5]。在神经系统疾病方面,已经证实其与Rett综合征,共济失调毛细血管扩张症以及精神分裂症具有很强的相关性[6-8]。
本研究拟以重组ORF1为抗原制备抗LINE-1 ORF1抗体,用于比较不同细胞种类间LINE-1 ORF1蛋白表达的差异;同时对神经细胞分化过程中其ORF1蛋白水平进行检测。以进一步阐明LINE-1与神经发育之间的关系及其在神经系统发育中扮演的重要的作用。

图1 LINE-1的结构Fig 1 The structure of representative LINE-1 elements
1 材料与方法
1.1 细胞系及培养基
细胞系:293/293T(人胚肾细胞)、A549(人肺腺癌细胞)和HeLa(实验用增殖表皮癌细胞)培养于含10% 胎牛血清的DMEM培养基(中国医学科学院基础医学研究所细胞资源中心)。胚胎干细胞HES 3.1(上海基免实业有限公司)。大肠杆菌DH5α RosettaTM(DE3)(首都医科大学丰台教学医院实验室保存)。
1.2 质粒,菌株及主要试剂
真核表达载体pcDNA(Invitrogen公司)和原核表达载体pET28a(Novagen公司);Pfu DNA聚合酶和DNA marker(全式金生物技术有限公司);内切酶和T4 DNA连接酶(NEB公司);蛋白Marker(Thermo Fisher公司);小量质粒抽提试剂(Axygen公司);镍离子柱(GE公司);异丙基-β-D硫代半乳糖苷(IPTG公司)和 HRP标记的羊抗小鼠/兔 IgG(Sigma公司);FITC标记的羊抗兔IgG和TRITC标记羊抗小鼠IgG(中杉金桥生物技术有限公司);抗G3BP1抗体(Santa Cruz生物技术公司,sc-365338);抗actin抗体(CST公司,4967);抗S6 Ribosomal抗体(Pierce公司,MA5-15123);Lipofectamine 2000(Life technology公司)。寡核苷酸引物合成和序列测定均由上海生工生物技术有限责任公司完成,其余所用化学试剂均为分析纯。
1.3 LINE1-ORF1原核表达质粒以及真核表达质粒构建
原核表达质粒pET28a-ORF1和真核表达质粒pcDNA-ORF1通过常规基因克隆操作方法获得,所有序列均通过测序以确保完全正确。
1.4 LINE1-ORF1蛋白质的诱导表达、纯化及鉴定
将构建好的原核表达质粒pET28-ORF1转化入RosettaTM(DE3)感受态细胞中,涂布于含有卡那霉素抗性的LB平板,37℃过夜培养。然后挑取单克隆于3 mL LB培养基中,37℃振荡培养过夜。然后按1∶100的接种量进行2次活化,220 r/min,37℃摇床培养细菌,菌体密度生长至对数期后,在18℃,不同终浓度的IPTG(0.05、0.1和0.2 mmol/L)诱导下,分别培养4、6和8 h后离心收集菌体,经超声破碎,分别收取破碎后上清与沉淀,利用SDS-PAGE检测表达蛋白的相对分子质量,表达形式及最佳诱导条件。随后对该工程菌株进行扩大培养,按照镍离子亲和树脂纯化的操作步骤纯化目的蛋白ORF1,纯化产物用SDS-PAGE电泳鉴定。确定合适的诱导条件后,扩大培养工程表达菌,超声破碎后产物通过镍株纯化,进行离子交换获得更纯化的ORF1蛋白。
1.5 抗体制备
将纯化得到的ORF1蛋白作为免疫原与等体积弗氏完全佐剂充分乳化后,采用的是皮下多点免疫法免疫兔,剂量为250 μg,基础免疫与加强免疫共7次。末次免疫8 d后采血,分离血清,并进行纯化、测定抗体效价。
1.6 质粒共转染真核细胞
用Lipofectamin 2000转染试剂转染重组质粒pcDNA-ORF1至真核细胞中,6孔板转染质粒用量为1~5 μg,相应的 Lipofectamin 2000用量为 2~10 μL,转染48 h后进行检测。
1.7 免疫印记(Western blot)实验
细胞用PBS洗2遍后,加入RIPA细胞裂解液进行细胞裂解,裂解15 min后,4℃,12 000 r/min,离心10 min去除细胞碎片,取上清加入上样缓冲液,煮沸5 min,应用传统方法进行SDS-PAGE和Western blot检测。一抗及工作浓度如下:Actin(1∶2 000),ORF1(1∶1 000),HRP 标记的二抗(1∶5 000),通过化学发光法进行检测。
1.8 免疫荧光显微镜(immunofluorescence microscopy)
细胞转染方法同前,转染后48h,用4%多聚甲醛固定细胞后,用Triton X-100打孔,一抗及其工作浓度:ORF1(1∶500),G3BP1(1∶1 000)。二抗及其工作浓度:FITC标记的羊抗兔二抗(1∶500),TRITC标记羊抗小鼠二抗(1∶500)。用 Leica TCS SPE,DM2500 Microscope(Leica Microsystems)进行连续断层扫描,图像叠加。
1.9 胚胎干细胞分化为神经祖细胞
神经祖细胞(neural progenitor cells,NPC)由胚胎干细胞诱导分化而来,主要技术方法见参考文献[9]。胚胎干细胞接种在胚胎成纤维细胞饲养层上,37℃,6%CO2条件下培养,培养液为无血清胚胎干细胞培养液,每天更换培养液,约6~7 d消化传代。在无血清培液中培养1周的拟胚体接种到多聚赖氨酸包被的组织培养皿,加入N2培养液和20 ng/mL FGF2。在随后的培养中进行性增殖。约10 d后将悬浮增殖的神经球机械打散成单细胞,接种至新的组织培养皿中,细胞贴壁增殖。4~5 d传代,每次冻存部分细胞。
1.10 核糖核蛋白颗粒纯化
核糖核蛋白颗粒(RNPs)纯化提取方法见参考文献[10]。细胞加入裂解液[(1.5 mmol/L KCl,2.5 mmol/L MgCl2,5 mmol/L Tris·HCl(pH7.4),1%deoxycolic acid,1%Triton X-100]裂解,通过离心去除沉淀,收集上清。蔗糖密度梯度(8.5%/17%)超速离心纯化RNPs,离心条件4℃,39 000×g,2 h,离心后得到产物重悬于RIPA裂解液中。
2 结果
2.1 LINE-1 ORF1蛋白的原核表达、纯化及验证
镍柱亲和层析纯化产物在约40 ku处有明显的蛋白条带,条带较干净。通过离子交换,将收集的峰富集蛋白(60~80 mL洗脱峰)做SDS-PAGE分析,蛋白条带更为清晰锐利,提示蛋白纯度更高(图2)。
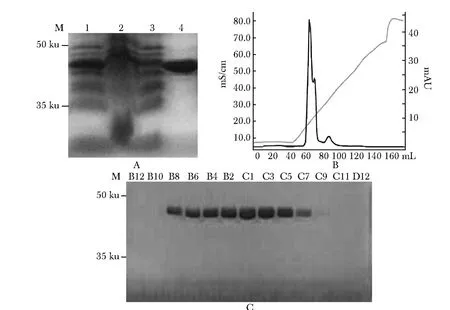
图2 SDS-PAGE分析工程菌中LINE-1 ORF1蛋白的表达以及纯化产物Fig 2 SDS-PAGE profile of LINE-1 ORF1 protein expression and purification ORF1 from E.Coli
2.2 兔抗重组ORF1蛋白多克隆抗体的制备及鉴定
通过重组ORF1蛋白免疫兔后,获得ORF1多克隆抗体。以重组ORF1为抗原,用间接ELISA方法检测免疫前血清和抗血清,效价为1∶20 000,表明抗体具有较好的效价。Western blot实验结果如图3所示。pcDNA-ORF1真核表达质粒转染293T细胞,48 h后的细胞裂解液,在40 ku处有一明显条带,条带清晰且单一,而转染空载体作为对照的细胞裂解液没有可见条带。

图3 免疫印迹法鉴定ORF1抗体Fig 3 Western blot examination of anti-ORF1 antibody
2.3 抗ORF1抗体的应用
2.3.1 应用抗ORF1抗体检测ORF1在真核细胞中定位:在ORF1过表达的HeLa细胞可以清晰观察到过表达ORF1在细胞内的定位,图像清晰。同时对细胞进行ORF1和G3BP1抗体染色,观察到ORF1与G3BP1在HeLa细胞中形成了明显颗粒小体,并且他们的细胞定位基本一致(图4)。
2.3.2 应用抗ORF1抗体进行各种细胞间LINE-1表达水平分析:LINE-1 ORF1在293细胞中表达水平较高,293T细胞中表达水平稍低,而HeLa,A549以及多功能干细胞(ESC)中其表达水平较低,条带不明显(图5)。
2.3.3 用抗ORF1抗体检测神经细胞分化过程中LINE-1表达水平:多功能干细胞(ESC)总细胞裂解液中LINE-1 ORF1蛋白水平较低(图5)。诱导分化后LINE-1 ORF1水平开始升高,约在第6天达到最高值,然后持续下降,最后的神经祖细胞中表达水平低于诱导分化前(图6)。

图4 免疫荧光法检测HeLa细胞中ORF1细胞定位Fig 4 Immunofluorescence examination of ORF1 sublocalization in HeLa cells

图5 内源性LINE-1 ORF1蛋白表达水平鉴定Fig 5 Immunoblot analysis of endogenous ORF1 expression in the indicated cell lines
3 讨论
反转录转座子约占人类基因组的34%,其中与人类疾病有密切关系的约占基因组的0.27%,其中占主导的为 LINE-1,Alu 序列和 SVA(SINE-VNRT-Alu)[11]。

图6 神经祖细胞分化过程中核糖核蛋白复合体中ORF1水平的变化Fig 6 Changes of endogenous ORF1 expression in RNP particles upon differentiation analysed with immunoblot
LINE-1与神经系统方面具有非常紧密的联系,研究证实相比于成人体内的其他细胞,LINE-1在脑细胞中更为丰富且活性增高,在干细胞分化发育成人类神经祖细胞(NPC)过程中,LINE-1在其中的转座将会增加,通过反转录转座子母语的“复制和粘贴”机制,添加额外的副本数百神经元的基因组,随机改变单个脑细胞中的信息。到目前为止,已经确认LINE-1在人类和小鼠神经祖细胞中都可以发生顺利转座。LINE-1在神经祖细胞中的转座可以改变附近基因的表达,而这些基因表达的改变直接影响神经元的命运和功能[12-13]。
自从1988年证实LINE-1在人类疾病发生中所起的作用[2],随后二十多年的研究使人们对LINE-1有了一定程度的了解,明确了LINE-1与人类生理功能以及疾病发生之间的关系。与此同时,目前还没有市售的针对ORF1蛋白特异的抗体,因此制备抗ORF1抗体对于后续深入研究LINE-1功能具有十分重要的现实意义。本研究对其进行制备,经ELISA以及Western blot检测表明,该抗体具有较好的敏感性与特异性。实验过程中,采用His融合的方式进行表达,纯化条件温和,有利于保持蛋白活性。通过动物免疫,获得了大量的多克隆抗体。
通过免疫共聚焦分析,在ORF1过表达的HeLa细胞可以清晰观察到过表达ORF1在细胞内的定位,图像清晰。LINE-1 ORF1蛋白可以与应急颗粒(stress granule)标志物 G3BP1 共定位[14],进一步检测观察到ORF1与G3BP1在HeLa细胞中形成了明显颗粒小体,并且他们的细胞定位基本一致,证实了ORF1抗体可以特异识别细胞内ORF1蛋白,为临床样品进行免疫组化实验奠定了基础。
ORF1蛋白水平直接反映LINE-1的活跃程度,本研究使用制备抗体对不同的细胞内的ORF1蛋白水平进行了检测,对LINE-1水平有了一个基本的认识,有助于为以后的研究提供线索,为实验室研究奠定良好的基础。同时,本研究检测了神经细胞分化过程中LINE-1表达水平的变化,首次在蛋白水平证实了在神经细胞分化过程中LINE-1表达水平在分化前期增高,后期降低,证明并补充了以往的研究结果。实验证据表明LINE-1在神经系统发育中具有较高的活性,提示其活跃转座在神经系统发育中扮演着重要的作用。
[1]Bodak M,Yu J,Ciaudo C.Regulation of LINE-1 in mammals[J].Biomol Concepts,2014,5:409-428.
[2]Kazazian HH,Wong C,Youssoufian H,et al.Haemophilia A resulting from de novo insertion of L1 sequences repre-sents a novel mechanism for mutation in man [J].Nature,1988,332:164-166.
[3]Kawano H,Saeki H,Kitao H,et al.Chromosomal Instability Associated with Global DNA Hypomethylation is Associated with the Initiation and Progression of Esophageal Squamous Cell Carcinoma [J].Ann Surg Oncol,2014,21:696-702.
[4]Crow MK.Long interspersed nuclear elements(LINE-1):potential triggers of systemic autoimmune disease[J].Autoimmunity,2010,43:7-16.
[5]Sukapan P,Promnarate P,Avihingsanon Y,et al.Types of DNA methylation status of the interspersed repetitive sequences for LINE-1,Alu,HERV-E and HERV-K in the neutrophils from systemic lupus erythematosus patients and healthy controls[J].J Hum Genet,2014,59:178-188.
[6]Coufal NG,Garcia-Perez JL,Peng GE,et al.Ataxia telangiectasia mutated(ATM)modulates long interspersed element-1(L1)retrotransposition in human neural stem cells[J].Proc Natl Acad Sci U S A,2011,108:20382-20387.
[7]Bundo M,Toyoshima M,Okada Y,et al.Increased l1 retrotransposition in the neuronal genome in schizophrenia[J].Neuron,2013,81:306-313.
[8]Amir RE,Van den Veyver IB,Wan M,et al.Rett syndrome is caused by mutations in X-linked MECP2,encoding methyl-CpG-binding protein 2 [J].Nat Genet,1999,23:185-188.
[9]林瑞竹,赵春华,徐琦璘.小鼠胚胎干细胞来源的神经干细胞的稳定传代体系探索[J].基础医学与临床,2012,32:644-649.
[10]Kulpa DA,Moran JV.Ribonucleoprotein particle formation is necessary but not sufficient for LINE-1 retrotransposition[J].Hum Mol Genet,2005,14:3237-3248.
[11]谈丹丹,洪道俊,吴裕臣.SVA反转录转座子的研究进展[J].基础医学与临床,2013,33:496-499.
[12]Baillie JK,Barnett MW,Upton KR,et al.Somatic retrotransposition alters the genetic landscape of the human brain[J].Nature,2011,479:534-537.
[13]Thomas CA,Paquola AC,Muotri AR.LINE-1 retrotransposition in the nervous system [J].Annu Rev Cell Dev Biol,2012,28:555-573.
[14]Doucet AJ,Hulme AE,Sahinovic E,et al.Characterization of LINE-1 ribonucleoprotein particles[J].PLoS Genet,2010:6:pii:e1001150.doi:10.1371/journal pgen.1001150.
