妊娠期糖尿病产妇血液HbA1c水平与产科不良症状发生率关系的研究
2015-03-05崔风云
崔风云
(青岛市胶州中心医院产科,山东 胶州 266300)
妊娠期糖尿病产妇血液HbA1c水平与产科不良症状发生率关系的研究
崔风云
(青岛市胶州中心医院产科,山东 胶州 266300)
摘要:目的探讨妊娠期糖尿病(GDM)患者糖化血红蛋白(HbA1c)水平变化与产科不良并发症发生的关系。方法收集2012年6月至2014年6月青岛市胶州中心医院产科收治的GDM患者(孕周在24~28周)122例作为GDM组,对GDM组进行健康教育、指导饮食、体育锻炼等,必要时应用胰岛素,强化血糖控制治疗。选取同期健康妊娠妇女100例作为对照组。分别测定入组时及终止妊娠前血HbA1c水平,比较两组产科不良症状发生率。结果①GDM组入组时HbA1c水平为(6.32±0.30)%,对照组HbA1c水平为(5.31±0.60)%,GDM组HbA1c水平显著高于对照组(P<0.05);经强化血糖控制治疗后终止妊娠前HbA1c水平下降至(5.84±0.85)%,显著低于治疗前(P<0.05),但仍高于对照组(5.01±0.68)%(P<0.05)。②GDM组早产、巨大儿、胎儿宫内窘迫、新生儿低血糖发生率显著高于对照组[11.5%(14/122)比3.0%(3/100),10.7%(13/122)比3.0%(3/100),13.9%(17/122)比5.0%(5/100),14.8%(18/122)比6.0%(6/100),P<0.05]。③终止妊娠前HbA1c>6.5%者早产、巨大儿、胎儿宫内窘迫、新生儿低血糖发生率显著高于HbA1c≤6.5%者[26.5%(9/34)比5.7%(5/88),20.6%(7/34)比6.8%(6/88),26.5%(9/34)比9.1%(8/88),32.4%(11/34)比7.9%(7/88),P<0.05或P<0.01]。结论GDM可增加产科不良症状发生的风险,孕期强化血糖控制可有效降低产科不良症状发生率。
关键词:妊娠期糖尿病;糖化血红蛋白;产科并发症
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指在妊娠期间发生或妊娠期间首次发现的糖耐量异常,是妊娠常见合并症,亚洲妇女中发病率为5%~10%,我国GDM的发病率约为6.6%,且呈逐步上升趋势[1]。大量研究指出,GDM患者若血糖控制不佳,其新生儿呼吸窘迫综合征、巨大儿、新生儿低血糖等不良妊娠结局的发生率将大大上升[2-3]。糖化血红蛋白(glycosylated hemoglobin,HbA1c)是反映血糖长期控制水平的金标准[4]。本研究探讨GDM患者HbA1c水平变化与产科不良并发症发生的关系,为临床治疗提供理论依据,现报道如下。
1资料与方法
1.1一般资料收集2012年6月至2014年6月青岛市胶州中心医院产科收治的GDM患者作为研究对象,入选标准:符合第七版《妇产科学》[5]中关于GDM的诊断标准;首次发现GDM时孕周在24~28周。排除标准:因院外分娩等各种原因导致终止妊娠前未采血检测HbA1c值。符合上述标准共122例,作为GDM组。选取同期健康妊娠妇女100例作为对照组。其中GDM组122例,年龄20~39岁,平均(28.6±3.2)岁;孕0~5次,平均(2.2±1.0)次;曾有不良孕产史13例。对照组100例,年龄21~39岁,平均(28.8±3.4)岁;孕0~6次,平均(2.3±1.1)次;有不良孕产史12例。两组在年龄、孕次、孕产史方面差异无统计学意义(P>0.05),具有可比性。
1.2方法参考第七版《妇产科学》,采用糖耐量试验诊断GDM。孕妇空腹12 h后,将75 g葡萄糖粉溶于200 mL水中,嘱孕妇5 min内饮用完毕,测定其空腹时、饮用葡萄糖水后1 h、2 h血糖。空腹血糖≥5.1 mmol/L,1 h血糖≥10.0 mmol/L或2 h血糖≥8.5 mmol/L三项符合任意一项即可诊断GDM[5]。对于已明确诊断GDM的孕妇,对其进行健康教育、指导饮食、体育锻炼等,必要时应用胰岛素,强化血糖控制治疗。第七版《妇产科学》[5]中认为HbA1c正常值为4%~6%,但血糖轻微上升时HbA1c值可维持在正常水平[6],因此本研究将6.5%定为HbA1c的临界值。
1.3观察指标分别测定孕妇入组时、终止妊娠前HbA1c水平,统计早产、巨大儿、胎儿宫内窘迫、胎膜早破、新生儿低血糖等产科不良并发症发生情况,不良并发症诊断标准参考第七版《妇产科学》[5]。
2结果
2.1各组入组时及终止妊娠前HbA1c水平比较GDM组中88例(72.1%)达到血糖控制标准(HbA1c≤6.5%)。GDM组入组时HbA1c水平显著高于对照组(P<0.05),经强化血糖控制治疗后终止妊娠前HbA1c水平显著下降(P<0.05),但仍高于对照组(P<0.05)。见表1。
2.2两组产科不良症状发生率比较GDM组早产、巨大儿、胎儿宫内窘迫、新生儿低血糖发生率显著高于对照组(P<0.05),两组胎膜早破发生率差异无统计学意义(P>0.05),见表2。
2.3终止妊娠前HbA1c值与产科不良症状发生率的关系终止妊娠前HbA1c>6.5%者早产、巨大儿、胎儿宫内窘迫、新生儿低血糖发生率显著高于HbA1c≤6.5%者(P<0.05或P<0.01),胎膜早破发生率差异无统计学意义(P>0.05),见表3。
表1GDM组与对照组入组时及终止妊娠前
HbA1c水平比较

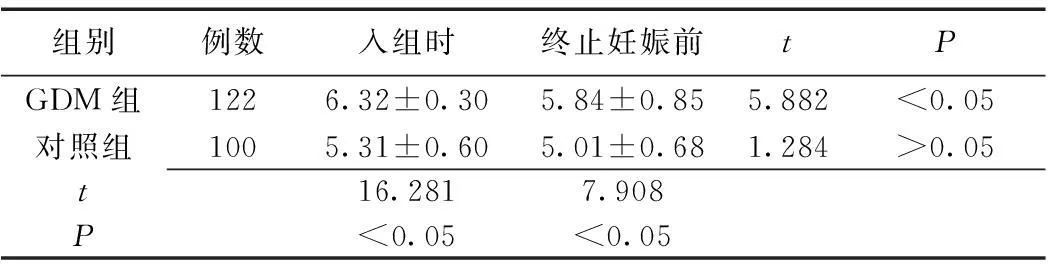
组别例数入组时终止妊娠前tPGDM组1226.32±0.305.84±0.855.882<0.05对照组1005.31±0.605.01±0.681.284>0.05t16.2817.908P<0.05<0.05
GDM:妊娠期糖尿病;HbA1c:糖化血红蛋白;对照组:健康妊娠妇女
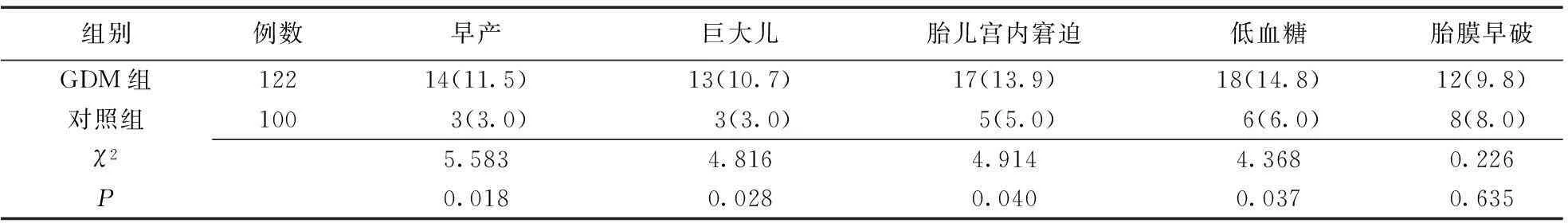
表2 两组产科不良症状发生率比较 [例(%)]
GDM:妊娠期糖尿病;对照组:健康妊娠妇女

表3 终止妊娠前不同HbA1c值者产科不良症状发生率比较 [例(%)]
HbA1c:糖化血红蛋白
3讨论
妊娠期女性机体处于特殊状态,各系统均出现不同程度的变化。这一阶段女性发生任何疾病都会对胎儿的生长发育产生影响[7]。HbA1c是反映血糖长期控制水平的金标准,其检测结果反映的是采血前8~12周的血糖控制情况[8],对于判断GDM血糖控制水平、指导临床治疗具有重要参考意义。
本研究结果显示,DM组入组时HbA1c水平显著高于对照组,但经强化血糖控制治疗后孕妇于终止妊娠前复查HbA1c水平已有显著下降(P<0.05),仍高于对照组(P<0.05),这一结果提示GDM孕妇经系统强化控制血糖治疗后,HbA1c水平降低,但仍有部分无法降低至正常水平,这可能与孕妇生活饮食习惯、内分泌水平有关[9]。有研究指出,相对于正常孕产妇,合并GDM的孕产妇孕期及围生儿相关不良并发症会明显升高[10]。本研究中,GDM组早产、巨大儿、胎儿宫内窘迫、新生儿低血糖发生率显著高于对照组(P<0.05),与上述研究结果基本一致。
本研究根据终止妊娠时孕妇HbA1c水平将孕妇分为血糖控制良好(HbA1c≤6.5%)和血糖控制不良(HbA1c>6.5%)进行比较,结果显示,HbA1c>6.5%的孕妇早产、巨大儿、胎儿宫内窘迫、新生儿低血糖发生率明显较HbA1c≤6.5%的患者高(P<0.05或P<0.01)。本研究中HbA1c>6.5%的孕妇早产率高达26.5%,分析原因,本研究认为与GDM孕妇各种并发症导致的医源性早产有关[11]。巨大儿是指足月新生儿体质量超过4000 g,其发生与胎儿在生长发育过程中长期处于高糖环境有关,胎儿在此环境中胰岛素大量分泌,脂肪和蛋白质合成过多[12],本研究中HbA1c>6.5%的孕妇巨大儿发生率为20.6%,而HbA1c≤6.5%的孕妇仅为6.8%。胎儿宫内窘迫是产科最棘手的急症之一,是孕晚期威胁胎儿生命的首要原因,可导致胎死宫内、新生儿重度窒息等严重并发症[13]。GDM孕妇由于长期高血糖刺激,胎盘毛细血管存在不同程度的损伤,可出现胎盘血管痉挛、管腔狭窄等情况,胎盘供血不足,从而导致胎儿窘迫。本研究中,GDM孕妇经过治疗后HbA1c恢复至正常范围之内,其胎儿窘迫发生率也显著降低(9.1% 比26.5%,P<0.05)。新生儿低血糖是指婴儿出生后30 min内测定血糖<2.2 mmol/L。该值主要受母体血糖水平的影响,胎儿在母体中时长期受到高血糖的影响,自身胰岛素分泌增加,体内处于高代谢水平,刚离开母体时糖代谢仍处于较高水平,从而发生低血糖[14]。本研究证实了上述理论,GDM组中终止妊娠前HbA1c>6.5%者发生率显著高于HbA1c≤6.5%者(32.4% 比7.9%,P<0.05)。该结果提示可通过检测孕妇HbA1c水平来预测新生儿低血糖的发生,但应用于临床仍需进一步大样本量的研究。本研究中,各组胎膜早破发生率差异无统计学意义(P>0.05)。胎膜早破发生于主要与生殖道感染相关[15],GDM孕妇经积极治疗后生殖道感染等致病因素发生率降低,从而使GDM组胎膜早破发生率接近于对照组。
虽然所有的GDM孕妇均给予了相应的强化血糖控制治疗,但仍只有72.1%的患者达到了血糖控制目标,本研究考虑此结果可能与患者GDM病情、自我管理、个人认识等多方面因素有关,可进一步研究其血糖控制相关因素。
综上所述,GDM孕妇血液HbA1c水平与产科不良症状发生率可能存在一定的相关性,但仍需进一步的大样本量研究才能得出,HbA1c>6.5%者产科不良症状发生率较高。临床上对于GDM孕妇要积极治疗,控制血HbA1c值在正常水平,降低产科不良反应发生率。
参考文献
[1]周莉,吴连方,范玲,等.妊娠期糖尿病孕妇产后糖代谢异常的影响因素[J].首都医科大学学报,2012,33(2):263-267.
[2]李海素,狄英波,谭冲,等.妊娠期糖尿病孕期干预与妊娠结局关系的研究[J].中国妇幼保健,2012,27(3):357-358.
[3]Collares CV,Evangelista AF,Xavier DJ,etal.Transcriptome meta-analysis of peripheral lymphomononuclear cells indicates that gestational diabetes is closer to type 1 diabetes than to type 2 diabetes mellitus[J].Mol Biol Rep,2013,40(9):5351-5358.
[4]陈海天,胡明晶,王广涵,等.广东巨大儿发病率调查及高危因素分析[J].中山大学学报:医学科学版,2012,33(2):276-280,封3.
[5]乐杰.妇产科学[M].7版.北京:人民卫生出版社,2004:137-139.
[6]杨晓菊,杨宗利,王学芹,等.HIF-1α、VEGF在妊娠期糖尿病胎盘组织中的表达及其与胎儿缺氧的关系[J].实用妇产科杂志,2012,28(11):962-966.
[7]Morbiducci U,Di Benedetto G,Gaetano L,etal.Predicting the metabolic condition after gestational diabetes mellitus from oral glucose tolerance test curves shape[J].Ann Biomed Eng,2014,42(5):1112-1120.
[8]张利萍.妊娠期糖尿病的病理生理分析[J].现代中西医结合杂志,2013,22(5):562-566.
[9]马临秀.妊娠期糖尿病治疗时机与母婴预后的关系[J].中国妇幼保健,2012,27(23):3692-3693.
[10]陈宝昌,戴兰芬,张晶,等.妊娠期糖尿病对新生儿脐血抵抗素水平及胰岛素抵抗的影响[J].山东医药,2014,54(26):14-15.
[11]高倩.妊娠期糖尿病与代谢综合征的关系研究进展[J].实用妇产科杂志,2014,30(3):178-181.
[12]赵敏琦,周玮,刘世芬,等.妊娠期糖尿病孕妇分娩后糖代谢异常的相关因素分析[J].实用医学杂志,2014,30(2):254-256.
[13]孙平平,李华萍,赵芳,等.妊娠期糖代谢异常导致巨大儿发生的危险因素分析[J].实用妇产科杂志,2012,28(1):64-67.
[14]罗静,常青,王廷洲,等.新妊娠期糖尿病诊断标准与围生期母儿结局分析[J].实用妇产科杂志,2012,28(9):755-758.
[15]肖苑玲,潘石蕾,陈炜,等.妊娠期糖尿病与妊娠并发症的相关性[J].广东医学,2012,33(23):3575-3576.
Study on the Relationship between the HbA1cLevel and Obstetric Complications in Gestational Diabetes WomenCUIFeng-yun.(DepartmentofObstetrics,QingdaoJiaozhouCentralHospital,Qingdao266300,China)
Abstract:ObjectiveTo investigate the relationship between the glycosylated hemoglobin(HbA1c) level and obstetric complications in gestational diabetes women(GDM).MethodsA total of 122 patients with GDM (24-28 weeks in pregnancy) were collected as the GDM group from Jun.2012 to Jun.2014 in department of Obstetric Qingdao Jiaozhou Central Hospital,GDM group were given health education,diet guide,physical exercise,and insulin when necessary to strengthen the blood glucose control.100 healthy pregnant women were selected during the same period as the control group.The serum HbA1clevel was tested at admission into study and before the termination of pregnancy.The obstetric complications of the two groups were compared.Results①At study entry,the HbA1clevel of GDM group and control group were (6.32±0.30)% and (5.31±0.60)%,HbA1clevel of GDM group was significantly higher than that of control group (P<0.05); after intensive glucose control therapy,HbA1clevel before pregnancy was decreased to (5.84±0.85)% and significantly lower than that before treatment (P<0.05),but it was still higher than that of the control group′s (5.01±0.68)% (P<0.05).②The preterm birth,macrosomia,fetal distress,neonatal hypoglycemia incidence rate of the two groups were significantly higher than the control group [11.5%(14/122) vs 3.0%(3/100),10.7%(13/122) vs 3.0%(3/100),13.9%(17/122) vs 5.0%(5/100),14.8% (18/122) vs 6.0%(6/100),P<0.05].③The premature delivery,fetal macrosomia,fetal distress,neonatal hypoglycemia incidence of patients whose HbA1c>6.5% were significantly higher than patients whose HbA1c≤ 6.5% [26.5%(9/34) vs 5.7%(5/88),20.6%(7/34) vs 6.8%(6/88),26.5%(9/34) vs 9.1%(8/88),32.4%(11/34) vs 7.9%(7/88),P<0.05 or P<0.01].ConclusionGDM can increase the risk of obstetric complications during pregnancy.Intensive blood glucose control during pregnancy can effectively reduce the incidence of obstetric complications.
Key words:Gestational diabetes mellitus; Glycosylated hemoglobin; Obstetric complications
收稿日期:2015-05-06修回日期:2015-07-27编辑:相丹峰
doi:10.3969/j.issn.1006-2084.2015.20.043
中图分类号:R714.25
文献标识码:A
文章编号:1006-2084(2015)20-3764-03
