嗜酸乳酸杆菌对过敏性鼻炎模型大鼠血清中组胺、IL-5、IL-12及组织中ICAM-1的影响
2015-03-04池海超
池海超,陈 觅,张 杰
(中国人民武装警察部队湖北省总队医院耳鼻喉科,武汉430060)
过敏性鼻炎(allergic rhinitis,AR)是呼吸系统常见的、多发的一种疾病,不仅严重地危害了人们身体健康而且容易诱发多种疾病[1]。AR 主要是患者吸入变应原,炎症介质的释放,导致鼻黏膜发生炎症[2]。同时发病原因也和体质、遗传、免疫等因素息息相关[3]。AR 的临床表现主要有鼻塞、流鼻涕、鼻痒、打喷嚏及嗅觉功能障碍等。此外,它还可能导致或并发鼻窦炎、鼻息肉、咽炎、中耳炎、气管和支气管炎、哮喘和变应性眼结膜炎等疾病,严重影响人们的睡眠、学习、工作及生活质量[4-5]。AR 主要通过药物进行治疗,存在安全性方面的问题,同时伴发较多不良反应[6]。有研究证明嗜酸乳酸杆菌(lacto-bacillus acidophilus,LBA)能够通过调剂免疫反应预防或减轻过敏性症状,对临床上AR的防治有深远意义[7-8]。但免疫调节机制尚未十分清楚,本研究拟建立AR大鼠模型,通过乳酸杆菌对模型大鼠组织中ICAM-1及血清中组胺、白细胞介素(IL)-5、IL-12的影响,探讨乳酸杆菌对AR大鼠免疫调节作用机制。
1 材料与方法
1.1 实验动物、主要仪器及试剂 SPF 级雄性SD 大鼠48只,扬州大学实验动物中心提供,体质量200~220g。LBA 浓缩冻干粉,有效活菌数大于或等于100亿个/g,购自广东金辛医药科技有限公司。卵清蛋白(ovalbumin,OVA)购自上海化学试剂厂。氯雷他定片(borata dine tablets,LRD)10 mg/片,购自上海先灵葆雅制药有限公司。氢氧化铝[Al(OH)3]购自上海凌峰化学试剂有限公司;组胺、白细胞介素-5(IL-5)、IL-12试剂盒购自上海恒远生物科技有限公司;Trizol试剂、逆转录试剂盒、Taq酶、上下游引物由上海生工生物科技有限公司生产或合成。BCA 蛋白浓度测定盒购自杭州碧云天生物技术研究所;ICAM-1一抗、山羊抗大鼠二抗、ECL发光显色液购自美国Millipore公司。其他试剂均为分析纯。
1.2 分组及造模 将48只雄性SD 大鼠分为4组:对照组、模型组、LBA 组、氯雷他定(LRD)组,每组12只。LBA 组每天按照2mL/kg灌服配制好的LBA 混悬液;对照组、模型组、LRD组每天灌服等量生理盐水,连续灌服3周。第4周,按照参考文献方法[8],具体方法为:模型组、LBA 组、LRD 组大鼠以OVA 10mg、Al(OH)330mg及生理盐水1mL混合后腹腔注射,隔天1次,连续7次,进行初次免疫;第15天进行激发,每天给予5% OVA 20μg滴鼻/侧和1%OVA 喷雾吸入5min,连续7d。对照组同期使用无菌生理盐水进行假致敏及假激发。
1.3 给药方法 LBA 组按照2mL/kg大鼠体质量灌服配制好的LBA 混悬液,造模期间同时给药直到实验结束;LRD 组于造模激发每天滴鼻前按照5mg/kg大鼠体质量灌服生理盐水溶解的LRD,每天1次,连续给药7d。对照组与模型组灌服等体积生理盐水。
1.4 症状评分标准 最后一次给药2h后对大鼠进行症状评分,评分标准如下[9]。鼻痒:无搔鼻为0分,轻度搔鼻1~5次为1分,中度搔鼻6~10 次为2 分,重度搔鼻11 次以上为3分;喷嚏:无喷嚏为0分,1~5次为1分,6~10次为2分,11次以上为3分;清涕:无清涕为0分,以溢至鼻孔为1分,明显流涕超出鼻孔为2 分,涕流满面及挂满须毛为3 分。并计算总分。
1.5 血清组胺、IL-5、IL-12水平检测 最后一次给药2h后,0.8%戊巴比妥钠(0.5 mL/100g)腹腔注射麻醉。颈动脉取血,10min 3 500r/min取上清,于-80 ℃保存。酶联免疫吸附法测定血清组胺、IL-5、IL-12水平。
1.6 ICAM-1mRNA 和蛋白表达检测 取鼻中隔黏膜,采用Trizol试剂盒进行总RNA 的提取,经核酸测定仪检测RNA浓度并定量。采用两步法进行反转录。ICAM-1上游引物:5′-AAG TGC TGC CGT CTC TAC AGT-3′;下游引物:5′-AGA GAC AGC GGT GGC TAA CT-3′。以GAPDH 为内参,并计算相对灰度值。将鼻黏膜组织严格按照蛋白抽提试剂盒进行抽提。BCA 法蛋白定量。蛋白免疫印迹法(Western blot)方法:配制12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离胶,每孔蛋白30μg。电泳80V20min,135V40 min。电转:250mA 90min。取出膜,封闭2h、一抗4℃过夜、二抗2h。ECL发光显色,曝光。用目的蛋白的灰度值与内参(GAPDH)的灰度值比值作用目的蛋白的相对表达量。
1.7组织病理检测 取新鲜鼻黏膜组织甲醛固定,乙醇梯度脱水,包埋、切片、苏木素-伊红(HE)染色,光镜观察。按照参考文献进行评分[10]。
1.8 统计学处理 采用SPSS19.0软件进行数据分析,计量资料以±s表示,多组间两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 症状评分比较 与对照组比较,模型组大鼠鼻痒、喷嚏、清涕等3项评分及总分显著增加(P<0.01);与模型组比较,LVA 组与LRD 组大鼠鼻痒、喷嚏、清涕3项症状评分及总分显著降低(P<0.01);LBA 组大鼠除喷嚏评分高于LRD 组外(P<0.05),鼻痒、清涕2项评分及总分与LBA 组差异无统计学意义(P>0.05)。见表1。
2.2 血清中组胺、IL-5、IL-12的水平 与对照组比较,模型组大鼠血清组胺和IL-5水平均显著升高(P<0.01),IL-12水平显著降低(P<0.01)。与模型组比较,LBA 组及LRD 组大鼠血清组胺、IL-5水平显著降低(P<0.01),IL-12水平显著升高(P<0.01);LBA 组与LRD 组比较,大鼠血清组胺和IL-5水平差异无统计学意义(P>0.05),IL-12水平差异有统计学意义(P<0.05)。见表2。
2.3 ICAM-1mRNA 及蛋白的表达 与对照组相比,模型组大鼠鼻黏膜组织中ICAM-1 mRNA 和蛋白的表达显著升高(P<0.01);与模型组比较,LBA 组与LRD 组大鼠鼻黏膜中ICAM-1mRNA 和蛋白表达显著降低(P<0.01);LBA 组与LRD 组比较大鼠鼻黏膜ICAM-1mRNA 和蛋白表达差异无统计学意义(P>0.05)。见图1。
表1 症状评分结果(±s,n=12,分)
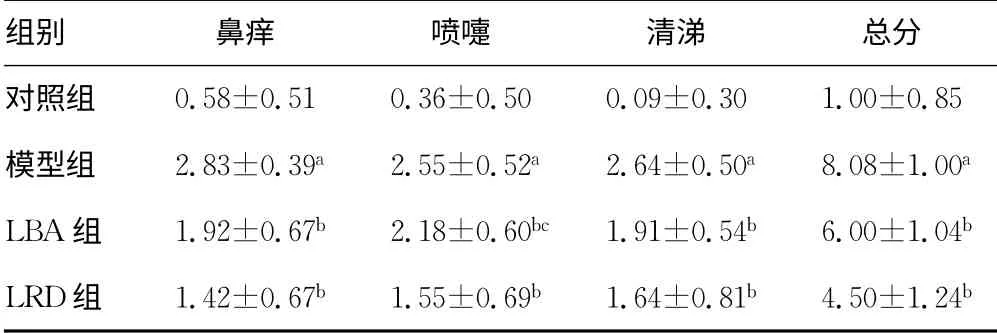
表1 症状评分结果(±s,n=12,分)
a:P<0.01,与对照组比较;b:P<0.01,与模型组比较;c:P<0.05,与LRD组比较。
组别 鼻痒 喷嚏 清涕 总分对照组0.58±0.51 0.36±0.50 0.09±0.30 1.00±0.85模型组 2.83±0.39a 2.55±0.52a 2.64±0.50a 8.08±1.00a LBA组 1.92±0.67b 2.18±0.60bc 1.91±0.54b 6.00±1.04b LRD组 1.42±0.67b 1.55±0.69b 1.64±0.81b 4.50±1.24 b
表2 血清中组胺、IL-5、IL-12水平变化(±s,n=12)
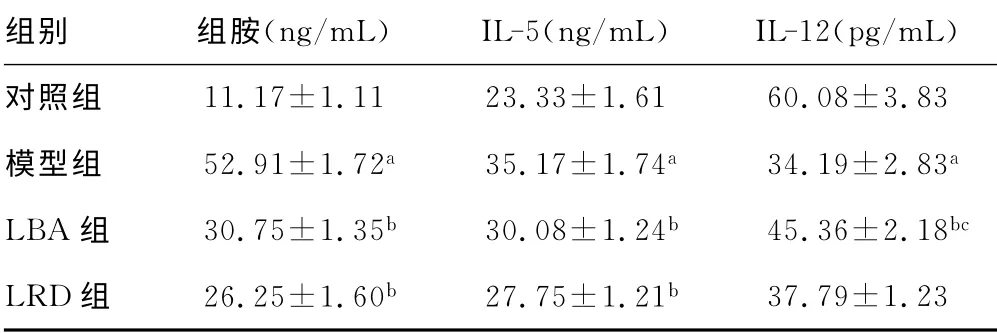
表2 血清中组胺、IL-5、IL-12水平变化(±s,n=12)
a:P<0.01,与对照组比较;b:P<0.01,与模型组比较;c:P<0.05,与LRD组比较。
组别组胺(ng/mL) IL-5(ng/mL) IL-12(pg/mL)对照组11.17±1.11 23.33±1.61 60.08±3.83模型组 52.91±1.72a 35.17±1.74a 34.19±2.83a LBA 组 30.75±1.35b 30.08±1.24b 45.36±2.18bc LRD组 26.25±1.60b 27.75±1.21b 37.79±1.23
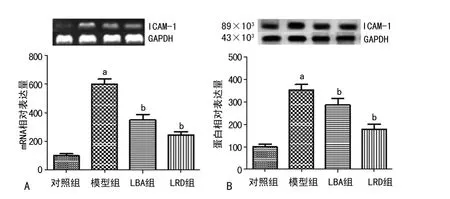
图1 鼻黏膜组织ICAM-1mRNA 及蛋白表达
2.4 鼻黏膜组织病理学变化 对照组大鼠鼻黏膜组织无变化。光镜下模型组大鼠鼻黏膜组织可见柱状纤毛上皮表现为局限性或弥漫性的增生肿胀。细胞核淡染,细胞体出现肿胀。杯状细胞明显增多,黏膜下腺体可见增生样改变。细胞间质可见明显的充血及水肿现象,并伴有一定数量的淋巴细胞、浆细胞及嗜酸性粒细胞的浸润。LBA 组大鼠鼻黏膜组织病理形态改变能够见到少量的炎性浸润,未发现明显增生及纤毛倒伏等改变。LRD 组大鼠鼻黏膜组织未见明显改变,或偶见炎性细胞侵润。见表3,图2。
表3 各组大鼠病理评分结果(±s,n=12,分)

表3 各组大鼠病理评分结果(±s,n=12,分)
a:P<0.01,与模型组比较。-:此项无数据。
组别 病理评分对照组-模型组 3.50±0.53 LBA 组 1.94±0.56a LRD组 1.78±0.72 a
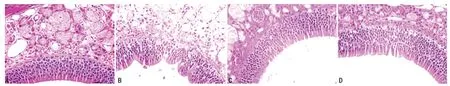
图2 各组大鼠鼻黏膜组织典型病例切片
3 讨 论
AR 是一种以鼻黏膜变应性炎症为特征的超敏反应性疾病,病变过程由多种细胞因子和多种免疫活性细胞参与[11]。从免疫学角度分析,AR 是体外环境因素作用于机体产生的异常免疫反应,造成Th细胞免疫反应失衡而引发的变应性炎性反应[12-13]。Th细胞又可分为Th1细胞和Th2细胞。IL-5是Th2细胞分泌的一种重要细胞因子,对嗜酸性粒细胞的发育、活化、浸润有刺激作用,并且能够延长其存活时间[14]。嗜酸性粒细胞的发育、浸润程度与AR 的严重程度密切相关。同时IL-5是IgE的正性调节因子,促使机体分泌各种炎性物质,如组胺、嗜酸性粒细胞趋化因子、花生四烯酸代谢产物,引起各种炎性临床症状。IL-12是Th1细胞分泌的一种重要细胞因子,由单核细胞产生,具有多种免疫调节作用,可减少外周血和痰液中的嗜酸性粒细胞的数量,抑制嗜酸性粒细胞的聚集和浸润,并可促其凋亡,抑制旁路记忆性T 细胞、嗜酸性粒细胞及肥大细胞脱颗粒[15]。ICAM-1是一种细胞间黏附分子,在变态反应中主要作为炎症细胞的黏附和信息交流的可溶性递质、参与介导炎症细胞穿越血管内皮细胞的过程[16-18]。在正常生理情况下鼻黏膜上皮细胞仅表达少量的ICAM-1,而在细胞因子和炎症介质的作用下可引起强烈表达,并且ICAM-1 参与了AR 的发病机制,其为AR 发病、治疗及预后的监测指标[19-20]。
LBA 是一种与人类生活密切相关的益生菌,对人体有营养作用,同时研究还发现其具有提高免疫力和生物拮抗的作用。随着研究的不断开展,已经证实了LBA 具有广泛有效的免疫治疗作用。本实验通过评价AR 大鼠症状评分,血清组胺、IL-5、IL-12水平、鼻黏膜组织中ICMA-1mRNA 及蛋白表达,组织病理变化,评价LBA 对AR 的作用。结果显示,长期(约6周)给予LBA 后,大鼠3项症状评分及总分显著低于模型组,大鼠鼻黏膜组织切片评分较模型组显著降低,提示症状显著好转,并且与阳性药组无显著性差异;血清组胺、IL-5水平较模型组显著降低,提示炎症细胞因子受到抑制,并且与阳性药组无显著性差异;血清IL-12水平较模型组显著升高,并且较阳性药组显著提高,提示大鼠免疫能力得到提升;鼻黏膜组织中ICMA-1mRAN 及蛋白表达和模型组相比显著降低,与阳性药组相比无显著性差异。
综上所述,长期(约6周)给予LBA 可降低血清组胺、IL-5水平及组织中ICMA-1的表达,提高血清IL-12水平对AR 发挥治疗作用。
[1] Gangal SV,Chowgule R.Infections in early Life and susceptibility to allergic diseases:relevance of hygiene hypothesis[J].Curr Sci,2009,96(6):784-793.
[2] Kawamoto S,Kaneoke M,Ohkouchi K,et al.Sake lees fermented with lactic acid bacteria prevents allergic rhinitis-like symptoms and IgE-mediated basophil degranulation[J].Biosci Biotechnol Biochem,2011,75(1):140-144.
[3] Perelman M,Fisher AN,Smith A,et al.Impact of allergic rhinitis and its treatment on the pharmacokinetics of nasally administered fentanyl[J].Int J Clin Pharmacol Ther,2013,51(5):349-356.
[4] 刘群,杨佳,赵百孝.不同灸法治疗过敏性鼻炎研究概况[J].世界中医药,2014(7):923-927.
[5] Wu ZJ,Du X,Zheng J.Role of lactobacillus in the prevention of clostridium difficile-associated diarrhea:a meta-analysis of randomized controlled trials[J].Chinese Med J,2013,126(21):4154-4161.
[6] 章文明,汪海峰,刘建新.乳酸杆菌益生作用机制的研究进展[J].动物营养学报,2012,24(3):389-396.
[7] Kim DY,Fukuyama S,Nagatake T,et al.Implications of nasopharynx-associated lymphoid tissue(NALT)in the development of allergic responses in an allergic rhinitis mouse model[J].Allergy,2012,67(4):502-509.
[8] Gandy JJ,Meeding JP,Snyman JR,et al.Clinical efficacy of Potassium humate in the treatment of allergic rhinitis:Double-Blind Placebo-Controlled trial[J].Drug Dev Res,2010,71(6):358-363.
[9] Sato K,Miyoshi F,Yokota K,et al.Marked induction of c-Maf protein during Th17cell differentiation and its implication in memory Th cell development[J].J Biol Chem,2011,286(17):14963-14971.
[10] 卢健敏.针刺对变应性鼻炎大鼠模型血清IL-5和鼻黏膜组织IL-5mRNA 表达的影响[J].长春中医药大学学报,2013,29(1):37-38.
[11] 孙叶飞,张旭,曲慧玲,等.甘珀酸对EAE 小鼠IL-12、IL-23表达的影响[J].中国医科大学学报,2013,42(10):903-906.
[12] 夏康,李家兵,吴建伟,等.丹红注射液对大鼠移植肾缺血再灌注损伤后ICAM-1表达的影响[J].重庆医科大学学报,2010,35(2):199-202.
[13] Kiyohara H,Ishizaki Y,Suzuki Y,et al.Radiation-induced ICAM-1expression via TGF-β1pathway onhuman umbilical vein endothelial cells;comparison between X-ray and carbon-ion beam irradiation[J].J Radiat Res,2011,52(3):287-292.
[14] Hsu J,Serrano D,Bhowmick T,et al.Enhanced endothelial delivery and biochemical effects ofα-galactosidase by ICAM-1-targeted nanocarriers for Fabry disease[J].J Control Release,2011,149(3):323-331.
[15] Won JH,Jung JK,Weon Cho C,et al.Antiallergic effect of KOB03,apolyherbal medicine,on mast cell-mediated allergic responses in ovalbumin-induced allergic rhinitis mouse and human mast cells[J].J Ethnopharmacol,2012,142(3):684-693.
[17] Perelman M,Fisher AN,Smith A.et al.Impact of allergic rhinitis and its treatment on the pharmacokinetics of nasally administered fentanyl[J].Int J Clin Pharmacol Ther,2013,51(5):349-356.
[18] Kim KY,Nam SY,Shin TY,et al.Bamboo salt reduces allergic responses by modulating the caspase-1activation in an OVA-induced allergic rhinitis mouse model[J].Food Chem Toxicol,2012,50(10):3480-3488.
[19] Zhang FY,Krafft T,Ye BX,et al.The lag effects and seasonal differences of air pollutants on allergic rhinitis in Beijing[J].Science of the Total Environment,2013,442:172-176.
[20] Anolik R.Desloratadine and pseudoephedrine combination therapy as a comprehensive treatment for allergic rhinitis and nasal congestion[J].Expert Opin Drug Metab Toxicol,2009,5(6):683-694.
