胡芦巴碱对缺氧/复氧乳鼠心肌细胞的保护作用*
2015-03-04王丹萍
韩 坤,王丹萍,袁 磊△
(1.漯河医学高等专科学校分子生物实验室,河南漯河462000;2.河南省漯河市中心医院内分泌科 462000)
胡芦巴碱(trigonelline,TRG)是一种生物碱,最早是从豆科植物葫芦巴的干燥种子中提取出来的,故而得名,此后发现TRG 还广泛存在于各种豆科植物的种子和咖啡中[1]。同时,TRG 还是人体内烟酸和色氨酸的代谢产物[2]。TRG具多种生物学作用,如降低血糖血脂[3-4]、抑癌[5]、抗氧化[6]、改善记忆[7]和抗感染[8]等。最近的一项研究表明,TRG 具有心肌保护作用[9]。本研究通过建立乳鼠心肌细胞缺氧/复氧模型,观察胡芦巴碱对缺氧/复氧心肌细胞的凋亡、超氧化物歧化物(SOD)和丙二醛(MDA)水平、线粒体膜电位以及caspase-9和caspase-3活性的影响,以探究TRG 对缺氧/复氧心肌细胞的保护作用及其机制,为治疗心肌缺血再灌注损伤提供新思路。
1 材料与方法
1.1 材料 出生72h内的SD 乳鼠购自郑州大学实验动物中心,高糖DMEM 和胎牛血清(Hyclone公司),TRG、典化丙啶(PI)、Rhodamine123、procaspase-9 抗体、cleaved caspase-9、procaspase-3抗体和cleaved caspase-3抗体(Sigma公司),总SOD(TSOD)试剂盒和MDA试剂盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 乳鼠心肌细胞原代培养 将出生3d 以内的SD 乳鼠心室肌剪碎,用0.125%胰蛋白酶进行消化,采用差速贴壁法纯化心肌细胞,用含20% 胎牛血清的DMEM 培养基,于37℃、5% CO2孵箱中培养,每隔48小时更换一次细胞培养液,待细胞融合度达80%以上时进行实验。
1.2.2 制备缺氧/复氧心肌细胞损伤模型 将培养的心肌细胞换用预先经95%N2和5%CO2混合气体饱和1h 的缺氧液,于95% N2、5%CO2的密闭容器中培养2h,再换用预先经95% O2和5%CO2混合气体饱和1h的复氧液,于95%O2、5%CO2的密闭容器中培养4h,建立心肌细胞缺氧/复氧损伤模型[8-9]。
1.2.3 实验分组 正常对照(Control组):更换正常培养基后于37 ℃、5%CO2孵箱中培养6h;缺氧/复氧组(H/R 组):更换缺氧液缺氧培养2h,再更换复氧液复氧培养4h;TRG 加缺氧/复氧组(TRG+H/R 组):更换含TRG(100nmol/mL)的缺氧液缺氧培养2h,再更换含TRG(100nmol/mL)的复氧液复氧培养4h。
1.2.4 流式细胞术检测细胞凋亡 制备各实验组细胞悬液,用PBS洗涤细胞2次,然后用70% 冰乙醇于4 ℃固定24h,再用PBS洗2次,加入1mL PI染液,4℃避光染色30min,送流式细胞仪检测。
1.2.5 SOD 与MDA 检 测 SOD 的 测 定 采 用 黄 嘌 呤 氧 化 酶法,MDA 的测定采用硫代巴比妥酸法,按照试剂盒说明书测定。
1.2.6 流式细胞术检测线粒体膜电位 制备细胞悬液,用PBS缓冲液漂洗2次,将Rhodamine123加入到细胞悬液(终浓度为5μg/mL),37 ℃孵育箱中放置30min,再用PBS缓冲液漂洗2次,送流式细胞仪检测。
1.2.7 Western blot检测蛋白水平 裂解各组细胞提取总蛋白,BCA 法测定蛋白浓度,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳并转移至聚偏氟乙烯(PVDF)膜,用封闭液(5%BSA/TBST)封闭1h,加入一抗(1∶1 000稀释)4℃孵育过夜,TBST 洗膜3次,加入二抗(1∶1 000稀释)室温下孵育1h,TBST 洗膜3次,加入ECL 进行发光反应,暗室X胶片显影,胶片用凝胶成像系统携带的白色光源拍照,β-actin蛋白条带为内参照。
1.3 统计学处理 采用SPSS16.0软件分析数据,计量资料以±s表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用LSD 法,以P<0.05为差异有统计学意义。
2 结 果
2.1 TRG 对缺氧/复氧心肌细胞凋亡的影响 流式细胞术结果显示,Control组、H/R 组和TRG+H/R 组的细胞凋亡率分别为(5.2±0.9)%、(38.7±4.3)%和(24.1±3.6)%,H/R 组较Control组明显升高(P<0.05),TRG+H/R 组较H/R 组明显降低(P<0.05)。见图1。
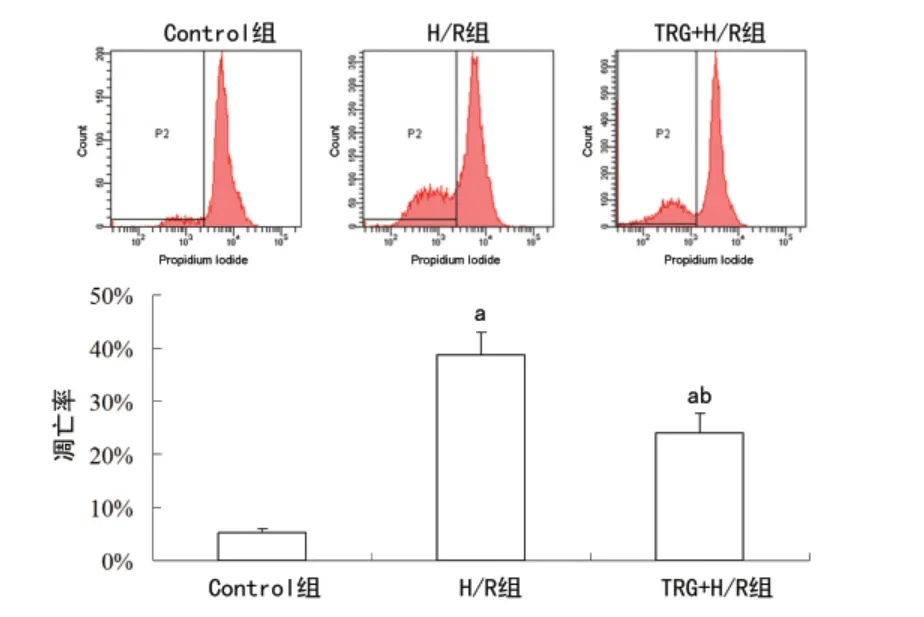
图1 TRG 对缺氧/复氧心肌细胞凋亡的影响
2.2 TRG 对缺氧/复氧心肌细胞SOD 活性和MDA 水平的影响 与Control组比较,H/R 组SOD 活性降低、MDA 水平升高(P<0.05),说明H/R 组细胞抗氧化能力降低。与H/R 组比较,TRG+H/R 组SOD 活性增强、MDA 水平降低(P<0.05)。见表1。
2.3 TRG 对缺氧/复氧心肌细胞线粒体膜电位的影响 应用流式细胞仪检测各实验组样本的荧光强度,用平均荧光强度值(mean fluorescence intensity,MFI)代表线粒体膜电位的水平。结果显示,H/R 组MFI 3 789±221较Control组5 481±319大幅下降(P<0.05),表明缺氧/复氧刺激使线粒体膜电位发生了显著的去极化;TRG+H/R 组MFI 4 36±257较H/R 组明显升高(P<0.05),说明TRG 能够稳定线粒体膜电位。见图2。
表1 各组SOD 活性和MDA 含量比较(±s)

表1 各组SOD 活性和MDA 含量比较(±s)
a:P<0.05,与Control组比较;b:P<0.05,与H/R 组比较。
组别 SOD(U/mgprot) MDA(nmol/mgprot)Control组115.81±10.63 3.13±0.46 H/R 组 54.24±8.71a 9.58±1.02a TRG+H/R 组 81.66±9.38b 7.23±0.65 b

图2 TRG 对缺氧/复氧心肌细胞线粒体膜电位的影响
2.4 TRG 对caspase-9 和caspase-3 活性的影响 Western blot结果显示,H/R 组procaspase-9(p47)和procaspase-3(p32)较Control组明显减少(P<0.05),但cleaved caspase-9(p35)和cleaved caspase-3(p17)显著增多,这表明缺氧/复氧刺激使caspase-9和caspase-3活化。TRG+H/R 组procaspase-9(p47)和procaspase-3(p32)较H/R 组明显增多(P<0.05),cleaved caspase-9(p35)和cleaved caspase-3(p17)显著减少(P<0.05),表明TRG 可抑制缺氧/复氧诱导的caspase-9 和caspase-3的活化。见图3。
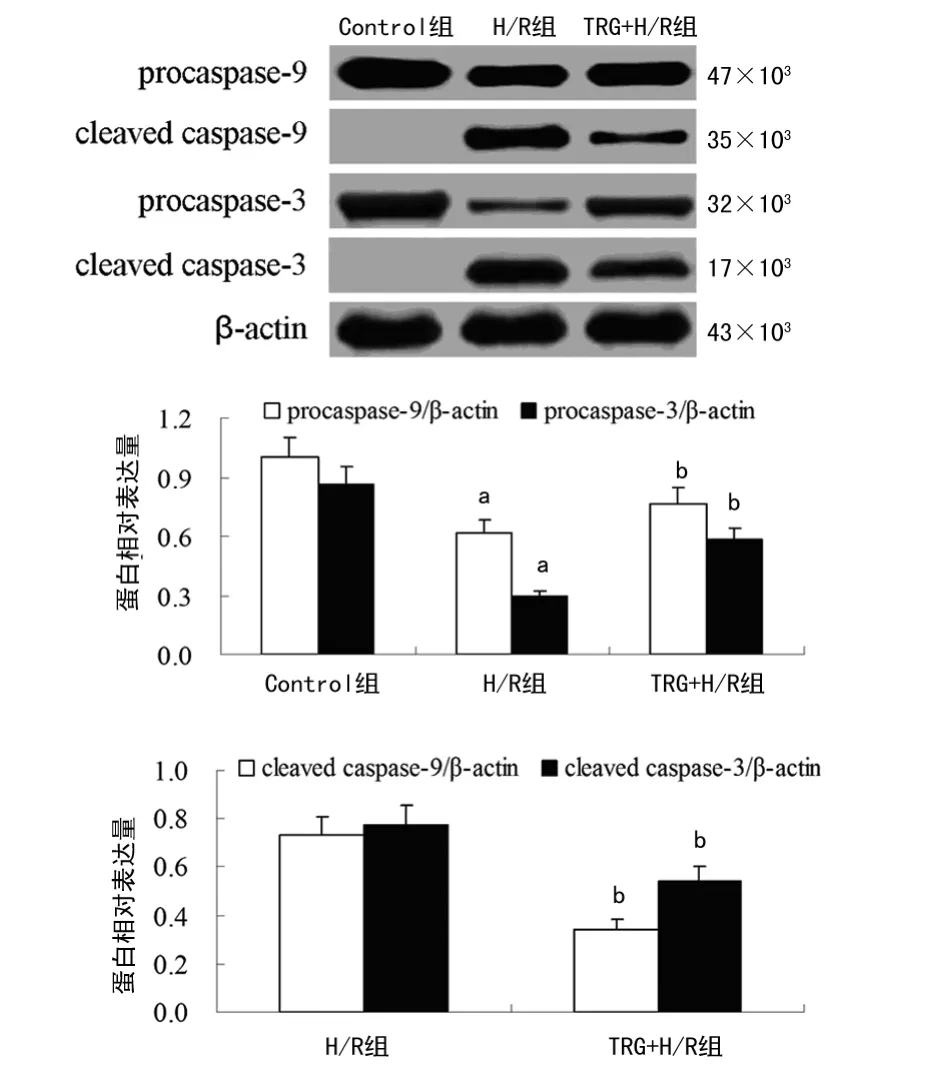
图3 TRG 对caspase-9和caspase-3活性的影响
3 讨 论
细胞凋亡在缺血/再灌注损伤过程中发挥重要作用[10]。心肌缺血/再灌注所导致的心肌细胞凋亡与细胞内能量代谢紊乱、线粒体渗透性转换孔的开放、钙超载、氧自由基的产生与清除失衡等均有关[11-14]。
在本研究中,乳鼠心肌细胞经缺氧/复氧后,与Control比较,H/R 组心肌细胞凋亡率明显升高,说明缺氧/复氧心肌细胞损伤模型建立成功。与H/R 组比较,TRG+H/R 组心肌细胞凋亡率明显降低,说明TRG 对缺氧/复氧损伤的心肌细胞具有一定的保护作用。
参与心肌缺血再灌注损伤的自由基主要有羟自由基、过氧化氢和超氧阴离子等。心肌缺血再灌注时,自由基清除系统功能下降,从而产生大量的自由基。自由基可广泛攻击含不饱和脂肪酸的生物膜结构,引起脂质过氧化,破坏膜结构和功能并产生大量MDA。SOD 是人体最重要的自由基清除剂,当自由基大量增多时SOD 消耗增加,SOD 活性就会下降[15]。因此有效阻止氧自由基产生并增强清除氧自由基的能力成为治疗心肌缺血再灌注损伤的重要措施之一。
本研究结果显示,与Control组比较,H/R 组心肌细胞内MDA 水平显著升高,同时SOD 活性显著下降,表明缺氧/复氧过程使得脂质过氧化反应强烈,细胞损伤严重,而TRG 可能通过增强心肌细胞对氧自由基的清除能力,减轻细胞膜脂质过氧化损伤,从而发挥对心肌细胞的保护作用。
缺血再灌注时所产生的钙超载和氧自由基可促进线粒体通透性转换孔大量开放,导致线粒体膜电位去极化,线粒体高度肿胀,外膜破裂,线粒体膜间隙中的细胞色素C(Cyt C)和凋亡诱导因子(AIF)等凋亡因子被释放到细胞质中,继而激活caspase-9和caspase-3,最终导致细胞凋亡[16]。线粒体膜电位去极化是线粒体功能逐渐丧失的关键阶段。
本研究结果显示,与Control组比较,H/R 组心肌细胞线粒体膜电位发生了显著的去极化,procaspase-9和procaspase-明显减少,但cleaved caspase-9和cleaved caspase-3显著增多,这表明缺氧/复氧过程使得线粒体通透性转换孔大量开放,caspase-9和caspase-3被激活。与H/R 组比较,TRG+H/R组心肌细胞线粒体膜电位水平显著升高,cleaved caspase-9和cleaved caspase-3显著减少,这表明TRG 对线粒体膜电位水平起到了稳定作用,抑制了caspase-9和caspase-3的活化,这可能与其抗氧化能力有关,但其对心肌细胞钙超载是否起到抑制作用尚待进一步阐明。
[1] Zhou J,Chan L,Zhou S.Trigonelline:aplant alkaloid with therapeutic potential for diabetes and central nervous system disease[J].Curr Med Chem,2012,19(21):3523-3531.
[2] Mason JB,Kodicek E.The metabolism of niacytin in the rat.Studies of the excretion of nicotinic acid metabolites[J].Biochem J,1970,120(3):509-513.
[3] Yoshinari O,Igarashi K.Anti-diabetic effect of trigonelline and nicotinic acid,on KK-A(y)mice[J].Curr Med Chem,2010,17(20):2196-2202.
[4] Hamden K,Bengara A,Amri Z,et al.Experimental diabetes treated with trigonelline:effect on key enzymes related to diabetes and hypertension,beta-cell and liver function[J].Mol Cell Biochem,2013,381(1/2):85-94.
[5] Arlt A,Sebens S,Krebs S,et al.Inhibition of the Nrf2 transcription factor by the alkaloid trigonelline renders pancreatic cancer cells more susceptible to apoptosis through decreased proteasomal gene expression and proteasome activity[J].Oncogene,2013,32(40):4825-4835.
[6] Yoshinari O,Takenake A,Igarashi K.Trigonelline ameliorates oxidative stress in type 2diabetic Goto-Kakizaki rats[J].J Med Food,2013,16(1):34-41.
[7] Tohda C,Kuboyama T,Komatsu K.Search for natural products related to regeneration of the neuronal network[J].Neurosignals,2005,14(1/2):34-45.
[8] Ozcelik B,Kartal M,Orhan I.Cytotoxicity,antiviral and antimicrobial activities of alkaloids,flavonoids,and phenolic acids[J].Pharm Biol,2011,49(4):396-402.
[9] Panda S,Biswas S,Kar A.Trigonelline isolated from fenugreek seed protects against isoproterenol-induced myocardial injury through down-regulation of Hsp27andαBcrystallin[J].Nutrition,2013,29(11/12):1395-1403.
[10] Hüttemann M,Helling S,Sanderson TH,et al.Regulation of mitochondrial respiration and apoptosis through cell signaling:cytochrome coxidase and cytochrome cinischemia/reperfusion injury and inflammation[J].Biochim Biophys Acta,2012,1817(4):598-609.
[11] Bonney S,Kominsky D,Brodsky K,et al.Cardiac per2 functions as novel Link between fatty acid metabolism and myocardial inflammation during ischemia and reperfusion injury of the heart[J].PLoS One,2013,8(8):e71493.
[12] Perrelli MG,Pagliaro P,Penna C.Ischemia/reperfusion injury and cardioprotective mechanisms:Role of mitochondria and reactive Oxygen species[J].World J Cardiol,2011,3(6):186-200.
[13] Ngoh GA,Watson LJ,Facundo HT,et al.Augmented OGlcNAc signaling attenuates oxidative stress and Calcium overload in cardiomyocytes[J].Amino Acids,2011,40(3):895-911.
[14] Petrosillo G,Di Venosa N,Moro N,et al.In vivo hyperoxic preconditioning protects against rat-heart ischemia/reperfusion injury by inhibiting mitochondrial permeability transition pore opening and cytochrome crelease[J].Free Radic Biol Med,2011,50(3):477-483.
[15] Zhang S,He B,Ge JB,et al.Characterization of chemical composition of Agaricus brasiliensis polysaccharides and its effect on myocardial SOD activity,MDA and caspase-3 level in ischemia-reperfusion rats[J].Int J Biol Macromol,2010,46(3):363-366.
[16] Ong SB,Subrayan S,Lim SY,et al.Inhibiting mitochondrial fission protects the heart against ischemia/reperfusion injury[J].Circulation,2010,121(18):2012-2022.
