缺血后处理对大鼠肾缺血/再灌注损伤及p38MAPK活性的影响
2015-03-04王雪岩姜秀良梁立升李爱芝马宏仲马加海
李 涛,王雪岩,姜秀良,梁立升,李爱芝,马宏仲,马加海※
(1.青岛大学医学院附属烟台毓璜顶医院麻醉科,山东 烟台264000; 2.烟台市疾病预防控制中心,山东 烟台264000)
缺血后处理对大鼠肾缺血/再灌注损伤及p38MAPK活性的影响
李涛1△,王雪岩2,姜秀良1,梁立升1,李爱芝1,马宏仲1,马加海1※
(1.青岛大学医学院附属烟台毓璜顶医院麻醉科,山东 烟台264000; 2.烟台市疾病预防控制中心,山东 烟台264000)
摘要:目的研究缺血后处理(IPO)对大鼠肾缺血/再灌注损伤(IRI)及p38丝裂原活化蛋白激酶(p38MAPK)活性的影响。方法将24只SD大鼠依据随机数字表法分为3组,各8只。对照(S)组:仅结扎右侧肾蒂,左肾蒂游离;缺血/再灌注(IR)组:结扎右侧肾蒂,夹闭左侧肾蒂60 min后,开放灌注24 h;IPO组:肾脏缺血60 min后,进行10 s灌注、10 s阻断,共6个循环的IPO,然后开放灌注24 h,余同IR组。检测血尿素氮(BUN)、肌酐,酶联免疫吸附试验法检测肾组织肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)水平,Western blot法检测肾组织磷酸化p38MAPK蛋白表达,观察肾组织的病理学变化。结果与S组比较,IR组和IPO组血BUN、肌酐,肾TNF-α、IL-1、p38MAPK蛋白表达量及组织病理评分显著增加(P<0.05);IPO组各指标较IR组显著下降(P<0.05)。结论IPO能减轻肾IRI,其机制与抑制p38MAPK活化,进而抑制炎性因子释放有关。
关键词:缺血/再灌注损伤;肾脏;缺血后处理;p38丝裂原活化蛋白激酶
肾脏缺血/再灌注损伤(ischemia-reperfusion injury,IRI)是引起急性肾衰竭的重要原因之一,缺血后处理(ischemic postconditioning,IPO)是一种新的减轻器官IRI的方法,可操作性强,对心、脑等器官IRI有确切的保护作用[1-2],但对肾脏IRI的研究结果不一,机制尚不明确。p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)是MAPK的一个亚类。研究发现,肾脏IRI后p38MAPK活化,进而调节肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1(interleukin 1,IL-1)等炎性细胞因子释放增加,导致肾脏损伤[3]。本研究拟探讨IPO对大鼠肾脏IRI及p38MAPK活性的影响。
1材料与方法
1.1材料选择清洁级健康8~ 10周SD雄性大鼠(购自烟台绿叶实验动物中心)24只,体质量210~240 g,动物许可证号SYXY(鲁)20030020。所有动物实验前12 h禁食,自由饮水。依据随机数字表法分为3组:对照(S)组、缺血/再灌注(IR)组、IPO组,每组8只。
1.2方法以戊巴比妥钠30 mg/kg腹腔注射麻醉,将所有大鼠麻醉后固定于操作台上。S组:尾静脉输注生理盐水,腹部正中切口进入腹腔,小心分离出双侧肾蒂,仅结扎右侧肾蒂,左肾蒂游离。IR组:结扎右侧肾蒂,用无损伤微动脉夹夹闭左侧肾蒂60 min后,松开动脉夹后充分开放灌注24 h,肾脏由暗红色恢复鲜红色即可确认血流恢复。IPO组:肾脏缺血60 min后,进行开放灌注10 s、阻断10 s 共6个循环的IPO,然后充分开放灌注24 h。
1.3标本留取再灌注24 h后,从下腔静脉抽取静脉血2~4 mL置于抗凝管内,静置4 h后分离血清,-70 ℃保存待用。分离左侧肾脏,滤纸吸干表面水分,将肾脏纵剖后取肾皮质100~200 mg,精确称重后用剪刀剪碎移入匀浆管内按溶质质量/溶液体积=1/9的比例加入4 ℃生理盐水,在冰浴中进行匀浆,制备成100 mg/L的肾组织匀浆液,以4 ℃低温离心机离心后取上清液于液氮速冻后置于-70 ℃冰箱中保存待用。同时摘取部分左肾组织置于4%多聚甲醛固定。
1.4检测指标采用全自动生化分析仪(Siemens-ADVIA2400)常规生化分析法测定血尿素氮(blood urea nitrogen,BUN)和肌酐,采用酶联免疫吸附试验法检测肾组织匀浆(上清)TNF-α、IL-1水平。Western blot法检测肾组织磷酸化p38MAPK蛋白表达。通过AlphaEase FC软件分析蛋白相对表达量,以β肌动蛋白为内参照,胶片扫描并照相,测定各条带A值。以目的蛋白和β肌动蛋白条带A值之比反映p38MAPK蛋白表达程度。左肾组织常规石蜡包埋,常规制片苏木精-伊红染色,光学显微镜观察病理变化,按照Jablonski等[4]描述的病理分级法将组织损伤程度分为0~4级。0级:正常;1级:单个细胞的坏死伴核分裂;2级:相邻近曲小管所有细胞坏死,但周围小管存活;3级:限定于近曲小管远端1/3细胞的坏死并扩展到皮质和髓质交界处;4级:近曲小管整段坏死。

2结果
2.1各组大鼠血清BUN、肌酐和肾组织TNF-α、IL-1水平的变化与S组比较,IR组和IPO组血BUN和肌酐水平显著增加(P<0.05);与IR组比较,IPO组血BUN和肌酐水平显著下降(P<0.05)。 与S组比较,IR组和IPO组肾组织TNF-α、IL-1水平显著升高(P<0.05);与IR组比较,IPO组TNF-α、IL-1水平显著下降(P<0.05)。见表1。
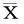
表1 各组大鼠血清BUN、肌酐和肾组织
BUN:血尿素氮; TNF-α:肿瘤坏死因子α;IL-1:白细胞介素1;S组:对照组;IR组:缺血/再灌注组;IPO组:缺血后处理组;a与S组比较,P<0.05;b与IR组比较,P<0.05
2.2肾组织磷酸化p38MAPK蛋白表达及病理分级IR组和IPO组p38MAPK蛋白相对表达量显著高于S组(P<0.05),IPO组p38MAPK蛋白相对表达量显著低于IR组(P<0.05)。与S组比较,IR组和IPO组肾组织病理分级升高(P<0.05);与IR组比较,IPO组病理分级下降(P<0.05)。见表2。
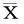
表2 各组大鼠肾组织磷酸化p38MAPK
p38MAPK:p38丝裂原活化蛋白激酶;S组:对照组;IR组:缺血/再灌注组;IPO组:缺血后处理组;a与S组比较,P<0.05;b与IR组比较,P<0.05
2.3肾组织病理学改变光镜下S组肾小球、肾小管结构正常(图1A);IR组见明显肾组织病理学损伤,主要表现为肾小管上皮细胞脱落、基膜断裂和肾小管阻塞,间质有水肿、充血及炎性细胞浸润(图1B);IPO组肾脏组织学改变轻微,仅见少数肾小管上皮细胞空泡变性、部分管腔扩张、淋巴细胞浸润(图1C)。

图1 各组SD大鼠肾脏缺血/再灌注后处理的光镜下形态学改变(HE染色,×100) A:对照组;B:缺血/再灌注组;C:缺血后处理组
3讨论
本研究采用先结扎右侧肾蒂,夹闭左侧肾蒂60 min再灌注24 h制备肾脏缺血再灌注损伤模型,避免对侧肾的代偿作用。BUN、肌酐能密切反映肾细胞的受损情况,本研究中IR组肌酐、BUN水平明显升高,肾组织损伤严重,说明成功建立肾IRI模型。
急性缺血是急性肾衰竭的最常见原因,再灌注加重肾损伤,如何有效地减轻肾脏IRI是目前研究的热点。IPO能否发挥保护作用,最关键的影响因素有两个:循环次数和短暂复灌/缺血的持续时间。有学者研究了不同IPO方案抗大鼠肾IRI的作用,认为6个循环10 s灌注/10 s阻断的方案最佳[5]。因此本研究采用了此方案。结果表明,IPO组血清BUN和肌酐水平较IR组显著降低,组织损伤亦减轻,说明IPO保护了肾脏的组织结构与功能。肾脏IRI机制十分复杂,近年来白细胞聚集及急性期反应的一些细胞炎性因子的作用日益受到重视,已证实肾缺血时,肾组织局部可产生多种炎性介质,其中包括TNF-α、IL-1、IL-6等[6]。本研究结果显示,IRI后肾组织TNF-α、IL-1水平也明显增加,提示IRI后炎性因子释放可能是导致肾脏组织结构与功能损伤的重要原因。
研究认为,IPO的作用机制主要包括:氧自由基的生成减少,腺苷、一氧化氮等内源性活性物质的释放及ATP敏感性钾通道等[7-8]。p38MAPK信号通路是近年来发现的广泛存在于各种动物细胞中的一条信号转导通路,p38MAPK产生于胞质,可被多种胞外刺激激活,激活后移位入核而发挥作用[9]。有研究证明,p38MAPK信号通路参与IRI等多种因素所致炎症反应调控,缺血/再灌注期间,p38MAPK活化,单核巨噬细胞、中性粒细胞等被激活后释放TNF-α、IL-1、IL-6等炎性细胞因子,后者通过多种途径参与细胞的损伤,而阻断p38 MAPK信号通路能减轻肾脏IRI[10]。本研究结果显示,肾IRI后磷酸化p38MAPK蛋白的表达水平升高,而IPO组表达水平降低,提示IPO能抑制大鼠肾脏IRI后p38MAPK的活化,减少TNF-α、IL-1等炎性因子的释放,降低炎症反应程度,从而保护肾脏的组织结构与功能。
综上所述,IPO能减轻肾脏IRI,其机制与抑制肾脏IRI后p38MAPK活化,从而抑制炎症反应有关。
参考文献
[1]Wang W,Tang T,Zhang P,etal.Postconditioning attenuates renal ischemia-reperfusion injury by preventing DAF down-regulation[J].J Urol,2010,183(6):2424-2431.
[2]Kin H,Zhao ZQ,Sun HY,etal.Postconditioning attenuates myocardial ischemia reperfusion injury by inhibiting events in the early minutes of reperfusion[J].Cardiovasc Res,2004,62(1):74-85.
[3]Park KM,Chen A,Bonventre JV.Prevention of kidney ischemia/reperfusion-induced functional injury and JNK,p38,and MAPK kinase activation by remote ischemic pretreatment[J].J Biol Chem,2001,276(15):11870-11876.
[4]Jablonski P,Howden BO,Rae DA,etal.An experimental model for assessment of renal recovery from warm ischemia[J].Transplantation,1983,35(3):198-204.
[5]云宇,段为钢,陈鹏,等.不同缺血后处理方案抗大鼠肾缺血-再灌注损伤的作用[J].昆明医学院学报,2009,30(4):31-35.
[6]Daemen MA,de Vries B,Buurman WA.Apoptosis and inflammation in renal reperfusion injury[J].Transplantation,2002,73(11):1693-1700.
[7]Zhao ZQ,Corvera JS,Halkos ME,etal.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-588.
[8]Selzner N,Boehnert M,Selzner M.Preconditioning, postconditioning,and remote conditioning in solid organ transplantation:basic mechanisms and translational applications[J].Transplant Rev, 2012,26(2):115-124.
[9]Cuschieri J,Maier RV.Mitogen-activated protein kinase(MAPK)[J].Crit Care Med,2005,33(12):417-441.
[10]Li R,Ding T,Liu X,etal.Influence of SB203580 on cell apoptosis and P38MAPK in renal ischemia/reperfusion injury[J].J Huazhong Univ Sci Technology Med Sci,2006,26(1):50-52.
关于作者署名的相关事项
1.署名的意义:①标明论文的责任人,文责自负。②医学论文是医学科技成果的总结和记录,是作者用智慧辛勤劳动的成果,是应得的荣誉,也是论文版权归署作者的一个声明。③便于编辑、读者与作者的联系、沟通,互相探讨,共同提高。作者姓名在文题下按序排列,排序应在投稿时确定,在编排过程中不应再做更改;作者单位名称要写全称(到科室)、所在城市及邮政编码,位于作者署名下方;多位作者不同单位时要于姓名右上角标明与单位排序相同的号码。
2.作者署名应具备下列条件:①参与选题和设计,或参与资料的分析和解释者。②起草或修改论文中关键性理论或其他主要内容者。③能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。仅参与获得资金或收集资料者不宜列为作者,对该研究有贡献者应列入志谢部分。在每篇文章的作者中需要确定一位能对该论文全面负责的通讯作者,而且在投稿时确定,如在来稿中未特殊标明,则视第一作者为通讯作者,并于姓名右上角标注※。作者中如有外籍作者,应附本人亲笔签名同意在本刊发表的函件。集体署名的论文于文题下列署名单位,于文末列出整理者姓名,并注明通讯作者姓名、单位及邮政编码。
Effects of Ischemic Postconditioning on Ischemia Reperfusion Injury and Expression of p38MAPK Protein in Rat KidneyLITao1,WANGXue-yan2,JIANGXiu-liang1,LIANGLi-sheng1,LIAi-zhi1,MAHong-zhong1,MAJia-hai1.(1.DepartmentofAnesthesiology,YantaiYuhuangdingHospital,QingdaoUniversityMedicalCollege,Yantai264000,China; 2.YantaiCenterforDiseaseControlandPrevention,Yantai264000,China)
Abstract:ObjectiveTo investigate the effects of ischemic postconditioning on ischemia reperfusion injury(IRI)and expression of p38 mitogen-activated protein kinase(p38MAPK) protein in rat kidney.MethodsA total of 24 SD rats were allocated randomly into 3 groups(n=8 per group).Sham (S) group:rats received continuous intravenous infusion of normal saline and clamping the right renal pedicles.IR group(IR):renal IRI was induced by clamping both renal pedicles 60 minutes followed by 24 h reperfusion.Ischemic postconditioning(IPO) group:ischemic postconditioning was given six cycles of 10 s reperfusion/10 s occlusion followed by 24 h reperfusion.Serum blood urea nitrogen(BUN), creatinine(Cr) was detected.ELISA was used to detect the tumor necrosis factor α (TNF-α),interleukin 1 (IL-1) in kidney.Western blot was applied to detect the expression of p38MAPK protein.Renal histopathology lesions were also examined.ResultsCompared with group S,the serum BUN and Cr,renal TNF-α and IL-1,expression of p38MAPK protein increased significantly in group IR and group IPO(P<0.05).Compared with group IR,all indexes in group IPO decreased significantly(P<0.05).ConclusionIPO can attenuate renal IRI in rats.The mechanism is related to inhibition of p38MAPK expression and inflammatory factor release.
Key words:Ischemia reperfusion injury; Kidney; Ischemic postconditioning; p38 mitogen-activated protein kinase
收稿日期:2013-07-01修回日期:2014-10-23编辑:伊姗
基金项目:烟台市科技发展计划项目(2009155-12)
doi:10.3969/j.issn.1006-2084.2015.11.048
中图分类号:R692.9
文献标识码:A
文章编号:1006-2084(2015)11-2049-03
