貂源绿脓杆菌流行株toxA基因克隆序列分析及原核表达
2015-03-04张传美秦晓冰杨海燕秦志华青岛农业大学动物科技学院山东青岛6609烟台市动物卫生监督所山东烟台64000
张传美,王 颖,秦晓冰,杨海燕,秦志华,单 虎(.青岛农业大学动物科技学院,山东青岛6609;.烟台市动物卫生监督所,山东烟台64000)
貂源绿脓杆菌流行株toxA基因克隆序列分析及原核表达
张传美1,王颖2,秦晓冰1,杨海燕1,秦志华1,单虎1
(1.青岛农业大学动物科技学院,山东青岛266109;2.烟台市动物卫生监督所,山东烟台264000)
摘要:为了研究貂源绿脓杆菌流行株toxA基因的遗传变异情况,并将toxA基因进行原核表达,本试验以貂源绿脓杆菌DNA为模板,经PCR扩增表达外毒素A蛋白的toxA基因,约1 917 bp的片段,将产物克隆与pMD-18T载体并测序。结果表明,12株流行株的序列与GenBank中的标准产毒株PA103株和PA01株的遗传关系较近,显示外毒素A毒性的氨基酸均未发生突变,流行株变异不大。将该基因亚克隆到原核表达载体pET32a,转化BL21(DE3)感受态细胞,经不同浓度的IPTG诱导表达,表达产物进行SDS-PAGE与Western Blot鉴定,结果表明,可产生相对分子量约为78 kDa的表达产物,成功地构建了外毒素A蛋白的重组表达系统。
关键词:绿脓杆菌;toxA基因;克隆;序列分析;原核表达
Corresponding author:SHAN Hu
绿脓杆菌(Pseudomonas aeruginosa)又称铜绿假单胞菌,属于假单胞菌科、假单胞菌属,是一种常见条件致病菌,可引起人及多种动物(如鸡、兔、羊、水貂等)发病。1972年,P v Liu在临床分离株的培养液中,发现了导致绿脓杆菌感染的毒性因子-外毒素A,并指出绿脓杆菌外毒素A(Pseudomonas ae⁃ruginosa exotoxin A,PEA)对皮肤黏膜有坏死作用,进入血液中能诱发败血症,是绿脓杆菌感染机体的最主要致病因子[1]。PEA由toxA基因编码,该基因由3个部分组成:Ⅰ区的Ⅰa(1-252AA)、Ⅰb(365-404AA)为识别部分,Ⅱ区(253 -364 AA)为“越膜转位”部分,Ⅲ区(4O5-613AA)为毒素分子的酶活性部分。toxA基因通过受体结合亚单位和跨膜亚单位将具有ADP-核糖基化活性的毒性单位导人细胞,催化细胞内的延长因子(EF-2)发生ADP-核糖基化反应,使EF-2灭活,抑制蛋白合成而杀死细胞[2-3]。
目前研究对动物源性绿脓杆菌外毒素A序列变异规律的系统报道较少,为了解山东地区貂源绿脓杆菌流行毒株的变异规律,本研究对本室分离鉴定得到的貂源绿脓杆菌toxA基因进行了克隆、测序及遗传变异分析,并将该基因进行原核表达,为研究该病的致病机理及开发新型的亚单位疫苗和诊断试剂奠定基础。
1 材料与方法
1.1材料试验用菌株分离自山东地区水貂养殖场,由本实验室分离鉴定并保存;宿主菌E.coli DH5α、BL21(DE3)株、载体pET32a(+)均由本室保存。pMD18-T载体克隆试剂盒、ExTaq DNA聚合酶、EcorI、HindⅢ、ApaI限制性内切酶、UNIQ-10柱式DNA胶回收试剂盒等,均购自TaKaRa公司;X-gal、IPTG,购自Merk公司;PVDF膜,购自Milli⁃pore公司;6×His单克隆抗体(RGS),购自Novagen公司。
1.2toxA基因的扩增与克隆参照GenBank上的绿脓杆菌PA103参考株设计toxA基因引物,预期产物长度1 917 bp,并在引物两端加EcoRI和Hin⁃dIII酶切位点。以分离纯化的细菌培养液为模版,按常规方法进行PCR反应,PCR扩增条件:94℃5 min;94℃1 min,61℃1 min,72℃3 min,循环30次;72℃延伸20 min。1%琼脂糖凝胶电泳检测,凝胶成像观察分析。引物序列如下:P1:5′- GAATTCATGCACCTGACACCCCATTG- 3′,P2:5′-CAAGCTTCTTCAGGTCCTCGCGCGGCG-3′。
1.3连接、转化和鉴定使用DNA Fragment Puri⁃fication Kit胶纯化回收。按照Pmd18-T Vector操作说明,将回收鉴定后的DNA与pMD18-T载体进行连接,连接后产物转化E.coli DH5α感受态细胞,筛选阳性克隆。随机挑取白色单菌落,提取质粒DNA。对重组质粒进行PCR鉴定和酶切鉴定。
1.4toxA全基因的序列测定及分析将鉴定为阳性克隆的菌液送华大基因科技服务有限公司测序。利用DNAStar和DNAMAN软件对所测定的toxA基因全长的核苷酸序列及推导的氨基酸序列进行编辑及密码子分析,并与GenBank上已发表过已知产毒株PA103和不产毒株PA01参考毒株序列分别进行核苷酸序列比对分析,并绘制系统进化树。
1.5原核表达载体的构建和诱导表达以pMD18-T-toxA为模板,经EcoR I和Hind III双酶切后胶回收,获得具有黏性末端的基因片段。将回收的toxA基因片段与pET32a载体连接,连接产物转化DH5α感受态细胞,筛选阳性克隆做PCR鉴定和酶切鉴定,鉴定正确的阳性重组质粒命名为pET32a-toxA。阳性重组质粒转化BL21(DE3)感受态细胞,选取重组菌接种Amp+的LB培养基,37℃振摇培养至OD600值为0.6-1.0时,加入不同浓度IPTG(0.5、1.0、1.5、2.0 mmol/L)诱导表达6 h。收集1 mL菌液离心,重复3次,加入100 μL 2×SDS上样缓冲液,水浴煮3~5 min,未诱导菌液和诱导空载体菌pET32a(+)作相同处理后,进行SDS-PAGE。
1.6WesternBlot检测参照分子克隆试验指南进行电转印,WesternBlot检测,一抗为6×His的单克隆抗体,二抗为HRP标记羊抗鼠(酶标IgG二抗)。
2 结果
2.1目的片段的PCR扩增、克隆及鉴定从15株绿脓杆菌中有12株扩增出toxA基因片段,分别命名为PA1、PA2、PA3、PA4、PA5、PA6、PA7、PA8、PA9、PA10、PA11和PA12,琼脂糖凝胶电泳证明,扩增片段大小与预期相符,约为1 917 bp。将扩增出的片段用pMD-18T载体进行克隆,所得重组质粒分别进行PCR鉴定和EcoRⅠ、Hind III双酶切鉴定。阳性质粒扩增出预期大小的基因片段1 917 bp(见图1),双酶切后均呈现目的条带和载体两条带(见图2)。
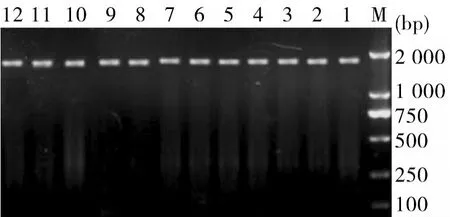
图1 重组质粒PCR鉴定结果
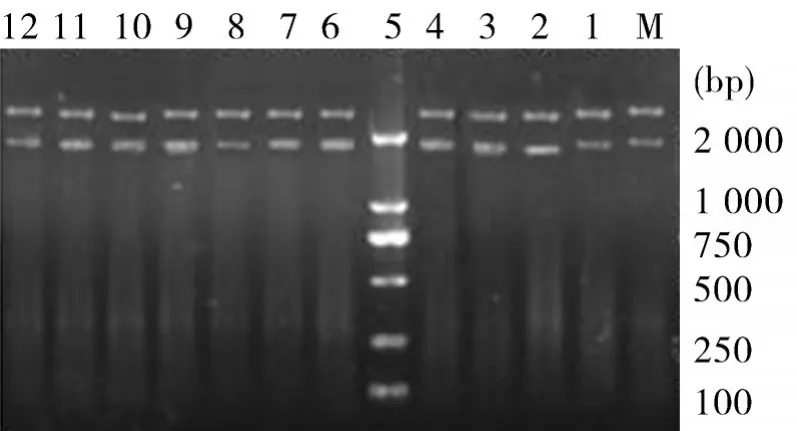
图2 重组质粒酶切鉴定结果
2.2toxA基因同源性分析及氨基酸序列比对12株山东水貂源绿脓杆菌流行株toxA基因与PA103参考株的核苷酸和氨基酸同源性分别为97.7%~99.1%和96.2%~97.2%,与PA01参考株的同源性分别为98.0%~99.5%和96.7%~97.9%,山东水貂源绿脓杆菌流行株之间核苷酸同源性为98.2%~100%,氨基酸同源性为97.3~99.8%。表明山东近期流行的绿脓杆菌毒株与参考株变异不大,且流行毒株之间同源性较高。与PA103为参考株比较发现,PA1至PA10株的37位Thr变为Pro,PA1至PA10株的179位Thr变为Ala,PA12 的313位Arg变为Gly,407位Val变为Ile,PA1至PA12株的364位Asn变为Ser,515位Gly变为Ser。与PA01株位参考株比较发现,PA1至PA10株的37位Thr变为Pro,PA12的313位Arg变为Gly,PA1至PA11株的407位Ile变为Val。
2.3toxA基因遗传进化分析利用DNAStar软件与12株流行株toxA基因序列进行比较,绘制toxA基因基因系统进化树。由图3可以看出,PA2、PA3、PA4、PA7、PA8、PA9、PA10、PA11与PA103、PA01遗传关系较近,PA11与PA01遗传关系最近,PA1、PA5、PA6与PA103、PA01遗传关系较远,PA12与PA103、PA01遗传关系相对较远。由此推断,目前山东水貂源绿脓杆菌流行株与PA11与PA01遗传关系较近,流行株变异不大。
2.4重组质粒pET32a -toxA的鉴定及原核表达以pET32a-toxA为模板扩增toxA基因,所获得的片段大小与预期1 917 bp相符。pET32a-toxA重组表达载体经EcoR I和Hind III双酶切后,在琼脂糖凝胶电泳中出现2条大小分别为约6 900 bp和1 917 bp的DNA片段,与预期产物大小相符。这表明toxA基因已正确插入pET32a载体EcoR I和Hind III酶切位点之间。

图3 山东12株绿脓杆菌toxA基因进化树
SDS-PAGE分析,在78 kDa处出现目的条带,与预期结果相符,表达产物在1.0 mmol/L时表达量较高(图4)。WesternBlot结果显示,转印的PVDF膜上出现与预期大小相同的条带,而对照组相应位置无此条带。这说明表达的蛋白为pET32a融合的toxA蛋白。
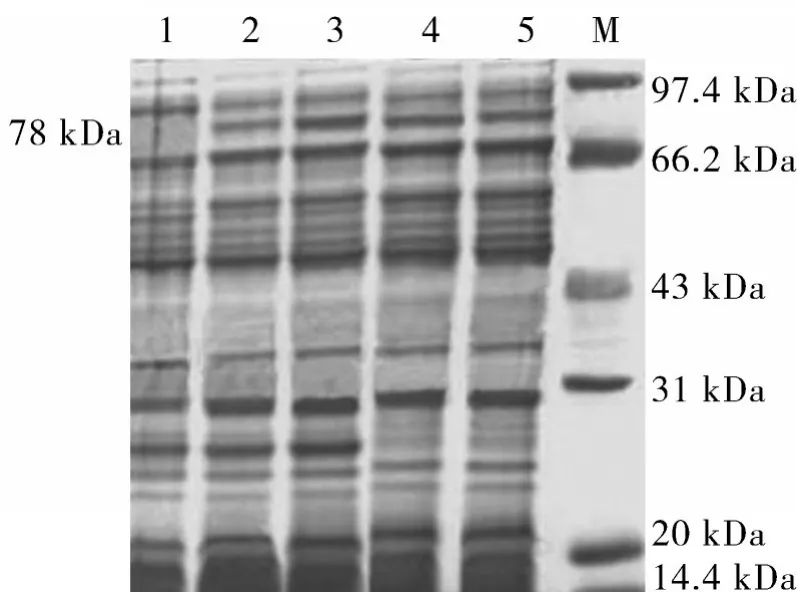
图4 不同诱导剂浓度的表达产物

图5 表达重组蛋白的Western Blot检测
3 讨论
近年来,山东地区水貂养殖规模不断扩大,以绿脓杆菌为主要病原菌引发的水貂出血性肺炎频繁暴发,且多呈继发感染、混合感染和群体急性暴发的趋势,不仅造成巨大经济损失,而且给临床治疗该病带来了更大的困难[4]。本试验通过对山东12株貂源绿脓杆菌toxA基因克隆与序列分析,研究了绿脓杆菌主要致病因子外毒素A的遗传变异情况。外毒素AIa区的定点诱变研究发现[5],当将第57位赖氨酸(Lys57)诱变为谷氨酸(Glu)时,突变的PE细胞毒性减低到1%,Ia区上其他Lys位点的突变对PE细胞毒作用无任何影响。可见,Lys57是Ia区的关键的氨基酸位点。除Lys57外,位于I区的His246,Arg247和His249三个碱性氨基酸也是维持PE生物学活性的重要位点。在突变型PEGlu246,247,249和PEGlu57,246,247,249,上述碱性氨基酸已由Gfu替换,使Ia区与Ⅱ区间连接的氢键受阻断,它们对动物显示低的细胞毒性。外毒素AⅡ区在毒素跨膜转位过程中起主导作用。当Ⅱ区缺失时,尽管其细胞结合能力和ADP-核糖基化活性尚存,但细胞毒性丧失。Arg276向Gly的点突变造成PE分子完全丧失细胞毒性,Arg279向Gly的点突变引起细胞毒作用减低到l/400。Wozniak等[6]通过对国际标准产毒株PAl03及不产毒株PA01的研究表明,第426位组氨酸对于外毒素的ADP-核糖基化作用是必须的。Douglas等及Carroll等[7-8]的研究表明,第553位谷氨酸及558位色氨酸对于外毒素AⅢ区的ADP-核糖基化作用是关键的。还有其他研究表明,第440位组氨酸,470,481位酪氨酸对酶活性及细胞毒性是重要的[9-10]。而12株水貂绿脓杆菌toxA基因测序结果表明,这些位点的氨基酸均未发生突变,可以推断该菌株细胞毒没有降低,具有ADP-核糖基化作用,但仍须做进一步研究。这些突变中,氨基酸的性质均有改变,这些改变是否对其毒性有影响,将有待进一步研究。
通过toxA基因的序列分析,表明山东地区近期绿脓杆菌流行毒株与参考株变异不大,且流行毒株之间同源性较高,流行毒株与PA103与PA01遗传关系较近。目前山东地区流行的水貂绿脓杆菌病的有关外毒素A毒性的氨基酸均未发生突变,可以推断菌株细胞毒没有降低,且流行株变异不大。绿脓杆菌外毒素A由toxA基因编码(其CDS全长为1 917 bp),分子量约为66 kDa,由613个氨基酸组成,其前体为638 aa,在分泌过程中切去了由25 aa组成的高度疏水的引导肽。正常情况下,toxA基因的表达受到多种调控基因的调节,如regA(toxR)、regB、lasR、ptxR、vfr(毒力因子调控基因)、pvds等正调控基因和fur(铁吸收调节基因)、ptxS等负调控基因。此外,培养温度、氧通气量、铁离子浓度及谷氨酸盐等环境因素亦影响其表达[11]。
绿脓杆菌基因组GC含量高达66%,从高GC含量的模板中用PCR方法扩增长片段DNA序列是件相当困难的事情[12]。为了能从高GC含量模板中进行有效的PCR扩增,本试验首先使用了Ex Taq酶,Ex Taq酶在普通PCR条件下,与普通Taq DNA Polymerase相比,具有扩增效率高、错配率低的优良性能。其次在PCR扩增体系中加入4.8%甘油和4%二甲基亚砜(DMSO)也是PCR扩增成功的关键所在,甘油的作用是提高PCR产物的产量,增加酶的稳定性;二甲基亚砜的作用是改善高GC含量的DNA变形情况,使聚合酶在二级结构处延伸。在构建原核融合表达载体时,选用了带T7 Lac原核启动子的pET32a(+)融合表达载体,该载体可高效表达外源蛋白,表达的融合蛋白的N端带有6个连续组氨酸融合标签,与其他纯化系统相比,其独特的优点是6个组氨酸尾空间构像小而且不带电荷,不会影响融合蛋白的分泌、重折叠、结构和功能以及目的蛋白的性能,最大限度保持其活性,也不会对动物机体产生任何副反应,因此不需要对融合蛋白进行切割处理,大大简化了操作步骤,降低了生产成本。本试验PEA的成功表达,为大量表达纯化该蛋白做了前期工作,更为进一步研究其性质和功能奠定了基础,为用于免疫导向治疗的重组毒素和人工疫苗的制备奠定了基础。
参考文献:
[1]夏海华,于冲,曲晓军,等.绿脓杆菌外毒素A的最新研究进展[J].生物技术,2012,22(2):81-85.
[2]郭学军,刘晓明,朱平,等.绿脓杆菌外毒素A受体结合亚单位基因的克隆与表达[J].中国兽医学报,1997,17(3):226-228.
[3] Daniel J,Wozniak,Lch-Yeh Hsu,et al.His-426 of the Pseudomonas aeruginosa exotaxin A is required for ADP-ribosylation of elongation factor II[A].Proc Natl Acad Sci USA,1998,85:8880-8884.
[4]程悦宁,易立,司方方,等.我国毛皮动物主要传染病防控现状及防控建议[J].经济动物学报,2013,17(1):49-54.
[5] Claude V.Gallant,Tracy L.Raivio,et al.Pseudomonas aeruginosa cysticfibrosis clinical isolates produce toxA with altered ADP-ribosyltransferase activity and cytotoxicity[J] . Microbiology,2002,146,1891-1899.
[6] Wozniak D J,Hsu L Y,Galloway D R.His-426 of the Pseudomo⁃nas aeruginosa exotoxin A is required for ADP- ribosylation of elongation factor II[J] .Proc Natl Acad Sci USA,1988,85(23):8880-8884.
[7] Douglas C M,Collier R J.ToxA of Pseudomonas aeruginosa:substi⁃ution of Glutamic Acid 553 with Aspartic Acid Drastically Reduc⁃es Toxicity and enzymatic activity[J] . J.Bacteriol,1987,169:4967-4971.
[8] Carroll S F,Collier R J . Active site of Pseudomonas aerugino⁃sa exotoxin A[J].J Biol Chem,1987,262(18):8707-8711.
[9] Brandhuber B J,Aliured V S,Falbel T G,et al.Mapping the en⁃zymatic active site of Pseudomonas aeruginosa exotaxin[J] .A pro⁃teins,1998,3:146-154.
[10] Wick M J,Iglewski B H.Determination of the amino acid change responsible for the nontoxic,cross-reactive toxA protein(CRM 66)of Pseudomonas aeruginosa PAO-PR1[J].J Bacterial,1988,179:5385-5388.
[11] Michael L Vasil.How we learnt about iron acquisit ion in P seu⁃domonas aeruginosa:a series of very fortunate events[J] . Biomet⁃als,2007,20:587-601.
[12]胡晓梅,饶贤才,黄建军,等.采用PCR技术从高GC含量绿脓杆菌模板中扩增长片段外毒素A全基因[J].第三军医大学学报,2003,25(9):833-834.
王颖(1986-),女,助理兽医师,硕士,主要从事预防兽医学研究,E-mail:wangying1986@163.com
注:王颖与张传美对本文具有同等贡献
Cloning,Sequenceanalysis and Prokaryotic expressionof the toxA Geneof Pseudomonasaeruginosafrom Minks
ZHANG Chuan-mei1,WANG Ying2,QIN Xiao-bing1,YANG Hai-yan1,QIN Zhi-hua1,SHAN Hu1
(1.College of Animal Science and Technology,Qingdao Agricultural University,Qingdao 266109,China;2.Yantai Animal Health Supervision Institute,Yantai 264000,China)
Abstract:To study the genetic variation of the toxA gene of P.aeruginosa from minks and its expression in E.coli.A 1917 bp fragment the toxA gene was amplified from the genomic DNA of P.aeruginosa from mink by PCR,and cloned into pMD18-T vec⁃tor.Sequencing analysis showed that 12 strains had close genetic relationship with PA103 and PA01 corresponding sequences pub⁃lished in the GenBank.Amino acids with toxicity of toxA gene are not mutated.The toxA gene was expressed into the prokaryotic ex⁃pression vector pET32a,and the constructed recombinant plasmid was transformed into E.coli BL21(DE3)competent cells . A 78KDa fusion protein was expressed after different concentration IPTG induction and confirmed by SDS-PAGE and Western blot analysis.The recombinant expression system containing the toxA protein of Pseudomonas aeruginosa has been established success⁃fully.
Key words:P.aeruginosa;toxA gene;clone;Sequence analysis;Prokaryotic expression
通讯作者:单虎,E-mail:shanhu67@163.com
作者简介:张传美(1978-),女,副教授,硕士,主要从事预防兽医学研究,E-mail:zhangchuanmei100@163.com
基金项目:青岛市科技计划基础研究项目[11-2-4-5-(3)-jch];科技基础性工作专项(SQ2012FY3260033);山东省优秀中青年科学家科研奖励基金项目(BS2011SW010)
收稿日期:2015-05-23
中图分类号:S852.61
文献标志码:A
文章编号:0529- 6005(2015)10- 0038- 04
