电针对缺血再灌注损伤大鼠缺血周围区皮质小胶质细胞活化的影响
2015-03-04王鲜黄佳柳维林上官豪郑薏王露露林云娇陶静陈立典
王鲜,黄佳,柳维林,上官豪,郑薏,王露露,林云娇,陶静,3,陈立典
电针对缺血再灌注损伤大鼠缺血周围区皮质小胶质细胞活化的影响
王鲜1,黄佳1,柳维林1,上官豪1,郑薏1,王露露1,林云娇1,陶静1,3,陈立典2
[摘要]目的探讨电针对缺血再灌注损伤大鼠缺血周围区皮质小胶质细胞活化的影响。方法36只雄性Sprague-Dawley大鼠随机分为假手术组(n=12)、模型组(n=12)和电针组(n=12)。模型组与电针组均采用改良Longa法制备左侧大脑中动脉闭塞模型,缺血2 h后恢复血供。电针组电针曲池、足三里穴治疗3 d。HE染色观察缺血周围区皮质神经细胞损伤情况;免疫组织化学法观察缺血周围区皮质小胶质细胞活化标记物ED1的表达;Westernblotting检测缺血周围区肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β 和IL-6的表达。结果与模型组相比,电针组大鼠神经功能缺损症状改善(P<0.05),缺血周围区皮质神经细胞损伤减轻,ED1阳性细胞数减少(P<0.05),TNF-α、IL-1β和IL-6的表达降低(P<0.05)。结论电针对大鼠脑缺血再灌注损伤具有保护作用,可能与抑制缺血周围区皮质小胶质细胞的活化及促炎因子的释放相关。
[关键词]脑缺血再灌注损伤;电针;小胶质细胞;炎症;大鼠
[本文著录格式]王鲜,黄佳,柳维林,等.电针对缺血再灌注损伤大鼠缺血周围区皮质小胶质细胞活化的影响[J].中国康复理论与实践, 2015, 21(11): 1251-1255.
CITED AS: Wang X, Huang J, Liu WL, et al. Effectsof electroacupunctureon activation of microgliain peri-infarct cortex of cerebral ischemia-reperfusioninjury rats[J]. Zhongguo Kangfu LilunYu Shijian, 2015, 21(11): 1251-1255.
脑卒中是导致死亡的第二大原因,占死亡人数的11%,我国每年新发脑卒中病例200万人次[1-2],而存活者中,约55%~75%留有肢体功能障碍[3]。大量临床及基础研究证明,电针疗法是治疗脑卒中行之有效的方法之一,但其具体作用机制尚未完全清楚。
炎症反应在缺血性脑损伤中起关键作用,而小胶质细胞作为中枢神经系统的免疫细胞,具有吞噬、抗原提呈、表达免疫相关因子及迁移的功能,在神经生理和病理进程中起关键作用[4]。当中枢神经系统发生损伤、卒中、变性以及肿瘤入侵等病变时,大量活化的小胶质细胞迁移到受损区域发挥免疫调节作用。缺血周围区一直是神经科学研究的热点[5]。研究表明,脑损伤诱导小胶质细胞活化并释放促炎细胞因子,如肿瘤坏死因子-α(tumor necrosisfactor-α, TNF-α)、白细胞介素(interleukin, IL)-1β和IL-6。促炎细胞因子有细胞毒性作用,并与炎症反应、坏死和凋亡相关,加重脑损伤[6-8]。
我们前期研究发现,电针曲池、足三里穴可抑制缺血再灌注损伤大鼠脑组织及血液中促炎因子的释放,从而减少脑梗死体积,发挥脑保护作用[9]。还有研究表明,针刺或电针预处理可以抑制脑缺血损伤大鼠海马区小胶质细胞的活化,抑制氧化应激[10-12]。本研究观察脑缺血再灌注损伤后缺血周围区皮质小胶质细胞的活化,探讨电针曲池、足三里穴治疗缺血性脑卒中的可能机制。
1 材料与方法
1.1实验动物及分组
成年健康雄性SPF级Sprague-Dawley大鼠36只,体质量(250±30) g,由上海斯莱克实验动物责任有限公司提供,生产许可证号:SCXK(沪)2014-0002。采用随机数字表法分为假手术组、模型组、电针组,每组12只。实验过程严格遵照国际动物保护和指南的规定。
1.2主要试剂和仪器
ED1一抗:AbD SEROTEC公司。TNF-α、IL-1β、IL-6、β-actin一抗,辣根过氧化物酶二抗:CELL SIGNALINGTECHNOLOGY公司。G6805型电针仪:上海华谊公司。Leiss LSM710光学显微镜:CARL ZEISS公司。Image-lab图像分析系统:BIORAD HERCULES公司。
1.3模型制备
动物术前禁食12 h。参考Longa方法[13],行左侧大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)术。10%水合氯醛3 ml/kg腹腔注射麻醉,仰卧固定,无菌操作。颈正中切口,暴露并钝性分离左侧颈总动脉、颈外动脉及颈内动脉,尼龙线依次结扎颈总动脉、颈外动脉,微动脉夹夹闭远端颈内动脉。颈总动脉上近分叉处约5mm处剪一“V”型小口,线栓经颈总动脉插入颈内动脉,当进入大脑中动脉稍遇阻力时,即可停止,进线长度约18~22 mm。结扎颈内动脉,伤口常规缝合。2h后拔出线栓实现再灌注。
假手术组只分离动脉,不结扎和插线。
术后,动物白炽灯照射取暖。手术过程维持肛温37℃左右。动物苏醒后观察其体态及行为,判断模型是否成功。
1.4干预方法
术后第2天,电针组大鼠参考《实验针灸学》[14]的定位方法,取曲池、足三里穴,使用华佗牌30号0.5寸毫针,斜刺右侧患肢穴位0.2~0.3 cm,接G6805电针仪,疏密波,频率1~20 Hz,以肢体轻度抖动为度。每次30min,每天1次,共3d。
假手术组及模型组以同样方法抓取固定,不进行电针刺激。
1.5神经行为学评分
各组大鼠在缺血再灌注后2 h及电针治疗3 d,由1名对研究不知情的观察者按Longa评分[13],对大鼠的神经功能缺损程度进行评估。0分,无神经功能缺损体征;1分,不能伸展对侧前爪;2分,向偏瘫侧转圈;3分,行走时向偏瘫侧倾倒;4分,不能自发行走,意识丧失。
1.6检测方法
1.6.1 HE染色
干预结束后,大鼠10%水合氯醛3ml/kg腹腔注射麻醉,生理盐水200 ml经左心室快速冲洗,4%多聚甲醛(pH=7.4) 250 ml灌流固定。取脑置4%多聚甲醛内,4℃固定24~48 h。常规脱水,石蜡包埋,冠状切片,片厚5µm。常规梯度脱蜡入水,HE染色,于显微镜下观察大鼠脑左侧缺血周围区皮质组织形态。
1.6.2免疫组织化学染色
脑组织石蜡切片常规脱蜡入水,置柠檬酸缓冲液中(pH=6.0),微波修复10 min,3% H2O2室温孵育5 min;PBS漂洗3次;10%正常山羊血清封闭,室温孵育30 min;加入ED1一抗(1∶150),湿盒4℃过夜;加生物素标记二抗,室温10min;加链霉卵白素-过氧化物酶,室温10 min;PBS漂洗3次;DAB显色1 min;自来水冲洗,苏木素复染细胞核10 min,自来水洗10 min以上。梯度酒精脱水,二甲苯透明,中性树胶封片。400倍镜下观察。阳性细胞细胞核呈紫蓝色,胞浆呈棕黄色。左侧缺血周围区皮质随机取4个视野,计算每个视野免疫组织化学染色反应阳性细胞数,取平均值。
1.6.3 Westernblotting
大鼠左侧缺血周围区皮质液氮速冻,-80℃冰箱保存。检测时每100 mg脑组织加入1 ml细胞裂解液和10µl苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)储存液提取蛋白质。考马斯亮蓝法测定蛋白浓度。脑组织加热变性后,取50µg,12% SDS-PAGE电泳,转移至PVDF膜上。5%脱脂牛奶室温封闭2 h。加TNF-α、IL-1β、IL-6一抗(1∶1000),β-actin,4℃孵育过夜。加人辣根过氧化物标记的二抗,室温孵育1 h。避光配置显色液并覆盖PVDF膜,反应1 min。采用Image-lab软件对目的条带行灰度分析,计算其与β-actin比值。
1.7统计学分析
采用SPSS18.0统计软件进行统计分析。数据采用(xˉ±s)表示,组间比较采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1神经功能缺损评分
干预前,与假手术组相比,模型组及电针组大鼠神经行为学评分均明显升高(P<0.01),模型组和电针组间无显著性差异(P>0.05)。干预后,电针组神经缺损评分较模型组降低(P<0.05)。见表1。
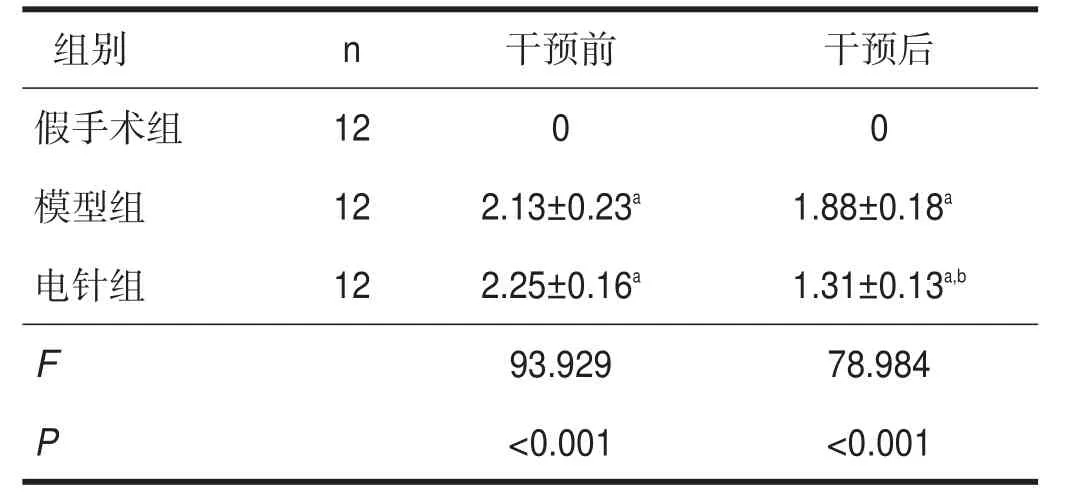
表1 各组干预前后神经功能缺损评分比较
2.2HE染色
假手术组神经细胞胞体呈多形性,胞质丰富,核圆形,核仁清晰可见。模型组神经细胞排列不规则,胞体明显缩小,胞质浓染或嗜伊红,核固缩,被深染的细胞包围,可能是炎性细胞。与模型组相比,电针组核皱缩或碎裂、溶解的神经细胞减少,细胞浸润减少。见图1。
2.3ED1免疫组织化学染色
ED1为活化的小胶质细胞标记物。假手术组偶见ED1阳性细胞。模型组可见大量小胶质细胞胞体增大,形态变为圆状、阿米巴状。与假手术组比较,模型组阳性细胞数明显增加(P<0.01);与模型组比较,电针组阳性细胞数减少(P<0.05)。见图2、表2。
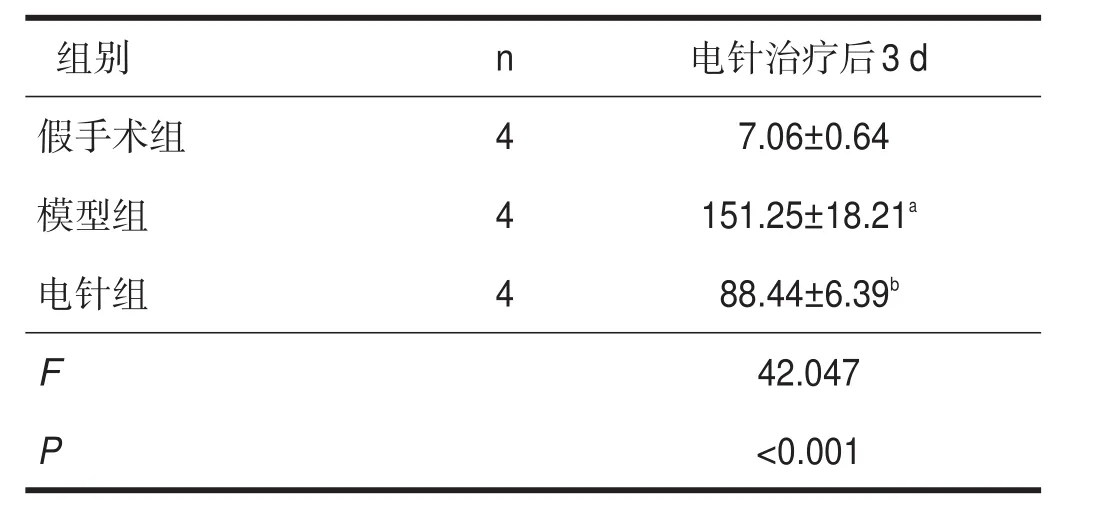
表2 各组ED1阳性细胞计数
2.4Westernblotting
模型组TNF-α、IL-1β和IL-6蛋白表达较假手术组增加(P<0.05),电针组较模型组降低(P<0.05)。见表3。
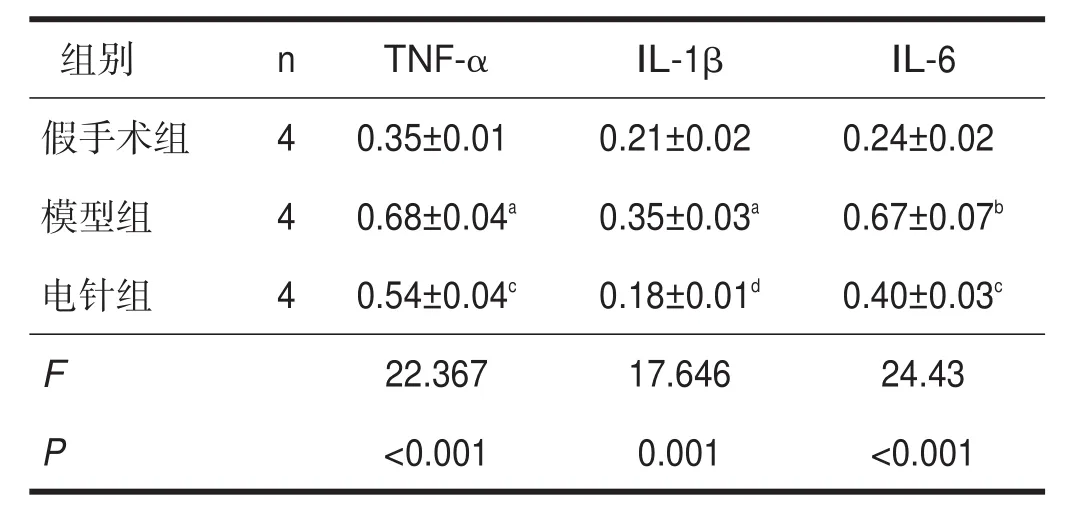
表3 各组促炎因子蛋白表达比较(/β-actin)
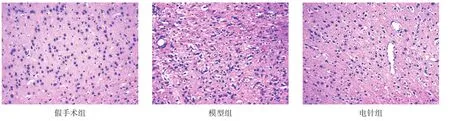
图1 各组缺血周围区皮质神经细胞形态(HE染色,200×)
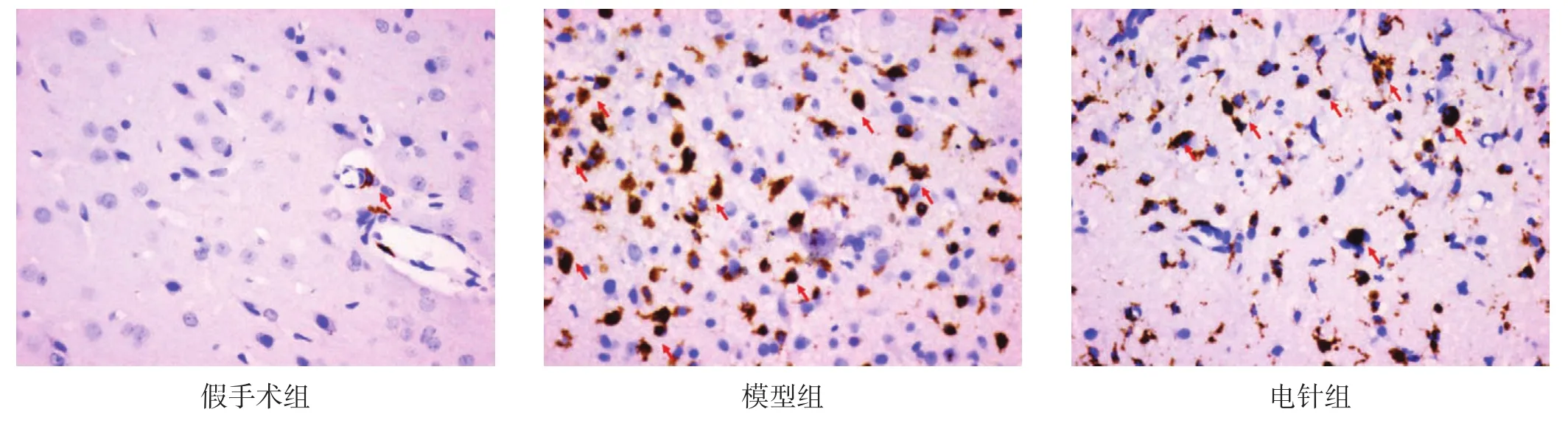
图2 各组缺血周围区皮质ED1的表达(免疫组织化学染色,400×)
3 讨论
祖国医学认为,中风(脑卒中)的基本病机总属阴阳失调,气血逆乱。根据中医理论“治痿独取阳明”原则,曲池穴是阳明经合穴,足三里穴是足阳明经合穴,对缺血性中风疗效确切,临床应用广泛。本研究显示,电针曲池、足三里能促进缺血再灌注损伤大鼠神经功能恢复。
近年研究发现,脑缺血过程中存在炎性反应,包括炎性因子和趋化因子产生,小胶质细胞和星形胶质细胞活化[15-17]。脑缺血时,局部脑组织细胞氧糖剥夺,神经元死亡或内源性信号改变,小胶质细胞激活;活化的小胶质细胞进一步释放具有细胞毒性的炎性细胞因子,如TNF-α、IL-1β和IL-6,加重神经元损害[18-21]。
TNF-α是很强的免疫介质和促炎细胞因子,脑缺血后的快速上调与神经炎症密切相关[22]。活化的小胶质细胞释放过量IL-1β、TNF-α,导致神经元损伤[23];注入小胶质细胞抑制剂米诺环素或吡格列酮,可以减少促炎因子的表达[24-25]。近年有学者发现,P2Y12受体及其p38MAPK/PKC信号通路介导小胶质细胞的活化及促炎因子的释放[26-27]。姜酮酚在缺血性脑损伤后具有神经保护作用,与抑制缺血周围区小胶质细胞活化引起的神经炎性反应,减少促炎因子TNF-α、IL-6的释放有关[8]。肢体缺血再灌注模型中发现,电针预处理可以抑制大鼠海马小胶质细胞的活化,减轻氧化应激[12]。
本研究显示,大鼠脑缺血再灌注后,缺血周围区皮质活化的小胶质细胞数量显著增加,促炎因子表达增加;电针后,缺血周围区皮质小胶质细胞活化被抑制,该区域促炎因子表达下降。
综上所述,电针曲池、足三里穴可能通过抑制缺血周围区皮质小胶质细胞的活化及促炎因子的释放,起到神经保护作用。电针调控小胶质细胞活化的信号途径,有待进一步研究。
[参考文献]
[1] Katnik C, GarciaA, Behensky AA, et al. Treatment withAfobazoleat delayed timepointsfollowing ischemic strokeimproves long-term functional and histological outcomes [J]. Neurobiol Dis, 2014, 62: 354-364.
[2]吴松花,李春玉.脑卒中患者中医体质与生命质量相关性研究进展[J].吉林医学, 2014, 35(31): 7041-7042.
[3] Merians AS, Jack D, Boian R, et al. Virtual reality-augmented rehabilitation for patients following stroke [J]. Phys Ther, 2002, 82(9): 898-915.
[4] Mizoguchi Y, Kato TA, HorikawaH, et al. Microglial intracellu-lar Ca(2+) signaling asatarget of antipsychotic actionsfor the treatment of schizophrenia [J]. Front Cell Neurosci, 2014, 8: 370.
[5]王慧霞.脑缺血半暗带及其干预的研究进展[J].世界最新医学信息文摘(电子版), 2014, (14): 52-52, 45.
[6] Wu CY, Kaur C, Sivakumar V, et al. Kv1.1 expression in microgliaregulatesproduction and releaseof proinflammatory cytokines, endothelins and nitric oxide [J]. Neuroscience, 2009, 158(4): 1500-1508.
[7] Hong ZY, Shi XR, Zhu K, et al. SCM-198 inhibits microglial overactivation and attenuates Aβ(1-40)-induced cognitive impairmentsin ratsvia JNK and NF-кB pathways[J]. JNeuroinflammation, 2014, 11: 147.
[8] Gaire BP, Kwon OW, Park SH, et al. Neuroprotective effect of 6-paradol in focal cerebral ischemiainvolvestheattenuation of neuroinflammatory responses in activated microglia [J]. PLoS One, 2015, 10(3): e120203.
[9] Lan L, Tao J, Chen A, et al. Electroacupuncture exerts anti-inflammatory effects in cerebral ischemia- reperfusion injured ratsviasuppression of the TLR4/NF-kappaB pathway [J]. Int J Mol Med, 2013, 31(1): 75-80.
[10]韩冰冰,卢岩,赵海军,等.针刺对MCAO大鼠脑组织小胶质细胞活化及炎症介质含量的影响[J].中风与神经疾病杂志, 2014, 31(10): 894-896.
[11]骆明军,程玲,徐丽,等.电针刺激水沟、百会穴后对缺血再灌注大鼠脑内小胶质细胞的活化[J].中国临床康复, 2006, 10 (11): 180-182.
[12] Chen Y, Zhou J, Li J, et al. Electroacupuncture pretreatment preventscognitiveimpairment induced by limb ischemia-reperfusion viainhibition of microglial activation and attenuation of oxidativestressinrats[J]. Brain Res, 2012, 1432: 36-45.
[13] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989, 20(1): 84-91.
[14]李忠仁.实验针灸学[M].北京:中国中医药出版社, 2007: 242.
[15] Jin R, Yang G, Li G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells [J]. J Leukoc Biol, 2010, 87 (5): 779-789.
[16] Becker KJ. Modulation of the postischemic immune response to improve stroke outcome [J]. Stroke, 2010, 41(10 Suppl): S75-S78.
[17] Tuttolomondo A, Di Raimondo D, di Sciacca R, et al. Inflammatory cytokinesin acuteischemic stroke[J]. Curr Pharm Des, 2008, 14(33): 3574-3589.
[18] CeulemansAG, Zgavc T, Kooijman R, et al. The dual role of theneuroinflammatory responseafter ischemic stroke: modulatory effects of hypothermia [J]. J Neuroinflammation, 2010, 7: 74.
[19] Banati RB, Gehrmann J, Schubert P, et al. Cytotoxicity of microglia[J]. Glia, 1993, 7(1): 111-118.
[20] Boutin H, LeFeuvre RA, Horai R, et al. Roleof IL-1alphaand IL-1beta in ischemic brain damage [J]. J Neurosci, 2001, 21 (15): 5528-5534.
[21] Sairanen T, Carpen O, Karjalainen-Lindsberg ML, et al. Evolution of cerebral tumor necrosis factor-alpha production duringhumanischemicstroke[J]. Stroke, 2001, 32(8): 1750-1758.
[22] Ritzel RM, Patel AR, Grenier JM, et al. Functional differences between microglia and monocytes after ischemic stroke [J]. J Neuroinflammation, 2015, 12: 106.
[23] Yuan Y, Zha H, Rangarajan P, et al. Anti-inflammatory effects of Edaravone and Scutellarin in activated microglia in experimentally induced ischemia injury in rats and in BV-2 microglia[J]. BMCNeurosci, 2014, 15: 125.
[24] Tikka TM, Koistinaho JE. Minocycline provides neuroprotection against N-methyl-D-aspartate neurotoxicity by inhibiting microglia[J]. JImmunol, 2001, 166(12): 7527-7533.
[25] Zhao Y, Patzer A, Gohlke P, et al. The intracerebral application of the PPARgamma-ligand pioglitazone confers neuroprotection against focal ischaemiain therat brain [J]. Eur JNeurosci, 2005, 22(1): 278-282.
[26] Liu Y, Zhao T, Yang Z, et al. CX3CR1 RNAi inhibits hypoxia- induced microglia activation via p38MAPK/PKC pathway [J]. Int JExp Pathol, 2014, 95(2): 153-157.
[27] Gelosa P, Lecca D, Fumagalli M, et al. Microglia is a key player in the reduction of stroke damage promoted by the new antithrombotic agent ticagrelor [J]. JCereb Blood Flow Metab, 2014, 34(6): 979-988.
·专题·
作者单位:1.福建中医药大学康复医学院,福建福州市350122;2.福建中医药大学,福建福州市350122;3.福建省康复技术重点实验室,福建福州市350122。作者简介:王鲜(1987-),女,河南三门峡市人,硕士研究生,主要研究方向:神经康复及认知科学。通讯作者:陈立典(1963-),男,福建政和市人,博士,教授,博士生导师,主要研究方向:神经康复及认知科学。E-mail: fjtcm1958@sina.com。
Effectsof Electroacupunctureon Activation of Microglia in Peri-infarct Cortex of Cerebral Ischemia-reperfusion Injury Rats
WANG Xian1, HUANG Jia1, LIU Wei-lin1, SHANGGUAN Hao1, ZHENG Yi1, WANG Lu-lu1, LIN Yun-jiao1, TAO Jing1,3, CHENLi-dian2
1. Collegeof Rehabilitation Medicine, Fujian University of Traditional Chinese Medicine, Fuzhou, Fujian 350122, China; 2. Fujian University of Traditional Chinese Medicine, Fuzhou, Fujian 350122, China; 3. Fujian Key Laboratory of Rehabilitation Technology, Fuzhou, Fujian350122, China
Abstract:Objective To explore the effect of electroacupuncture on activation of microglia in peri-infarct cortex after cerebral ischemia-reperfusion in rats. Methods36 male Sprague-Dawley rats were randomly divided into sham group (n=12), model group (n=12) and electroacupuncturegroup (n=12). Thelatter two groupswereoccluded theleft middlecerebral arterieswith modified Longa'smethod for 2 hours and reperfused. The electroacupuncture group received electroacupuncture at Quchi (LI11) and Zusanli (ST36) acupoints for 3 days. Thenervecell damageinperi-infarct cortex wasobservedwith HEstaining, whiletheexpressionof ED1wasdeterminedwithimmunohistochemical staining, and the expression of tumor necrosis factor-α(TNF-α), interleukin-1β(IL-1β) and IL-6 were determined with Western blotting. ResultsTheneurological deficitsscoreimproved significantly in theelectroacupuncturegroup (P<0.05), with lessnervecell damage, lessnumber of ED1 positivemicroglia(P<0.05) and lesslevelsof TNF-α, IL-1β and IL-6 (P<0.05), compared with themodel group. Conclusion Theelectroacupunctureat Quchi (LI11) and Zusanli (ST36) acupointscan protect brain from ischemia-reperfusion injury, which might beassociatedwithinhibitingthemicroglial activationandproinflammatory responseinperi-infarct cortex.
Keywords:cerebral ischemia-reperfusioninjury; electroacupuncture; microglia; inflammation; rats
(收稿日期:2015-09-01修回日期:2015-10-15)
基金项目:1.国家自然科学基金项目(No.81273835; No.81403462);2.福建中医药大学重点学科专项基金项目(No.X2014069-学科)。
DOI:10.3969/j.issn.1006-9771.2015.11.003
[中图分类号]R743.3
[文献标识码]A
[文章编号]1006-9771(2015)11-1251-05
