石蒜愈伤组织增殖分化及试管鳞茎膨大研究
2015-03-02刘旭忻徐正华舒春节
刘旭忻,邹 娜,张 露,徐正华,舒春节,赵 衡
(江西农业大学园林与艺术学院,江西南昌330045)
石蒜愈伤组织增殖分化及试管鳞茎膨大研究
刘旭忻,邹娜,张露*,徐正华,舒春节,赵衡
(江西农业大学园林与艺术学院,江西南昌330045)
摘要:以石蒜愈伤组织为材料,分别采用完全随机和L9(34)正交试验设计,研究不同激素浓度配比对石蒜愈伤组织增殖及不定芽分化,以及大量元素浓度、蔗糖浓度和活性炭(AC)含量对石蒜鳞茎膨大等影响。结果表明:MS+6-BA 5.0 mg/L+NAA 0.5 mg/L为适宜的愈伤组织增殖培养基,增殖系数为3.02;MS+6-BA 1.0 mg/L+NAA 0.3 mg/L为适宜的分化培养基,分化率达到92.58%;MS+蔗糖40 g/L+AC 1.0 g/L为适宜的鳞茎膨大培养基,鳞茎质量可达0.86 g,增加6.62倍,直径达1.00 cm。
关键词:石蒜;愈伤组织;试管鳞茎;膨大
石蒜(Lycorisradiata(L’Her.) Herb)为石蒜科(Amaryllidaceae)石蒜属(Lycoris)鳞茎类多年生草本植物,别名红花石蒜、魔术花[1]。石蒜是一类集观赏、药用与工业价值于一体的经济植物[2-4],广泛应用于植物景观配置和药用生产。迄今,有关石蒜属植物的研究报道主要集中在染色体核型[5-6]、生长发育[7]、繁殖及栽培[8]、杂交育种[9]、开发利用[2-3]等方面。由于石蒜有性杂交结实率很低[10],自然分球繁殖系数低、速度慢[11],因此很多学者把注意力集中在石蒜组培研究上,以鳞片为外植体,多用直接诱导出的不定芽进行增殖[12],以期提高其繁殖系数,但试管鳞茎小,移栽成活率低[13],限制了石蒜组培快速发展。目前百合与大蒜在试管鳞茎膨大方面进行了有益探索[14-16],取得了一定成效。为此,本文将探讨石蒜愈伤组织增殖分化及鳞茎膨大因素,旨在为石蒜试管苗生产和壮大提供技术支撑,为石蒜属其他植物的快繁技术提供依据。
1材料与方法
1.1供试材料
以石蒜(Lycorisradiata(L’Her.) Herb)双鳞片诱导出的愈伤组织为试材,进行愈伤组织增殖、不定芽分化和鳞茎膨大试验。
1.2试验方法
1.2.1石蒜愈伤组织增殖与不定芽分化采用完全随机化试验设计,将获得的愈伤组织切割成约1 cm×1 cm小块,接种到MS添加4种浓度6-BA(1.0,3.0,5.0,7.0 mg/L)和2种浓度NAA(0.3 mg/L、0.5 mg/L)的8种培养基上,各培养基均添加琼脂6.5 g/L,蔗糖20 g/L,并调至pH 5.8。每处理接种10瓶,每瓶1~2块愈伤组织,重复3次。接种后置于温度(25±1)℃,光照强度2 000 lx,光周期12 h/d环境条件下培养。接种50~60 d后进行统计分析愈伤组织增殖系数、愈伤组织分化率和分化芽数。
愈伤组织增殖系数=培养后愈伤组织体积/接入时愈伤组织体积
(1)
愈伤组织分化率=(出芽的愈伤组织块数/愈伤组织总块数)×100%
(2)
分化不定芽数=不定芽总数/出芽的愈伤组织块数
(3)
1.2.2石蒜试管鳞茎膨大将分化出的不定芽丛芽分割成单芽,选取直径为0.2~0.3 cm的单芽,切去其叶片,接种于膨大培养基上,各培养基均添加琼脂6.5 g/L,调至pH 5.8。试验设计采用3因素3水平的正交设计,参照L9(34)设计表(表1),共9个处理,每处理接种10瓶,每瓶接种1个芽,两次重复。置于温度(25±1)℃,光照强度2 000 lx,光周期12 h/d环境培养,并观察鳞茎膨大状况。接种50~60 d后,从培养基中取出诱导出的鳞茎,剪去叶片和根,称其质量,测定鳞茎直径和高度,统计鳞茎增重倍数和鳞茎指数等指标。
初始单芽鲜重=接种单芽后培养基与瓶的总质量-未接种前的培养基与瓶的总质量
(4)
鳞茎增重倍数=最终形成鳞茎质量/初始单芽质量
(5)
鳞茎指数=鳞茎高度/鳞茎直径

(6)
1.2.3数据处理和分析应用Excel 2010进行数据处理,采用SPSS 17.0进行方差分析。
2结果与分析
2.1激素配比对石蒜愈伤组织增殖与不定芽分化影响
石蒜愈伤组织在含有不同激素浓度配比的培养基中进行增殖(表2),结果表明NAA浓度一定时,愈伤组织增殖系数随着6-BA浓度的增加呈现先增后减的趋势,并在6-BA为5.0 mg/L时达到最大值,分别比1.0,3.0,7.0 mg/L提高80.84%、54.87%、101.33%;当6-BA浓度一定时,与0.3 mg/L NAA相比,0.5 mg/L NAA在1.0,3.0,5.0,7.0 mg/L 6-BA条件下增殖系数分别提高15.97%、34.48%、64.13%、15.38%。方差分析表明,处理7的增殖系数与其他各处理间存在极显著差异。由上可知,植物生长调节剂的不同浓度配比组合对愈伤组织的增殖有较大的影响,其中以MS+6-BA 5.0 mg/L+NAA 0.5 mg/L(即处理7)中的愈伤组织生长最快(愈伤组织体积增大后质地较疏松,呈淡黄色)、增殖系数最大(3.02倍)而为最佳增殖配方(图1)。

表2 不同激素浓度配比对石蒜愈伤组织增殖和不定芽分化的影响
大写字母代表0.01水平的差异显著性分析,小写字母代表0.05水平的差异显著性分析。+:愈伤组织缓慢生长;++:愈伤组织生长较快;+++:愈伤组织快速生长。
Uppercase letter significant at 0.01 level,lowercase letter significant at 0.05 level.+:proliferated slowly;++:proliferated faster;+++:proliferated rapidly.
愈伤组织增殖中,也会分化出不定芽。当培养30 d时,愈伤组织表面出现白色芽点,50~60 d时芽顶端分化出绿色叶片,但是添加不同浓度配比的植物生长调节剂,不定芽分化情况大不相同(图1-图2)。表1表明,当NAA浓度不变,分化率随着6-BA浓度的增加而减小;当6-BA浓度不变,分化率随着NAA浓度的升高而下降。方差分析表明,处理1与其它处理达极显著差异;而处理4和8培养基中的石蒜愈伤组织分化率较低,与其他处理也有极显著差异。石蒜愈伤组织在MS+6-BA 1.0 mg/L+NAA 0.3 mg/L(即处理1)中具有最高分化率,为92.58%。
不同激素浓度配比组合使得不定芽分化率各不相同,其诱导愈伤组织分化出的不定芽个数亦有差别(表2)。NAA浓度一定时,6-BA浓度的升高会导致不定芽数减少;6-BA浓度一定时,低浓度的NAA能促进不定芽数增加,其中以MS+6-BA 1.0 mg/L+NAA 0.3 mg/L(处理1)中分化芽数最多(5.53个),分别比处理2、3、4提高41.43%、56.66%、159.62%,且分化出的不定芽长势较壮,植株较大。方差分析结果表明,处理1与其他各处理间均存在极显著差异。由此看出,低浓度的植物生长调节剂组合不仅可提高石蒜不定芽分化率、且有利于不定芽的形成及生长,筛选出石蒜不定芽适宜分化培养基配方组合为MS+6-BA 1.0 mg/L+NAA 0.3 mg/L(处理1)。
2.2不同因素水平对石蒜试管鳞茎膨大影响
在膨大培养基上培养至50~60 d后,测定鳞茎质量、直径与高度,鉴于石蒜鳞茎近球形,膨大效果主要是体现为质量的增加与直径的增长(图3),重点分析其质量与直径,对高度值的分析仅作参考。
从表3中可以看出不同因素水平对石蒜试管鳞茎的质量、直径、高度的影响不同。就鳞茎质量而言,处理4的石蒜鳞茎质量值最大(0.86 g),比处理2提高514.29%。通过分析鳞茎质量极差值,可知影响石蒜试管鳞茎增重因素的主次顺序依次为:大量元素、活性炭、蔗糖。就不同因素水平而言,含大量元素浓度1 MS的培养基,分别比大量元素浓度为1/2 MS、2 MS的培养基平均质量提高129.63%、67.57%;添加活性炭2.0 g/L的培养基分别比添加活性炭0.5 g/L、1.0 g/L的培养基提高质量96.43%、27.91%;但不同蔗糖浓度对鳞茎质量的影响较小,其中以添加40 g/L蔗糖的增重效果较好。
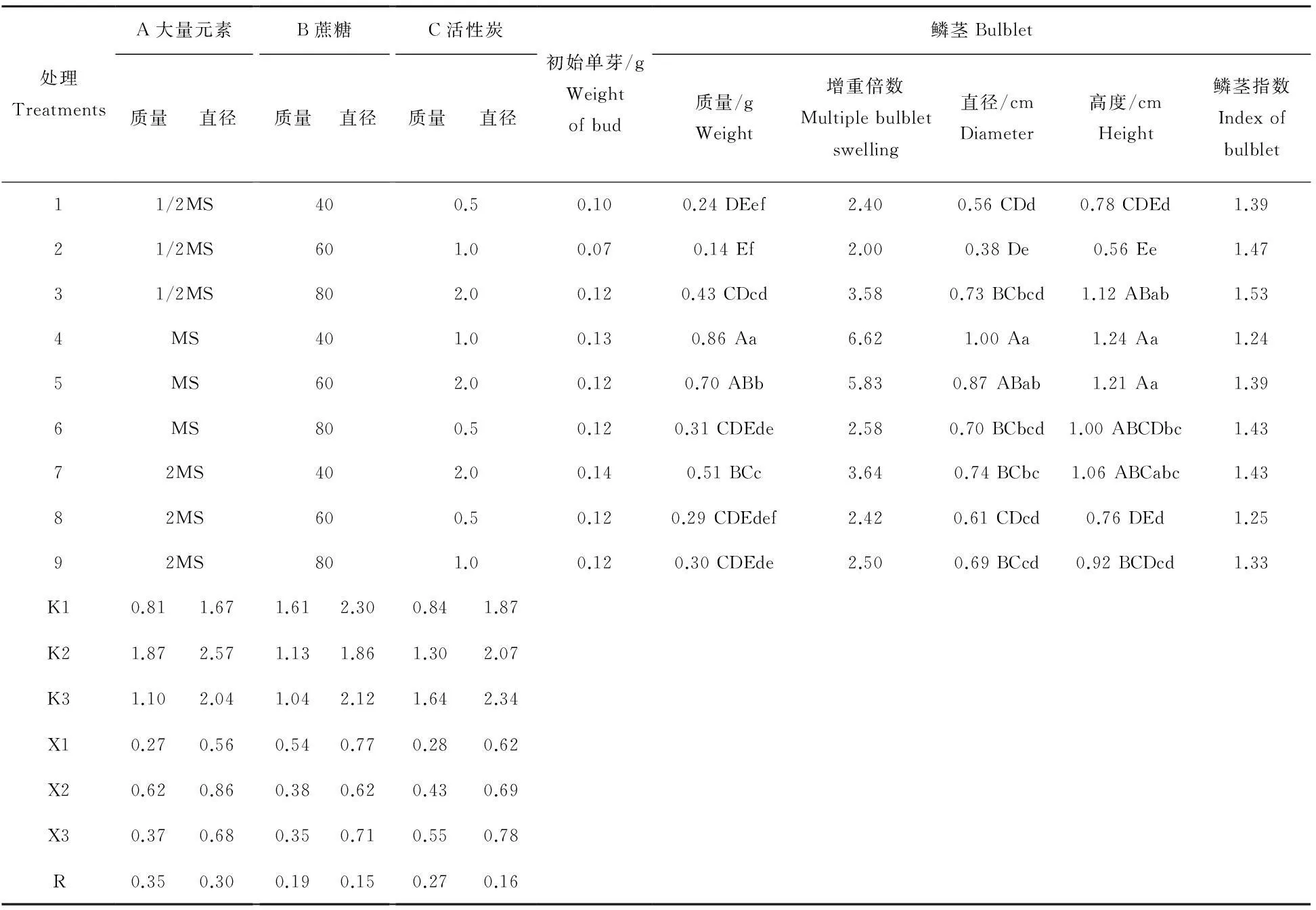
表3 石蒜试管鳞茎膨大相关性状及大量元素浓度、蔗糖含量、活性炭含量极差分析
大写字母代表0.01水平的差异显著性分析,小写字母代表0.05水平的差异显著性分析。
Uppercase letter significant at 0.01 level,lowercase letter significant at 0.05 level.
从鳞茎的直径这一指标来看,处理4中的石蒜试管鳞茎直径最大(1.00 cm),分别比处理2、处理9提高163.16%、44.93%。根据极差值可知对鳞茎直径增长影响最大的是大量元素,其次是活性炭,蔗糖的作用最小。进一步分析各因素不同水平的作用,大量元素浓度为1 MS的培养基对促进鳞茎直径增长的效果最好,平均直径分别比添加大量元素1/2 MS、2 MS的培养基提高53.57%、26.47%;培养基中活性炭用量由0.5 g/L提升至1.0 g/L时,鳞茎平均直径提高11.29%,活性炭用量由0.5 g/L提升至2.0 g/L时,平均直径提高25.81%;含有蔗糖40 g/L的培养基的平均直径(0.77 cm)与含有蔗糖80 g/L的培养基的平均直径(0.71 cm)比较接近。方差分析表明,处理4对试管鳞茎增重和直径增长影响与除了处理5之外的其他处理间的差异均达到极显著水平。
从鳞茎的高度值来看,仍然是处理4的效果最好,该处理中的试管鳞茎高度达到1.24 cm,分别比处理1、处理2、处理8提高58.97%、121.43%、63.16%。处理5、处理3、处理7中的鳞茎高度仅次于处理4,但这四个处理之间差异不显著。
从3个单因素(大量元素、蔗糖、活性炭)的鳞茎质量、直径极差比较中,分析出较好的鳞茎增重配方为MS+蔗糖 40 g/L+活性炭 2.0 g/L。但该配方与正交试验所得的最佳膨大方案处理4的配方存在偏差,要得到最优的膨大配方,需进一步做试验对比验证。
验证试验中MS+蔗糖 40 g/L+活性炭 2.0 g/L所培养的鳞茎平均质量为0.32 g,鳞茎平均直径为0.70 cm,鳞茎平均高度为0.95 cm,膨大效果明显不及处理4(鳞茎平均质量0.86 g,鳞茎平均直径1.00 cm,鳞茎平均高度1.24 cm)。综合分析表明:以MS基本培养基添加40 g/L蔗糖与1.0 g/L活性炭(处理4)为最佳的膨大配方组合,移栽成活率高达98%(图4)。

图1 MS+6-BA 5 mg/L+NAA 0.5 mg/L愈伤组织增殖、分化效果Fig.1 Effect of callus proliferation and differentiation onMS+6-BA 5 mg/L+NAA 0.5 mg/L

图2 MS+6-BA 1 mg/L+NAA 0.3 mg/L愈伤组织增殖、分化效果Fig.2 Effect of callus proliferation and differentiation onMS+6-BA 1 mg/L+NAA 0.3 mg/L

图3 鳞茎膨大效果的比较Fig.3 Comparison of bulblet enlargement

图4 试管苗移栽成活Fig.4 Transplanting survival of test-tube plantlets
3讨论与结论
植物生长调节剂的种类与浓度配比对石蒜属植物的组培繁殖及小鳞茎的分化存在影响[17],本研究得出较高浓度的6-BA和NAA组合有利于石蒜愈伤组织的增殖,较低浓度的生长素有利于分化出不定芽。石蒜试管鳞茎贮藏的养分能为石蒜出苗后的生长发育提供大量的营养,试管苗形成的鳞茎愈大愈能够提高移栽成活率,所以鳞茎的大小决定着试管苗出瓶移栽后的生长势态。对于石蒜鳞茎而言,大量元素是促进其膨大的决定性因素,大量元素浓度等于标准浓度MS时,膨大效果最好,这与张洁等[18]的研究结果不相同。大量元素浓度过低,不利于鳞茎的膨大[19-20],而大量元素中N、P、K等浓度过高会抑制根的发生,影响营养元素的吸收。高含量的活性炭有利于试管鳞茎的膨大,随着活性炭含量的增加,鳞茎的质量和直径增加,2.0 g/L时,鳞茎膨大显著,这与胡凤荣[21]的研究结果相似。可能是活性炭给试管鳞茎创造了暗环境,产生了对生长抑制物等其他有机物的吸附作用,从而促进了鳞茎的膨大[20,22]。蔗糖浓度为40 g/L时,有利于鳞茎的膨大,这与朱锦等[11]、王光萍等[23]的研究结果不一致。推测是小鳞茎在膨大前所处的营养环境不相同,机体内所含养分存在差异,膨大过程中对糖分的需求也不尽相同。三种因素采用正交设计,则大量元素MS+蔗糖40 g/L+AC 1.0 g/L为最佳膨大组合,这是各因素间互相作用的结果。
本试验通过带鳞茎基盘的石蒜双鳞片诱导获得愈伤组织,以愈伤组织为外植体,添加不同浓度配比的激素进行增殖、不定芽分化,再将分化形成的单芽放入正交设计的培养基上促进其鳞茎膨大。主要技术路线为:将愈伤组织接入MS+6-BA 5.0 mg/L+NAA 0.5 mg/L进行增殖,取增殖后的愈伤组织放入分化培养基MS+6-BA 1.0 mg/L+NAA 0.3 mg/L诱导不定芽萌发,最后将所得的单芽置于MS+蔗糖40 g/L+AC 1.0 g/L中进行鳞茎膨大培养。试验中亦发现,MS+6-BA 1.0 mg/L+NAA 0.3 mg/L能促使石蒜鳞茎复壮,使鳞茎直径增长至0.30 cm左右,为鳞茎膨大试验提供了良好材料。
参考文献:
[1]张露,曹福亮.石蒜属植物栽培技术研究进展[J].江西农业大学学报,2001,23(3):375-378.
[2]Liu S,Ding Z,Zhang L,et al.Ethanol production fromLycorisradiataHerbert (Amarylllidaceae) residues as a new resource[J].Biomass and Bioenergy,2012,37(2):237-242.
[3]Cao Z F,Yang P,Zhou Q S.Multiple biological functions and pharmacological effects of lycorine[J].Science China Chemistry,2013,56(10):1382-1391.
[4]令狐昱慰,李多伟.石蒜属植物的研究进展(综述)[J].亚热带植物科学,2007,36(2):73-76.
[5]张露,蔡友铭,诸葛强,等.石蒜属种间亲缘关系RAPD分析[J].遗传学报,2002,29(10):915-921.
[6]Wu W M,Zhu Y Y,Li H R,et al.Two new alkaloids from the bulbs ofLycorissprengeri[J].Journal of Asian natural products research,2014,16(2):192-199.
[7]肖郁绵,佘琳芳,常乐,等.三种植物生长调节剂对石蒜小鳞茎发育的影响[J].核农学报,2013,27(9):1409-1415.
[8]佘琳芳.石蒜属植物小鳞茎的繁殖技术及其化学调控研究[D].杭州:浙江大学,2014.
[9]任毅,符木,高亦珂.石蒜属植物育种研究进展[J].中国园艺文摘,2013,29(10):15-19.
[10]戴叶辉,张露,柳正葳,等.石蒜有性生殖败育的原因探讨[J].仲恺农业工程学院学报,2011,24(3):12-15.
[11]朱锦,诸葛强,余水生,等.石蒜组培繁殖技术的研究[J].浙江林业科技,2002,22(4):45-48.
[12]何树兰,束晓春,姚青菊,等.石蒜的组织培养[J].江苏林业科技,2003,30(4):18-20.
[13]马小萍,熊丽,王祥宁,等.组培条件对试管鳞茎膨大的影响[J].南方农业,2008,2(9):85-87.
[14]任亚萍,刘秀群,陈龙清.培养条件对卷丹试管鳞茎生长和膨大的影响[J].华中农业大学学报,2011,30(1):49-53.
[15]韦莉萍,韦绍龙,苏宾,等.兰州百合鳞茎再生繁殖体系的建立[J].南方农业学报,2014,45(5):742-748.
[16]梁艳,杨晓杰,陈典,等.多效唑对大蒜试管微鳞茎形成和膨大的影响[J].北方园艺,2010(5):57-59.
[17]刘合霞,周坚.石蒜愈伤组织的诱导及其植株再生研究[J].北方园艺,2013(06):93-96.
[18]张洁,蔡宣梅,林真,等.百合试管鳞茎诱导及膨大技术的研究[J].福建农业学报,2010,25(3):328-331.
[19]张延龙,梁建丽,牛立新.东方百合试管鳞茎膨大的研究[J].西北农林科技大学学报:自然科学版,2006,34(6):75-78.
[20]张艳波.毛百合组织培养与试管鳞茎膨大的研究[D].哈尔滨:东北林业大学,2013.
[21]胡凤荣.百合种质资源鉴定与组培快繁技术体系研究[D].南京:南京林业大学,2007.
[22]王晓丽.垂花百合组织培养及试管鳞茎膨大初步研究[D].哈尔滨:东北林业大学,2011.
[23]王光萍,陈英,周坚,等.长筒石蒜鳞片诱导和植株再生[J].植物生理学通讯,2005,41(4):457-460.
Proliferation and Differentiation of Callus and
Enlargement of Tube Bulbs inLycorisradiata
LIU Xu-xin,ZOU Na,ZHANG Lu*,XU Zheng-hua,
SHU Chun-jie,ZHAO Heng
(College of Landscape and Art,Jiangxi Agricultural University,Nanchang 330045,China)
Abstract:Taking the callus ofLycorisradiataas material,the callus proliferation and adventitious bud differentiation ofL.radiatawere studied by means of randomized complete design,using the medium of different hormone proportions.The influences of the macroelement concentration,sucrose concentration,activated carbon concentration on bulblet enlargement ofL.radiatawere studied utilizing L9(34) orthogonal design.The results showed that the suitable medium for the callus proliferation was MS+6-BA 5.0 mg/L+NAA 0.5 mg/L and its multiplication coefficient was 3.02.The suitable medium for the bud differentiation was MS+6-BA 1.0 mg/L+NAA 0.3 mg/L and its differentiation rate was up to 92.58%.The suitable medium for the bulblet enlargement was MS with 40 g/L sucrose and 1.0 g/L activated carbon.The weight and the diameter of the bulblet were up to 0.86 g and 1.00 cm respectively,and the weight increased 6.62 times.
Key words:Lycorisradiata;callus;bulblet in tube;enlargement
作者简介:刘旭忻(1991—),女,硕士生,主要从事石蒜组织培养研究,E-mail:jxaulxx@163.com;*通信作者:张露,教授,博导,E-mail:zhlu856@163.com。
基金项目:教育部留学回国人员启动基金(教外司留[(2009)1001号])
收稿日期:2015-03-18修回日期:2015-05-05
中图分类号:S682.2+9
文献标志码:A
文章编号:1000-2286(2015)06-1005-06
刘旭忻,邹娜,张露,等.石蒜愈伤组织增殖分化及试管鳞茎膨大研究[J].江西农业大学学报,2015,37(6):1005-1010.
