双氟沙星对异育银鲫的急性毒性和组织损伤研究
2015-05-15阮记明隗黎丽黄建珍章海鑫王自蕊
阮记明,隗黎丽,黄建珍,章海鑫,王自蕊
(1.江西农业大学 动物科学技术学院,江西 南昌 330045;2.江西省水产科学研究所,江西 南昌 330039)
氟喹诺酮类(Fluorine quinolones,FQNS)是一类具有6-氟-7-哌嗪-4-诺酮环结构(母核结构)的抗菌药物,具有杀菌力强、抗菌谱广、口服吸收快、生物利用率高、半衰期长等特点,可用于治疗各个系统的感染性疾病[1]。近年来,随着其广泛被使用,其毒副作用也逐渐显现。FQNS常见的毒副作用主要包括中枢神经系统毒性、肝脏毒性、肾脏毒性、软骨毒性、及生殖毒性等[2-4],经统计分析临床上出现最多的是神经毒性[5]。FQNS引起的神经毒性主要表现为惊厥、昏迷、癫痫等[6-8]。邓艳萍[9]在小鼠脑内注射环丙沙星、依诺沙星、司巴沙星与氧氟沙星等5种氟喹诺酮类抗菌药物时发现,上述5种药物能引起小鼠发生惊厥作用。肝肾毒性方面,长期高剂量使用FQs可产生明显肝毒性,肝肿胀等,甚至肝细胞坏死;肾脏损害表现为尿素氮和血清肌酐值升高;大剂量可形成蛋白尿、结晶尿、血尿等,严重时可出现水肿、间质性肾炎,甚至继发肾功能衰竭。Burkhardt等[10]研究了二氟沙星大剂量(300 mg/kg)用药后,透视观察可见其关节腔内积有泡状囊形物,关节吻合处错位,间距增大,且随着用药时间的增加,关节的损伤程度也在加剧,以肱骨和股骨顶端损伤最为明显。生殖毒性方面,黄文颐等[11]研究发现,盐酸二氟沙星能显著影响胚胎的生长发育,且其严重程度存在剂量效应关系。
双氟沙星(Difloxacin,DIF),也称二氟沙星,属于第三代FQNS抗菌药物之一。其化学名称为6-氟-1-对氟苯基-1,4-二氢-7-(4-甲基-1-哌嗪基)-4-氧代-3-喹啉羧酸,是由美国Abbott公司于1984年首次合成的。DIF对大多数革兰氏阴性菌和阳性菌、支原体等具有良好的抗菌活性[12]。因此,DIF成为我国水产养殖业上最为常用的抗菌药物之一。但是,DIF对水产动物的急性毒性、组织损伤等情况目前尚且不清楚。因此,本文拟通过研究DIF对异育银鲫急性毒性、在肝脏、肾脏组织中的残留以及所引起的损伤等情况,为其在水产养殖上的合理使用提供理论参考。
1 材料与方法
1.1 材料
1.1.1 试验动物 健康的异育银鲫购自于江苏省南通市某农场,体质量为(60.04±5.02)g,运至实验室经2%NaCl浸泡消毒10 min后,暂养2周。试验用水族箱规格为100 cm×80 cm×80 cm。试验用水为充分曝气的自来水;连续24 h充气;每两天换1次水,每次换水量1/4。暂养及毒性试验期间控制水温为(18±1)℃;自然光照。
1.1.2 主要仪器 超纯水系统(Purelab Prima120)、精密电子天平(Mettler AB104-N)、切片机(Leica:RM2135)、展片机(Leica:HI1210)、显微镜(Olympus)、高速冷冻离心机(Allegrax-15R)、Agilent-1100型高效液相色谱仪(四元泵、自动进样器、柱温箱、二极管阵列检测器)、氮气吹干仪、漩涡混合器等。
1.1.3 主要试剂和药品 苦味酸、甲醛、氯仿、石蜡、冰醋酸、苏木精、伊红、盐酸、无水乙醇、二甲苯、中性树胶和水杨酸、氯化钠、二氯甲烷、正己烷、柠檬酸、柠檬酸三钠、磷酸、磷酸氢二钠和磷酸二氢钠为国产分析纯;乙腈、四丁基溴化铵为HPLC级(由国药集团化学有限公司购进);DIF标准品购自Sigma公司;DIF原料药(纯度为98%)由浙江国邦药业有限公司提供。
1.2 方法
1.2.1 急性毒性试验 预试验根据《新兽药特殊毒性试验技术要求》设计,DIF采用单次前肠口灌给药。根据在最低剂量组的试验鱼死亡率小于20%,最高剂量组的试验鱼全部死亡或者死亡率大于80%原则,通过预试验得到正式试验的药物用量区间(最低与最高剂量)范围;再根据确定的区间范围利用等对数间距法[13]确定各正式急性毒性试验组的用药剂量。正式急性毒性试验分5个剂量组,每个剂量组分3个平行,共30尾。试验鱼发生死亡判断标准:呼吸停止并对外界刺激无反应,即中毒后鳃盖完全停止活动且鱼体对外界(如玻璃棒或镊子)刺激在30 s内没有产生反应确定为死亡[14]。
1.2.2 样品采集 根据本文得到的96 h LD50单次前肠口灌用药;试验分为3个平行,每个平行30尾;并于用药后第96 h采集肝脏和肾脏组织样品用于药物残留和组织切片分析。
1.2.3 药物残留检测 (1)色谱条件。色谱柱为:ZORBAX SB2C-18分析柱(150 mm×4.6 mm,5 μm);检测波长278 nm;流速1.5 mL/min;柱温 40 ℃;流动相:乙腈:四丁基溴化氨(0.030 mol/L、pH3.1)=5:95(V/V);进样量为 10 μL。
(2)HPLC样品处理[15]。用10 mL离心管分别称取肝脏、肾脏组织匀浆1.000 g,先加入0.2 mol/L PBS缓冲溶液(pH 7.4)和1 mol/L NaCl各1 mL,再加入5 mL二氯甲烷进行药物萃取,旋涡混合振荡10 min后,4℃条件下8 000 r/min离心10 min,取有机相;剩余残渣中再加入5 mL二氯甲烷,重复上述操作步骤进行第二次萃取;合并上述两次有机相,置于氮气吹干仪中45℃恒温吹干,然后加1 mL流动相溶解,再加5 mL正己烷脱脂;混匀、离心后将下层液体经有机微孔滤膜(0.45 μm)过滤,4℃保存。
(3)DIF检测方法确证。DIF检测方法的正确性见“双氟沙星对异育银鲫血脑屏障渗透性及消除规律”一文[16]。
1.2.4 组织切片 取新鲜肝脏和肾脏组织,10%福尔马林浸泡48 h以上;然后将固定好的肝脏和肾脏组织切成小块,依次进行组织脱水、透明、透蜡包埋、切片(厚度:6 μm),再用苏木精-伊红染色[17],中性树胶封片后在显微镜下观察、拍照。
1.3 数据处理
DIF半数致死量按照下列公式计算:

其中:Xk为最高对数剂量;i为相邻两对数剂量的差值;∑P为各剂量组的死亡率之和;Pm为最高剂量死亡率;Pn为最低剂量死亡率。
文中数据以平均值±标准差表示,并运用SPSS17.0进行一维方差分析,其中P<0.05和P<0.01表示差异显著和差异极显著。
2 结果与分析
2.1 96 h半数致死剂量
预试验得到DIF急性毒性正式试验时的药物用量区间为2 000~4 000 mg/kg。因此,依据等对数间距法得到 5 组正式急性毒性试验剂量分别为 2 000、2 378.209、2 828.134、3 363.179 和 4 000 mg/kg。然后在根据上述5个剂量进行前肠单次口灌给药后,各剂量组实验鱼死亡时间及死亡数量见表1。另根据1.3中DIF半数致死量公式计算得到DIF对异育银鲫96 h半数致死剂量为2 840 mg/kg,DIF应为安全剂量284 mg/kg。
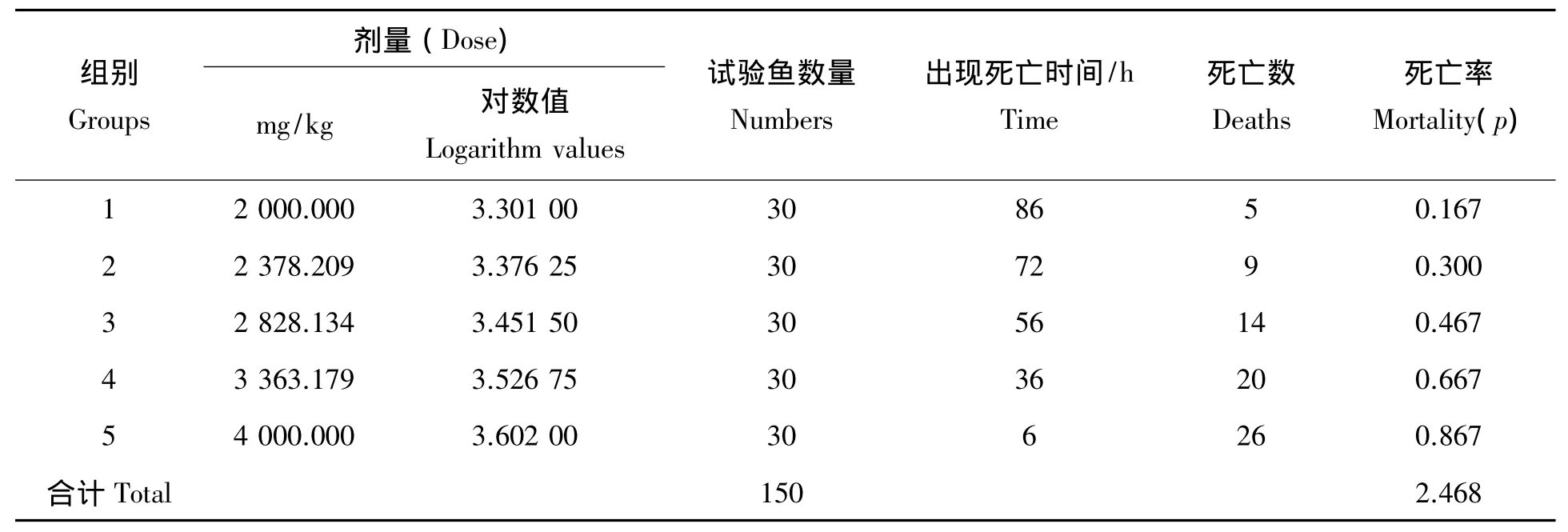
表1 DIF对异育银鲫急性毒性试验结果Tab.1 Acute toxicity test results of DIF to C.auratus gibelio
2.2 DIF 临床症状
DIF按照上述5个剂量进行前肠单次口灌给药后,各剂量组实验鱼均先后出现焦躁不安、快速游动、乱窜、呼吸频率加快且不规则等异常现象;并且随着试验时间的增加,各组实验鱼表现侧翻、甚至呈现“腹上背下”或者“头上尾下”等异常体态,有的体形发生“弯月状”变形;有的胸鳍、腹鳍还出现僵直、震颤等类似神经异常症状。另外,实验鱼在96 h LD50剂量下(2 840 mg/kg)也出现上述症状。实验鱼在96 h LD50剂量下,异育银鲫在用药后16 h开始表现急躁不安、呼吸频率加快、快速游动并上浮;49 h左右体态出现侧翻,呈弯月形,出现“头上尾下”等异常体态,随着用药时间的增加,有些异育银鲫表现出上述相似的异常神经症状。
2.3 DIF组织残留情况
采用HPLC对肝脏、肾脏组织中DIF残留检测结果显示,在DIF 96 h LD50剂量下,DIF在肝脏组织中的含量为(73.36±2.17)μg/g,极显著高于肾脏组织中的残留量(4.33±0.35)μg/g。

图1 96 h肝脏病理组织切片(DIF 96 h LD50)Fig.1 Histopathological section of liver at 96h(DIF 96 h LD50)

图2 正常肝脏组织切片Fig.2 Tissue section of normal liver

图3 96 h肾脏组织病理切片(DIF 96 h LD50)Fig.3 Histopathological section of kidney at 96 h(DIF 96 h LD50)

图4 正常肾脏组织切片Fig.4 Tissue section of normal kidney
2.4 DIF对肝脏、肾脏组织病理损伤情况
组织切片结果显示,DIF根据其96 h LD50(2 840 mg/kg)用药后,肝细胞之间的界线较为清晰;但细胞核变形严重呈星状,核仁浓缩、破裂甚至溶解消失(图1白箭头所示);细胞质染色较浅,有些发生崩解;部分肝细胞发生空泡变性(图1黑箭头所示);而正常肝细胞形态完整、界限清晰,细胞核染色均匀(图2白箭头所示);细胞质清晰、嗜酸性强;肝血窦典型(图2黑箭头所示)。肾脏在其96 h LD50用药后呈现血管球轻微皱缩,出现囊腔,结缔组织有出血(图3白箭头所示);肾小管结构不完整,其上皮细胞界线模糊,细胞核溶解(图3黑箭头所示)等病理变化;而正常肾脏肾小球结构完整(图4白箭头所示);肾小管形态清晰(图4黑箭头所示)。
3 讨论与结论
3.1 DIF对异育银鲫毒性
目前,关于DIF毒性也有很多研究。张艳等[18]研究表明,盐酸二氟沙星混悬乳注射液对小鼠口服LD50为2 303.56 mg/kg,对小鼠腹腔注射LD50为723.89 mg/kg,按照外源化合物急性毒性分级标准判断属于低毒物质。沈川等[19]研究认为,双氟沙星在剂量分别为500、50、5 mg/kg时对昆明系小鼠的生殖细胞染色体均未造成损伤,其显性致死试验为阴性。黄文颐等[11]按300、150、50 mg/kg的盐酸二氟沙星给受孕大鼠灌胃,结果高剂量组胎鼠存活率明显降低,显著影响了胚胎的生长发育,且其严重程度存在剂量效应关系。本文中所得到的DIF对异育银鲫(平均体质量为(60.04±5.02)g)96 h LD50为2 840 mg/kg。根据我国《生物技术检测规范(水环境部分)》毒性分级标准判断,DIF对异育银鲫为低毒物质。
另据报道,FQNS常见的毒副作用主要包括中枢神经系统毒性、肝脏毒性、肾脏毒性、软骨毒性、及生殖毒性等[2-4],其中中枢神经系统毒性为喹诺酮类药物常见的不良反应。经统计分析,临床上最多见的是神经毒性[5]。FQNS引起的神经毒性主要表现为惊厥、昏迷、癫痫等[6-8]。动物表现为不安或神经症状,雏鸡急性中毒神经症状表现为尖叫、旋转、最后头颈及两肢强直、痉挛而死,猫、犬还能诱发癫痫[20]。邓艳萍[9]研究发现,在小鼠脑内注射环丙沙星、依诺沙星、司巴沙星与氧氟沙星等5种氟喹诺酮类抗菌药能引发惊厥作用。张艳等[18]对小鼠灌服盐酸二氟沙星混悬乳注射液后,各组小鼠均出现扭体、竖尾、全身震颤、抽搐等症状。本文DIF急性毒性试验中,异育银鲫按照其96 h LD50单次前肠口灌给药后,于第16 h开始表现急躁不安,呼吸频率加快且不规则,快速游动并上浮等异常现象;在第49 h左右出现体态侧翻呈弯月形,在水中呈“头上尾下”的异常体态,随着用药时间的增加,有些异育银鲫表现“腹上背下”等异常体态,同时胸鳍和腹鳍呈僵直、震颤等类似神经异常症状。上述临床症状表明,DIF对异育银鲫具有神经毒性。
有研究表明,FQNS神经毒性与其能竞争性抑制神经递质γ-氨基丁酸(Gama-Aminobutiric acid,GABA)与GABA受体结合有关。有研究认为,FQNS致癫痫机制是通过阻止GABA与神经细胞相应的受体结合而致脑神经细胞的兴奋抑制调节失调[21-22],使CNS兴奋性增高[23]。FQNS在脑脊液中的浓度增高,使得GABA从自主神经末梢释放减少的同时,还可以竞争性抑制GABA与突触后受体结合,使CNS兴奋性增加,导致惊厥和癫痫等不良反应的发生[24]。FQNS神经毒性可能是由于FQNS药物含有氟原子(使其亲脂性增加,组织渗透力增强),容易通过血-脑屏障进入脑组织及神经细胞内,使GABA释放减少,进而使CNS兴奋性增高所致。另外有研究认为,FQNS引起轻度的神经毒性反应具有可逆性[25],停药后一般可恢复。
3.2 DIF对异育银鲫组织损伤
FQNS除了中枢神经系统毒性之外、肝脏毒性、肾脏毒性、软骨毒性及生殖毒性也是其常见的毒副作用。有研究发现,左氧氟沙星能引起肝脏损害[26],曲伐沙星可导致急性肝炎[27]。荣祖元等[28]在研究环丙沙星、依诺沙星、氧氟沙星等氟唆诺酮类药物对小鼠腹腔注射急性毒性试验中发现,上述药物在低于1/2~1/4LD50剂量作用下能引起小鼠肝脏重度畸型,出现空泡样变,并有散在灶性坏死。FQNS通常浓集于肾脏,可通过各种机制引起肾脏损害如直接损害肾小管、间质性炎症(过敏性间质性肾炎)、肾电解质水平改变或肾小球损害[29]。另外有研究发现,FQNS常引起过敏性间质性肾炎[30]。邓宇等[31]研究发现,左氧氟沙星对家兔的前交叉韧带细胞具有明确的毒性作用,同时认为该作用与氟喹诺酮类药物对肌腱的细胞毒性作用相类似。因此,本文研究了96 h LD50剂量下DIF在肝脏、肾脏组织中的残留及组织损伤情况。结果显示,在96 h LD50(2 840 mg/kg)剂量下,DIF在肝脏和肾脏组织中的残留量分别为(73.36±2.17)μg/g 和(4.33±0.35)μg/g(表 2)。同时,病理组织切片观察发现,DIF 根据其 96 h LD50用药后,肝脏细胞核变形严重呈星状,核仁浓缩、破裂甚至溶解消失,细胞质染色较浅,有些发生崩解;部分肝细胞发生空泡变性(图1);肾脏出现血管球轻微皱缩出现囊腔,结缔组织出血,肾小管结构不完整,其上皮细胞界线模糊,细胞核溶解等病理变化(图3)。上述组织病理观察结果表明,在96 h LD50剂量下,DIF对异育银鲫的肝脏、肾脏产生了严重毒性。
本文研究了DIF对异育银鲫的急性毒性和对在肝脏、肾脏组织中的残留以及所引起的组织损伤等情况。虽然急性毒性试验结果认为DIF对异育银鲫为低毒物质,但从其所致临床症状来看,DIF对异育银鲫具有神经毒性,同时对异育银鲫的肝脏、肾脏产生了严重毒性。本文的研究结果为DIF在水产养殖上的合理使用提供了理论参考。
[1]陈杖榴.兽医药理学[M].3 版.北京:中国农业出版社,2009:271-274.
[2]Owens R J,Ambrose P G.Antimicrobial safety:focus on fluoroquinolones[J].Clin Infect Dis,2005,41(Suppl 2):144-157.
[3]高硕,张红梅,蒋若冰.氟喹诺酮类药物的研究进展[J].沈阳药科大学学报,2011,09:756-759.
[4]穆桂荣.氟喹诺酮类药物不良反应临床分析[J].首都医药,2009,22:45.
[5]黄晓虹,张晓娟,廖广仁.308例氟喹诺酮类药致不良反应分析[J].中国药房,2010,10:928-930.
[6]Barrett M J,Login I S.Gemifloxacin-associated neurotoxicity presenting as encephalopathy[J].Ann Pharmacother,2009,43(4):782-784.
[7]Grill M F,Maganti R K.Neurotoxic effects associated with antibiotic use:management considerations[J].Br J Clin Pharmacol,2011,72(3):381-393.
[8]范铭.喹诺酮类药致老年人不良反应文献分析[J].中国药房,2010,18:1704-1706.
[9]邓艳萍.氟喹诺酮类药物对小鼠中枢神经毒性及其机制研究[D].北京:北京医科大学,1999.
[10]Burkhardt J E,Hill M A,Turek J J,et al.Ultrastructural changes in articular cartilages of immature beagle dogs dosed with difloxacin,a fluoroquinolone[J].Vet Pathol,1992,29(3):230-238.
[11]黄齐颐,房晶.盐酸双氟沙星对大鼠致畸胎试验[J].中国兽药杂志,1999,33(4):9-11.
[12]Carbone M,Pennisi M G,Masucci M,et al.Activity and postantibiotic effect of marbofloxacin,enrofloxacin,difloxacin and ciprofloxacin against feline Bordetella bronchiseptica isolates[J].Veterinary Microbiology,2001,81(1):79-84.
[13]沈建忠.动物毒理学[M].北京:中国农业出版社,2004:83-87.
[14]周凤霞.生物监测[M].北京:化学工业出版社,2006:99-112.
[15]阮记明,胡鲲,章海鑫,等.两种水温条件下异育银鲫体内双氟沙星药代动力学比较[J].上海海洋大学学报,2011(6):858-865.
[16]阮记明,胡鲲,杨先乐,等.双氟沙星对异育银鲫血脑屏障渗透性及消除规律[J].水生生物学报,2014(2):272-278.
[17]Jones R,Reid L.The effect of pH on Alcian Blue staining of epithelial acid glycoproteins.I.Sialomucins and sulphomucins(singly or in simple combinations)[J].Histochem J,1973,5(1):9-18.
[18]张艳,彭麟,贺培益,等.盐酸二氟沙星混悬乳注射液的急性毒性和蓄积毒性[J].江苏农业科学,2011(4):260-262.
[19]沈川,沈建忠.双氟沙星对小鼠的显性致死试验[J].中国兽药杂志,2000,34(5):16-18.
[20]魏东,李振华,张乃生.氟喹诺酮类药物的不良反应[J].动物医学进展,2006,27(7):105-107.
[21]Matsuo H,Ryu M,Nagata A,et al.Neurotoxicodynamics of the interaction between ciprofloxacin and foscarnet in mice[J].Antimicrob Agents Chemother,1998,42(3):691-694.
[22]Motomura M,Kataoka Y,Takeo G,et al.Hippocampus and frontal cortex are the potential mediatory sites for convulsions induced by new quinolones and non-steroidal anti-inflammatory drugs[J].Int J Clin Pharmacol Ther Toxicol,1991,29(6):223-227.
[23]易冬玲,易晓玲.氟喹诺酮类药物的神经毒性及其防治进展[J].医药导报,2010,29(9):1183-1184.
[24]李强,朱雄,等.喹诺酮类抗菌剂结构与不良反应之间的关系[J].药学进展,2003,27(1):29-33.
[25]蒋锦,刘明亮.氟喹诺酮类抗菌药的安全性[J].国外医药:抗生素分册,2003(5):226-231.
[26]Carbon C.Comparison of side effects of levofloxacin versus other fluoroquinolones[J].Chemotherapy,2001,47(Suppl 3):9-14,44-48.
[27]Chen H J,Bloch K J,Maclean J A.Acute eosinophilic hepatitis from trovafloxacin[J].N Engl J Med,2000,342(5):359-360.
[28]荣祖元,杨体模,庄镇华.环丙沙星、氧氟沙星、依诺沙星等对小鼠单次腹腔注射产生肝损伤作用程度比较[J].四川生理科学杂志,1995,Z1:76.
[29]Kaloyanides G J.Antibiotic-related nephrotoxicity[J].Nephrol Dial Transplant,1994,9(Suppl 4):130-134.
[30]Hadimeri H,Almroth G,Cederbrant K,et al.Allergic nephropathy associated with norfloxacin and ciprofloxacin therapy.Report of two cases and review of the literature[J].Scand J Urol Nephrol,1997,31(5):481-485.
[31]邓宇,陈廖斌.左氧氟沙星对家兔前交叉韧带细胞的细胞毒性作用[J].中国药理通讯,2011,28(2):30.
