调强放疗联合新辅助内分泌方法治疗局限期前列腺癌的疗效及影响因素
2015-03-02来晓东郭燕春王旬果
来晓东,郭燕春,王旬果
(山东省东营市人民医院1.泌尿外科;2.肿瘤放疗科,山东 东营,257091)
前列腺癌是严重威胁男性健康的泌尿系统恶性肿瘤之一,在美国,前列腺癌是最常见的非皮肤癌,据美国癌症协会[1]数据报道,2011年美国有240890 男性确诊前列腺癌。中国前列腺癌发病率出现逐年上升的趋势[2]。对于局部进行性前列腺癌早期患者,临床治疗多采用根治性前列腺切除或根治性放疗方案,但局部治疗后仍有约35%患者复发或转移。另一方面,鉴于前列腺癌是雄性激素依赖性肿瘤,根治性手术或放疗前行新辅助内分泌治疗(NHT)能够提高治疗效果[3]。本研究运用调强放疗联合新辅助内分泌方法治疗局限期前列腺癌,并探讨不同因素对患者生存结局的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2009年6月—2012年6月山东省东营市人民医院接受治疗的54例前列腺癌患者为研究对象,年龄58~79岁,中位年龄75岁。患者临床表现为排尿困难、尿频尿急、血尿等下尿路病变,行血清前列腺特异抗原(PSA)和经直肠超声引导下前列腺穿刺病理活检确诊,其中PSA 值≤10 ng/mL 5例、≥10 ng/mL 49例。采用AJCC TNM 分期标准T2期22例、T3期25例,T4期7例;N0期48,N1期6例。前列腺癌组织Gleason评分5~6 分15例,7 分17例(3 +4 分11例、4 +3 分6例),8 分15例,9 分7例。危险度分组:局限性中危8例,局限性高危组33例、局部晚期16例。此外,所有患者核素骨显像排除骨转移。实验经医院伦理研究会批准,患者均签署知情同意书。
1.2 方法
患者均采用新辅助内分泌治疗(NHT)联合调强放疗(IMRT),治疗前行血清PSA 检测、直肠超声下前列腺体积测定和最大尿流率(Qmax)测定。根据放疗前NHT 时间不同患者分为A组(3个月NHT)和B组(6 个月NHT),各27例。内分泌治疗方案采用手术去势或促黄体激素释放激素类似物(LHRH-A)(戈舍瑞林3.6 mg,每28 d 皮下注射1 次)联合抗雄激素药物(比卡鲁胺50 mg,1 次/d)去势。IMRT 运用美国瓦里安21EX/23EX 直线加速器,临床靶体积测定依据患者临床病理分期、PSA 水平和解剖部位差异划定,照射范围为盆腔预防照射联合前列腺区照射,其中盆腔区照射剂量48~52 Gy,前列腺区剂量28~32 Gy,单次剂量1.5~2 Gy,5 次/周,总剂量76~82 Gy。此外,患者治疗开始后定期检查PSA,1 次/月;肝肾功能及血常规,1 次/月,3 个月后改为每3~6 个月复查1 次。若患者PSA 持续升高或出现骨痛,则行核素骨扫描、盆腔CT 等检查。
1.3 观察指标
记录患者治疗前后血清PSA 值、前列腺体积和Qmax,比较2组上述指标在放疗后3、6 和12 个月时变化情况。依据美国放射肿瘤学会定义PSA生化复发:PSA 最低值(PSA nadir)基础上增加≥2 ng/mL,无生化复发时间为入组至PSA 复发、死亡或随访截止。
1.4 统计学处理
采用SPSS 19.0 软件进行统计分析,计量资料以均数±标准差()表示,计数资料以%表示。计量资料比较t 检验,非参数资料进行logrank 单因素分析。P<0.05 为差异有统计学意义。
2 结果
2.1 2组血清PSA 变化
NHT 治疗前A、B组血清PSA 中位数分别为67.9 ng/mL 和78.4 ng/mL,差异无统计学意义(P>0.05);化疗开始前再次检测,2组血清PSA中位数分别为0.30 ng/mL 和0.12 ng/mL,差异有统计学意义(P<0.01)。NHT 联合调强放疗治疗后3、6 和12 个月时,2组血清PSA 水平均较放疗前显著下降(P<0.05 或P<0.01),其中A组血清PSA 中位数 分别为0.15、0.14 和0.42ng/mL,B组分别为0.07、0.05和0.22ng/mL,其中12 个月时2组差异有统计学意义(P<0.01)。
2.2 2组前列腺体积和Qmax变化
治疗前2组前列腺体积和Qmax差异无统计学意义(P>0.05)。NHT 联合调强放疗后3 个月,2组前列腺体积均显著下降(P<0.01),Qmax均显著上升(P<0.01);组间比较,2组前列腺体积在放疗后各检测点差异无统计学意义(P>0.05),Qmax在放疗后3 个月差异无统计学意义(P>0.05),但在6 和12 个月时差异有统计学意义(P<0.05)。见表1。
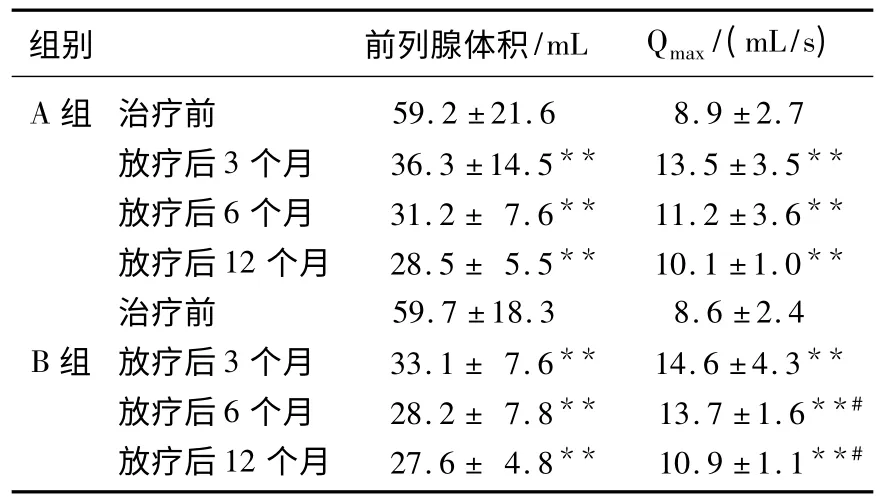
表1 2组前列腺体积和Qmax变化
2.3 不良反应
NHT 治疗过程中A组潮热2例,B组3例。IMRT 治疗开始后,A组出现尿频、血尿6例,肠炎6例;B组尿频、血尿7例,肠炎8例。尿频、血尿总发生率为24.1% (13/54),肠炎总发生率为25.9%(14/54),经对症治疗后均缓解。
2.4 无生化复发生存相关因素分析
术后随访3~36 个月,所有患者中11例放疗后出现生化复发;8例患者出现远端转移。表2显示的是54例患者无生化复发生存率(%)的单因素分析,其中放疗前PSA 水平、PSA nadir、危险分组与是无生化复发生存相关影响因素。
3 讨论
一项基于中国前列腺癌发病和治疗状况的多种心研究报告[4]显示,前列腺位癌基线PSA 中位置为46.1ng/mL,多数患者以尿路症状和骨痛就诊。本研究中,2组患者NHT 治疗前血清PSA中位数分别为67.9 ng/mL 和78.4 ng/mL,高于上述报道,可能和本研究纳入人群的前列腺癌分期以T3~T4期为主有关。PSA 是一种丝氨酸蛋白水解酶,血液中大部分以复合物形式存在。自Wang 等从前列腺组织内分离和提纯PSA 以来,其已广泛应用于前列腺癌的筛选、诊断[5]。此外,随着超声技术的发展,经直肠超声引导下前列腺穿刺活检进一步提高了前列腺肿瘤的检出率[6-8]。

表2 患者无生化复发生存率单因素分析 %
前列腺癌治疗方案依据通常结合患者年龄、肿瘤分期、病理分级等情况[9-11]。对于晚期前列腺癌,在增加放疗剂量以提高局部控制率的基础上,联合内分泌治疗相比单纯放疗能潜在提高患者无生化复发生存期和总生存率[12-14]。Cahlon等[15]回顾478例局限性前列腺癌患者接受86.4剂量IMRT 治疗,中、高危险组5年控制率分别为85%和70%。另一方面,NHT 常采用药物去势-LHRH-A 联合抗雄激素药物,后者能通过阻断前列腺靶组织中雄激素受体,达到抑制肾上腺源性雄激素释放效应。卢可士等[16]报道了13例接受IMRT 治疗前列腺癌患者(Gleason 评分均≥6 分,均行抗雄激素治疗)的1 和3年总生存率分别为92.3% 和84.6%。本研究中,Gleason 评分均≥7 分患者1 和3年生存 率分别 为92.0% 和84.8%。此外,本研究还观察了不同NHT 时间下对患者PSA 和前列腺体积的影响。结果显示,放疗前B组PSA 水平下降程度大于A组,但组间前列腺体积变化差异无统计学意义。相关研究提示,NHT 治疗后PSA 降低可分为速降阶段和缓降阶段,且降低程度和NHT 治疗时间有关[17]。研究还报道,NHT 可以使前列腺体积缩小20%~50%,缩小程度与病理分期有关[18]。此外,前列腺癌放疗并发症主要为前列腺周围器官受损所致的相应临床症状[19],以尿频和直肠炎常见,但IMRT 能减少前列腺周围正常组织的照射剂量,降低并发症发生风险。本研究中尿频和肠炎发生率较高,分别为24.1%和25.9%,可能和高照射剂量(76~82 Gy)使用有关。
前列腺癌局部放疗后部分患者可出现生化复发,放疗后PSA nadir 是评价生化复发的重要指标[20]。也有研究指出,内分泌治疗时间(>3 个月)、放疗前无生化失败是提高3年期生存率的相关因素[21]。本研究结果显示,放疗前PSA 水平、危险分组、NHT 治疗时间是无生化复发生存的影响因素,与钟秋子[22]报道基本一致。
综上所述,调强放疗联合新辅助内分泌方法治疗局限期前列腺癌疗效显著且相对安全,调强放疗前行NHT 能有效控制PSA 水平,改善生存结局。
[1]Brawley O W.Prostate cancer epidemiology in the United States[J].World J Urol,2012,30(2):195.
[2]Baade P D,Youlden D R,Krnjacki L J.International epidemiology of prostate cancer:geographical distribution and secular trends[J].Mol Nutr Food Res,2009,53(2):171.
[3]Tammela T L.Endocrine prevention and treatment of prostate cancer[J].Mol Cell Endocrinol,2012,360(1/2):59.
[4]王道元,乔保平,孙如坤,等.前列腺特异性抗原相关变数与前列腺癌Gleason 评分及临床分期的关系[J].郑州大学学报:医学版,2012,47(4):537.
[5]Heidenreich A,Bellmunt J,Bolla M,et al.EAU guidelines on prostate cancer.Part 1:screening,diagnosis,and treatment of clinically localised disease[J].Eur Uro,2011,59(1):61.
[6]费翔,唐杰,李岩密,等.经直肠前列腺超声造影在鉴别诊断前列腺癌与前列腺增生中的价值[J].中华超声影像学杂志,2010,19(7):596.
[7]张昊,张庄文,莫正雄,等.经尿道等离子前列腺剜除术治疗前列腺增生症的初步报告[J].中华全科医学,2011,9(11):1704.
[8]方文革,关超,许海斌,等.经尿道等离子前列腺剜除术治疗良性前列腺增生症[J].中华全科医学,2010,8(12):1518.
[9]刘文才.经尿道前列腺等离子双极电切术与常规电切术治疗良性前列腺增生症疗效比较[J].海南医学院学报,2011,17(11):1519.
[10]张磊.舒芬太尼用于前列腺电切术后镇痛的临床研究[J].中华全科医学,2010,8(11):1381.
[11]刘华,潘海龙.护理干预对经尿道前列腺电切术后常见并发症的效果观察[J].实用临床医药杂志,2013,17(12):99.
[12]Grubisha M J,DeFranco D B.Local endocrine,paracrine and redox signaling networks impact estrogen and androgen crosstalk in the prostate cancer microenvironment[J].Steroids,2013,78(6):538.
[13]张世革,王久林,吴烨,等.前列腺癌内分泌治疗的生存随访[J].中华男科学杂志,2013,19(12):1103.
[14]Denham J W,Steigler A,Lamb D S,et al.Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer:10-year data from the TROG 96.01 randomised trial[J].The lancet oncology,2011,12(5):451.
[15]Cahlon O,Zelefsky M J,Shippy A,et al.Ultra-high dose(86.4 Gy)IMRT for localized prostate cancer:toxicity and biochemical outcomes[J].Int J Radiat Oncol Biol Phys,2008,71(2):330.
[16]卢可士,陈明坤,秦自科,等.调强适形放疗治疗前列腺癌的临床疗效分析(附13例报告)[J].现代泌尿外科杂志,2011,16(2):108.
[17]侯瑞鹏,李健,王凤玮,等.不同时间新辅助内分泌治疗联合调强放疗对局部晚期前列腺癌疗效的影响作用[J].中华泌尿外科杂志,2012,33(5):369.
[18]Hsu C Y,Joniau S,Roskams T,et al.Comparing results after surgery in patients with clinical unilateral T3a prostate cancer treated with or without neoadjuvant androgen-deprivation therapy[J].BJU international,2007,99(2):311.
[19]Nath S K,Sandhu A P,Rose B S,et al.Toxicity analysis of postoperative image-guided intensity-modulated radiotherapy for prostate cancer[J].Int J Radiat Oncol Biol Phys,2010,78(2):435.
[20]Huang S P,Bao B Y,Wu M T,et al.Impact of prostate-specific antigen (PSA)nadir and time to PSA nadir on disease progression in prostate cancer treated with androgen-deprivation therapy[J].Prostate,2011,71(11):1189.
[21]高鸿,李高峰,吴钦宏,等.调强放疗联合新辅助内分泌方法治疗局限期前列腺癌的生存分析[J].中华放射肿瘤学杂志,2010 (2):127.
[22]钟秋子,李高峰,徐勇刚,等.62例前列腺癌三维适形或调强放疗的临床研究[J].中华放射肿瘤学杂志,2010(3):231.
