熊去氧胆酸联合异甘草酸镁干预四氯化碳诱导小鼠急性肝损伤研究
2015-03-02王淑萍黄全祥张宏岐
王淑萍,黄全祥,张宏岐
(湖北省宜昌市第三人民医院1.肝病科,2.药剂科,湖北 宜昌 443000;3.三峡大学医学院 药学系,湖北 宜昌 443000)
急性肝损伤是各种肝脏疾病的发生、发展及最终走向肝功能衰竭的始动环节和共同途径[1]。急性肝损伤为慢性肝病基础,可引起急性肝功能受损及病理组织学异常,一直是全球关注的热点研究方向[2]。临床研究表明,熊去氧胆酸(UDCA)对于慢性肝病具有良好的治疗效果,其主要通过无毒性的UDCA 替换或清除毒性胆汁酸,阻止胆管上皮细胞凋亡而发挥作用,在临床上得以广泛应用[3-4]。异甘草酸镁(MgIG)是甘草酸单一立体异构体镁盐,在临床治疗多种肝损害均具有较显著的疗效,不良反应少,与其他护肝类药物联用,疗效可有明显提高[5-6]。目前有关二者联用的相关报道较少,本研究通过探讨UDCA 联合MgIG 干预小鼠急性肝损伤的疗效,为有效治疗慢性肝脏疾病提供理论依据。
1 材料与方法
1.1 实验动物
SPF 级雄性小鼠50 只,18~22 g,购于三峡大学实验动物中心,合格证号:SYXK(鄂)2011-0061,采用12 h 昼夜交替照明,环境温度:(22±4)℃,湿度:40%~50%。
1.2 主要试剂与仪器
主要试剂:UDCA 胶囊购自德国福克药厂;MgIG 购自江苏正大天晴药业股份有限公司;丙氨酸氨基转移酶(ALT)试剂盒、天门冬氨酸氨基转移酶(AST)试剂盒、总蛋白含量测定试剂盒、丙二醛(MDA)含量测定试剂盒、总抗氧化能力(TAOC)测定试剂盒、谷胱甘肽过氧化物酶活性(GSH-PX)测定试剂盒,均购自南京建成生物工程研究所。
主要仪器:Stat Fax-2100 型酶标仪(单通道),美国Awareness 公司;U-3010 紫外-可见分光光度计,日本Hitachi High-Technol 公司。
1.3 实验方法
随机将50 只小鼠分为空白组、模型组、UDCA组、MgIG组、联合组5组,每组10 只。给药组每日分别灌胃给予UDCA 25 mg/kg、MgIG 5 mg/kg、UDCA25 mg/kg+MgIG15 mg/kg,1 次/d,连续3 d,每只0.2 mL,空白组和模型组灌胃给予等体积生理盐水。末次给药1 h 后,空白组腹腔注射生理盐水0.1 mL/10 g,其余各组腹腔注射0.1%CCl4花生油溶液0.1 mL/10 g[7],禁食不禁水,16 h 后摘眼球取血,离心取血清,置4 ℃保存备用;同时立即剖腹取肝脏,4 ℃预冷生理盐水冲洗,滤纸拭干、称重,计算肝脏指数(肝重/体重×100%)。其中每只小鼠称取肝脏小叶0.5 g,加预冷的9 倍体积的0.86%生理盐水于玻璃匀浆器中匀浆,2500 r/min 离心10 min,上清液置4 ℃保存备用。其余肝组织于4%多聚甲醛固定液中固定24 h,用水冲洗后经梯度乙醇脱水,二甲苯透明,进行石蜡包埋处理后切成4 μm 厚的薄片。
1.4 观察指标
改良赖氏法测定血清ALT、AST,考马斯亮蓝法测定蛋白含量。血清ALT、AST,肝组织MDA含量、SOD、T-AOC、GSH-PX 的测定均严格按试剂说明书进行操作。采用苏木精-伊红染色、Masson三色染色观察肝组织变化。
1.5 统计学方法
实验数据应用SPSS 19.0 处理,定量资料采用均数±标准差()表示,组间均数比较采用单因素方差分析和t 检验分析组间差异,以P<0.05 为差异有统计学意义。
2 结果
2.1 肝脏指数
结果见表1。各组肝脏指数比较,差异无统计学意义(P>0.05)。
表1 对小鼠肝脏指数的影响(,n=10)

表1 对小鼠肝脏指数的影响(,n=10)
2.2 血清生化指标
模型组血清ALT、AST 含量较空白组明显升高,差异具有统计学意义(P<0.05)。与模型组比较,UDCA组,联合组血清中的ALT、AST 含量均有明显降低,差异具有统计学意义(P<0.01),其 中联合组优于单独用药组(P<0.05 或P<0.01)。见表2。
表2 对小鼠血清ALT、AST 的影响(,n=10)

表2 对小鼠血清ALT、AST 的影响(,n=10)
与空白组比较* P<0.05;与模型组比较##P<0.01;与UDCA组,△P<0.05;与MgIG组比较,▲P<0.05,▲▲P<0.01。
2.3 肝组织匀浆指标
与空白组比较,模型组肝组织MDA 含量升高,SOD、T-AOC、GSH-PX 活性降低(P<0.01);各给药组肝组织MDA 含量与模型组比较均有所降低,SOD、T-AOC、GSH-PX 活性有所增加(P<0.01),其中联合组MDA 降低较UDCA组明显(P<0.05)。见表3。
2.4 组织病理学观察
苏木精-伊红染色结果显示:空白组小鼠肝脏结构正常,肝细胞排列整齐有序,未见明显病变部位,及坏死细胞、成纤维细胞存在;模型组在汇管区可见明显坏死病灶,肝组织结构发生明显变化,形成完整假小叶,肝细胞排列混乱,失去正常肝组织所具有的放射状排列;MgIG组、UDCA组和联合组肝脏病变程度均明显减轻,坏死肝细胞明显减少,脂肪化程度减轻,肝细胞排列紊乱情况有所改善。联合组效果最佳。见图1。
表3 对小鼠肝组织中MDA、SOD、T-AOC、GSH-PX 的影响(,n=10)
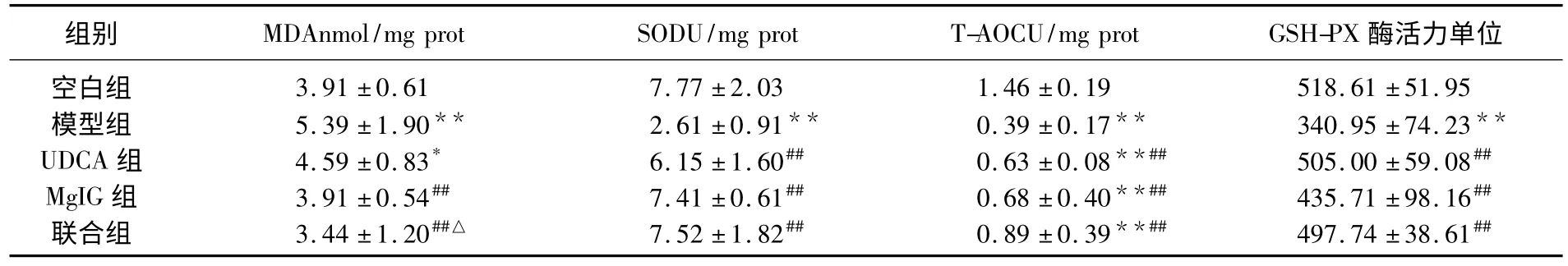
表3 对小鼠肝组织中MDA、SOD、T-AOC、GSH-PX 的影响(,n=10)
与空白组比较,**P<0.01;与模型组比较,##P<0.01;与UDCA组,△P<0.05。

图1 药物对小鼠肝组织病变程度的影响 HE 染色,100 倍
Masson 三色染色结果显示:空白组小鼠肝脏组织正常,无明显可见胶原沉积;模型组小鼠肝脏中存在大量胶原沉积,且相互连接成网状;用药组胶原沉积情况明显少于模型组,见图2。
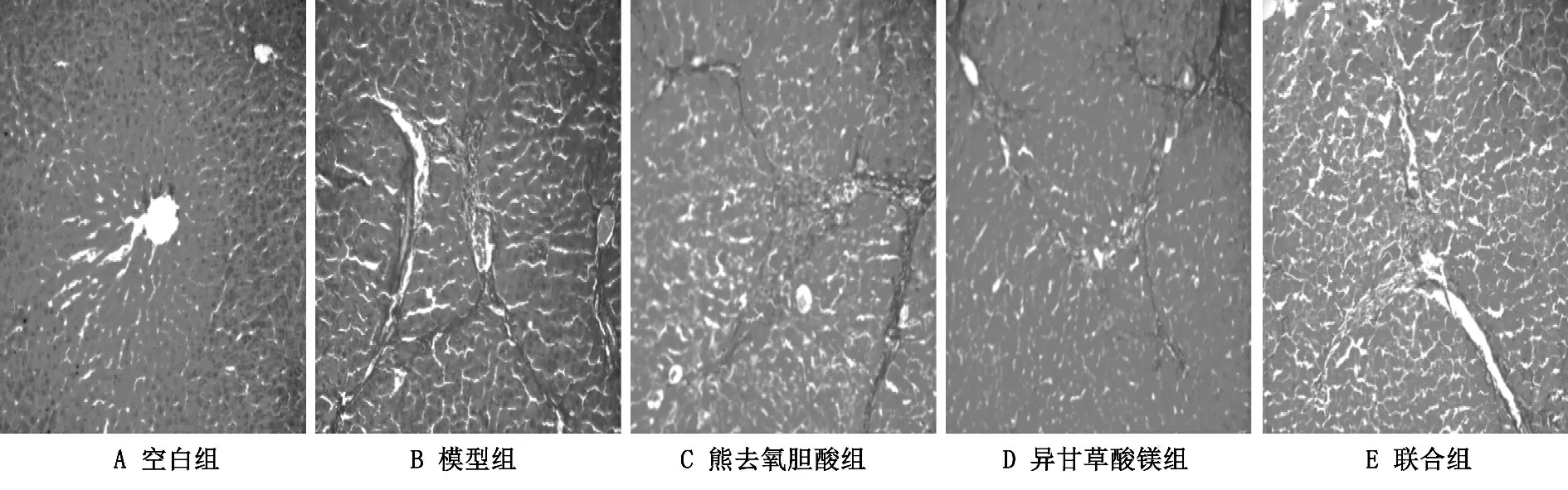
图2 药物对小鼠肝组织病变程度的影响 Masson 三色染色,100 倍
对各组肝脏切片采用DMR 显微图像分析系统进行胶原沉积面积积分,结果用药各组小鼠肝组织中胶原组织含量均有一定降低,与模型组比较差异具有统计学意义(P<0.05 或P<0.01),MgIG组、联合组效果优于UDCA组(P<0.01),见表4。
表4 药物对小鼠肝组织胶原面积的影响(,n=10)
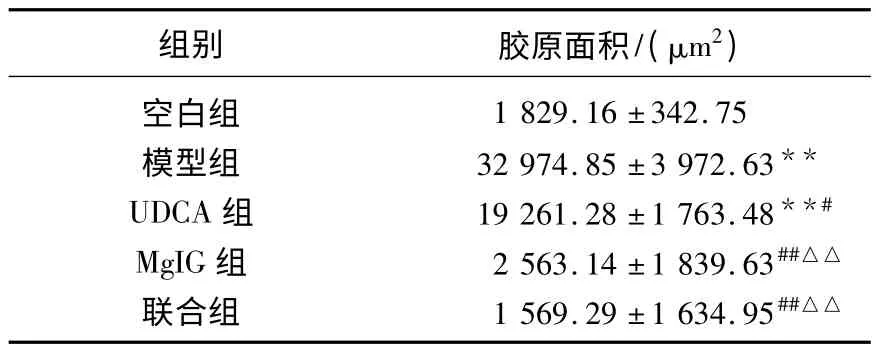
表4 药物对小鼠肝组织胶原面积的影响(,n=10)
与空白组比较,* P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与UDCA组,△△P<0.01。
3 讨论
肝损伤是由各种肝脏疾病所产生的病变结果,常见的包括病毒性肝损伤、药物性肝损伤、酒精性肝损伤和免疫性肝损伤[8],其主要表现为脂肪肝、胆汁郁积、肝坏死、肝纤维化、肝硬化甚至肝癌等[9]。
UDCA 为胆汁淤积性肝病内科治疗的常用药物。研究显示,UDCA 对胆管结扎、CCl4、酒精诱导的肝损伤动物模型都有显著治疗作用[10-11]。其作用机制主要通过抑制肝脏氧自由基,减少TNFα 和TGF-β1等细胞因子的产生[12],诱导肝纤维细胞凋亡发挥保肝作用[13]。MgIG 具有较强的抗炎、保护肝细胞膜及改善肝功能的作用,常用于多种原因所致的肝功能异常[14],还具有类糖皮质激素的作用,可通过免疫调节等作用降低化疗后的不良反应,且能有效减少肝细胞变性、坏死及炎症细胞浸润,促进肝细胞再生[15]。
本研究显示,UDCA、MgIG 能有效提升因注射CCl4而降低的SOD 和GSH-PX 活性,加快肝组织中超氧阴离子的清除速度,保护肝细胞免受过氧化损伤;各给药组小鼠肝组织T-AOC 提升,说明药物不仅能促进自由基清除,还能阻断过氧化链,提升小鼠机体整体的对抗氧化应激的水平。UDCA 与MgIG 联合用药能显著降低模型组小鼠血清ALT、AST 水平和过氧化物终产物MDA 的含量,病理学检查提示联合用药组肝细胞变性、坏死及炎细胞浸润明显减轻,病变程度明显降低。表明UDCA、MgIG 具有协同作用,联合应用对CC14所致小鼠急性化学性肝损伤具有保护作用及抗纤维化作用,其机制可能与其清除自由基、提高抗氧化酶活性等有关。
[1]Hemandez-Gea V,Friedman S L.Pathogenesis of liver fibrosis[J].Annu Rev Pathol.,2011,6:425.
[2]明雅南,刘晓琳,茅益民.药物性肝损伤发病机制研究进展[J].实用肝脏病杂志,2014,17(6):657.
[3]Tsochatzis EA,Feudjo M,Rigamonti C,et al.Ursodeoxycholic acid improves bilirubin but not albumin in primary biliary cirrhosis:further evidence for nonefficacy[J].Biomed Res Int,2013:139763.
[4]He H,Mennone A,Boyer J L,et al.Combination of retinoic acid and ursodeoxycholic acid attenuates liver injury in bile duct-ligated rats and human hepatic cells[J].Hepatology,2011,53:548.
[5]刘林,秦建军,史树堂等.肝损伤动物模型制作的研究进展[J].医学研究与教育,2009,26(5):49.
[6]宋佳伟,邢蓉.异甘草酸镁的药理与临床[J].中国新药与临床杂志,2012,31(10):579.
[8]Buko V U,Kuzmitskaya-Nikolaeva A,Naruta EE,et al.Ursodeoxycholic acid dose-dependently improves liver injury in rats fed a methionine and choline[J].Hepatol Res,2011,41:647.
[9]Buko V U,Lukivskaya O Y,Zavodnik L B,et al.Antioxidative effect of ursodeoxycholic acid in the liver of rats with oxidative stress caused by gamma-irradiation[J].Ukr Biokhim Zh,2002,74:88.
[10]陈建清,胡良凯,张建民.熊去氧胆酸在胆汁淤积性肝病中的应用[J].国际消化病杂志,2014,28(6):474.
[11]谢程航.熊去氧胆酸联合常规基础治疗肝硬化临床疗效观察[J].现代诊断与治疗,2014,25(17):3949.
[12]Buko V U,Lukivskaya O Y,Naruta E E,et al.Protective effects of norursodeoxycholic acid versus ursodeoxycholic acid on thioacetamide-induced rat liver fibrosis[J].J Clin Exp Hepatol,2014,4(4):293.
[13]Mas N,Tasci I,Comert B,et al.Ursodeoxycholic acid treatment improves hepatocyte ultrastructure in rat liver fibrosis[J].World J Gastroenterol,2008,14:1108.
[14]贺延新,赵清喜,娄渊贵.异甘草酸镁联合熊去氧胆酸治疗自身免疫性肝炎肝硬化失代偿期的疗效观察[J].黑龙江医药科学,2012,35(2):11.
[15]Huang X,Qin J,Lu S.Magnesium isoglycyrrhizinate protects hepatic L02 cells from ischemia/reperfusion induced injury[J].Int J Clin Exp Pathol,2014,7(8):4755.
