治愈1型糖尿病离我们有多远?
2015-03-02季荔杨涛
季荔 杨涛
南京医科大学第一附属医院内分泌科
治愈1型糖尿病离我们有多远?
季荔 杨涛
南京医科大学第一附属医院内分泌科
Cure for Type 1 diabetes: beyond Insulin

杨 涛 主任医师,教授,博士生导师;曾在美国科罗拉多大学Barbara Davis 糖尿病中心做博士后研究,现任南京医科大学第一附属医院/江苏省人民医院内分泌科主任;国际自身免疫糖尿病学会(IDS)胰岛自身抗体工作组(IASP)委员,国际胰腺胰岛移植学会(IPITA)委员,中华医学会糖尿病学分会委员、1型糖尿病学组副组长,中华医学会内分泌学分会委员、糖尿病学组副组长,江苏省医学会内分泌学分会副主任委员,南京市医学会内分泌学分会主任委员;全国高等学校五年制本科《内科学》教材(第8版)编委,全国高等学校成人专升本《内科学》教材(第3版)主编,《中华内分泌代谢杂志》、《中华糖尿病杂志》、《中国糖尿病杂志》编委;主要研究方向为1型糖尿病免疫治疗和胰岛移植;主持国家“973”前期研究计划1项,国家自然科学基金4项等科研项目,已发表SCI文章43篇。
1型糖尿病(type 1 d iabetes,T1DM)是遗传和环境(包括病毒感染)等多种因素共同作用于易感个体,由自身T淋巴细胞介导的一种器官特异性自身免疫性疾病,从而导致大量胰岛β细胞凋亡、功能衰竭,体内胰岛素绝对分泌不足[1],是儿童和青少年糖尿病的主要类型。随着各国医疗保健服务的普及和诊断技术的不断进步,1型糖尿病的发病率也日益增加[2]。自1921年Ban ting发现胰岛素以来,每日多次皮下注射胰岛素一直是治疗l型糖尿病的最主要手段。而随着新型胰岛素种类的研发和植入式胰岛素泵技术的广泛应用,l型糖尿病患者的血糖较以往得到了更有效的控制。但由于外源性胰岛素的释放不受机体血糖调控,并且随着病程的进展,胰岛功能逐渐衰竭,病程中患者的血糖往往波动较大,各种急、慢性并发症并不能避免[3,4]。因此,随着对1型糖尿病发病机制的深入了解,许多科研工作者都在寻求治疗方法上的新突破,包括以逆转或延缓自身免疫反应为目的的免疫调节治疗和替代胰岛β细胞功能的胰岛移植、干细胞移植等在内的新技术就成为了根治1型糖尿病的新希望。
一、 胰岛移植
胰岛移植最早可以追溯到1894年,由英国医生W illiam s和Harsan t将部分羊胰腺成分移植到1例15岁1型糖尿病少年皮下[5],从此开启了胰腺器官移植的大门。虽然胰腺移植后能生理性调节胰岛素的分泌,使患者术后的生活质量大大改善,但由于其创伤性大,潜在的并发症风险较高,因此,在大多数发达国家,患者更倾向于选择操作简单、创伤性小、免疫抑制剂用量少的胰岛移植。2000年,来自加拿大ALBERTA大学的Shap iro等人提出了著名的Edm on ton方案,即在使用不含糖皮质激素的新型免疫抑制剂(包括雷帕霉素、低剂量他克莫司、人源化白介素-2受体抗体)的情况下,将分离提纯的人胰岛输入糖尿病患者的肝门静脉内,使胰岛附着在肝窦区域并持续分泌胰岛素[6]。该团队对7例有严重低血糖病史和控制不稳定的1型糖尿病患者成功进行了胰岛移植,平均随访时间为11.9个月(4.5~15个月),期间发现所有患者均摆脱了对胰岛素的依赖,未再发生低血糖等严重并发症。虽然大部分患者在移植1年以后又开始接受外源胰岛素治疗,但所需的胰岛素剂量远低于从未接受过胰岛移植的1型糖尿病患者,同时血糖也得到了更有效的控制。之后Edm on ton胰岛移植多中心临床研究结果也显示,胰岛移植1年后44%的患者可不再需要胰岛素注射,28%的患者胰岛素注射剂量减少,另外28%的患者无效,多次胰岛移植后脱离胰岛素注射的比例大大增加。部分患者不依赖胰岛素的时间最长已经超过了5年,少数患者移植6年后胰岛仍能发挥功能并能相对有效地控制血糖。目前,在全世界有上千例患者接受过胰岛移植,大多数是血糖控制较差或有频发低血糖昏迷史的1型糖尿病患者,少数是已经接受过肾移植的糖尿病患者。从血糖控制效果以及脱离或减少外源性胰岛素的使用、严重低血糖反应是否显著减少或消除及生活质量改善、长期微血管并发症的发生风险是否降低等角度来看,胰岛细胞移植可以显著改善1型糖尿病患者的生存时间和生存质量,是1型糖尿病理想的替代治疗方法[7]。
然而深入研究提示,Edm onton方案需要进一步改进完善,Shap iro等报告显示胰岛移植常需要2个以上的胰腺才能获得足够胰岛满足一位患者的需要,这使得原本紧张的供体资源更为稀缺。此外,胰岛细胞移植后,随着移植时间延长,胰岛的作用会逐渐消亡。来自Niclauss N[8]等的研究发现,雷帕霉素会抑制移植后胰岛细胞的再生,表明移植后使用免疫抑制剂,不仅对受体、对移植物也有损伤。此外,选择年龄在45岁及以下的供体进行胰岛细胞移植效果要明显好于老年供体[9]。这都提示增加胰岛移植的供体来源,提高胰岛细胞提取的数量和纯度,开发应用新型免疫抑制剂,降低移植成本等都是研究者们日后需要共同面临的新课题。
为了将胰岛移植更好的推向临床,异种移植、胰岛干细胞移植、微囊化胰岛细胞移植等相关概念也不断被提出。异种胰岛移植胰岛来源主要是猪,与人源化的胰岛相比,异种胰岛细胞来源更广泛。但是降低不同种属的抗原性以减少免疫抑制剂的用量和避免感染猪内源性逆转录病毒(po rcine endogenous retrovirus,PERV)[10]是必须要克服的障碍。胰岛细胞作为一个细胞团,直径是一般细胞的十几倍,可以透过微囊膜与外界进行物质交换,获得营养和排出代谢废物[11],因此,微囊化胰岛移植通过免疫隔离技术抑制移植后免疫排斥反应的发生,可在不使用免疫抑制剂的情况下延长胰岛移植物的存活时间,但该技术目前还缺少公认可靠的治疗效果评估和随访结果。胰岛干细胞[12]是指能分化增殖为可以分泌胰岛素的胰岛组织,或起源于胰腺,具有自我更新复制能力的细胞,将胰岛干细胞移植用于临床不仅解决了供体短缺的问题,而且不存在种属差异及免疫排斥问题,具有巨大的潜力。但是,胰岛干细胞缺乏明确的表面标志,如何采集纯化以大量制备,以及干细胞带来的致癌风险也是需要面对和解决的问题。
二、 干细胞技术
干细胞是一类具有自我更新能力和多向分化潜能的细胞,目前研究较多的是胚胎干细胞和成体干细胞,后者主要包括间充质干细胞、造血干细胞及胰岛干细胞。
(1)胚胎干细胞
胚胎干细胞是来源于人和哺乳动物早期胚囊内细胞团中的一种二倍体细胞,具有分化全能性和无限增生的能力。过去多项研究证实,可以通过基因修饰和蛋白转导技术将胚胎干细胞诱导分化成分泌高水平胰岛素的细胞[13,14],再将这些细胞移植给糖尿病小鼠体内,能使其血糖恢复到正常水平。但是,通过这种方法所获得的胰岛β细胞数量有限,基础胰岛素分泌量和葡萄糖刺激后的胰岛素分泌量均低于正常,并不能完全实现胰岛素分泌的生理性调节,而且目前胚胎干细胞仍停留在动物研究,用于临床治疗还需要解决诸多关键技术和伦理等法律道德问题。
(2)间充质干细胞
间充质干细胞具有自我更新和分化为3个胚层细胞的能力,是胰岛β细胞替代治疗的另一可供选择细胞来源。间充质干细胞除能分化替代β细胞外,还可以迁移到胰腺,分泌多种细胞因子,促进血管生成,改善微环境。此外,间充质干细胞还有一定的免疫调节作用,可以减少自身免疫系统对胰岛的攻击,阻止胰岛β细胞进一步受损[15,16],虽然间充质干细胞的来源丰富,自体移植的免疫排斥较小,但对于它的诱导分化机制仍有争议,治疗所需的细胞移植数量、时间和途径还不统一。
(3)造血干细胞
造血干细胞是所有免疫细胞(包括T淋巴细胞、B淋巴细胞、巨噬细胞、中性粒细胞、树突状细胞、NK细胞)的祖细胞,具有极高的自我更新、多向分化和重建造血的潜能,不仅能分化为胰岛β细胞,还能促进残存的胰岛β细胞的修复及胰腺干细胞向胰岛β细胞分化[17],是目前在糖尿病方面研究最多、技术也较成熟的一种干细胞。虽然造血干细胞移植可使1型糖尿病患者胰岛β细胞功能得到改善,暂时脱离使用胰岛素,但是其跨胚层分化的机制和移植后状态所能维持的时间仍需进一步探讨。
虽然干细胞的研究为治愈1型糖尿病点燃了新的希望,但究竟是干细胞本身发挥作用,还是移植后使用免疫抑制剂对自身免疫反应的抑制和对移植免疫耐受的诱导效应,目前尚不能定论[18]。
三、免疫治疗
从1型糖尿病的自然病程来看,胰岛β细胞的破坏早在高血糖症状出现前就已经存在,随着病程进展,胰岛功能逐渐衰竭。因此,如何阻止对胰岛β细胞的自身免疫攻击,延缓胰岛功能的损伤和下降,是免疫治疗的难点。目前的针对病因的治疗多使用免疫抑制药物(包括环孢素A、抗CD 20单克隆抗体、抗CD 3单克隆抗体及抗胸腺细胞球蛋白等)、广谱细胞因子(TNF-α,IL-1受体拮抗剂,IL-4和IL-10等)及抗原特异性疫苗(包括GAD65-alum及DiaPep277)等,虽然以上方法都取得了一定的疗效,但单药治疗往往不能持久,不良反应也较明显,而不同作用机制的药物联合应用,不仅可以作用于多条通路,并可在更安全的治疗剂量下获得更好的治疗效果。目前能用于联合治疗的药物并不多,主要是由于部分药物还未被批准用于人体。现阶段正在研究的主要有IL-2和雷帕霉素;GAD-a lum、西格列汀和兰索拉唑;表皮生长因子和胃泌素;霉酚酸酯、抗CD25抗体或ATG和Peg filg rastim。基因疗法是近十几年来诞生的一种新型治疗措施,它是指将正常的功能基因或新基因以一定的基因转移方式导入患者体内,表达出患者体内缺失或表达异常的蛋白,重新赋予其正常的或新的生理功能。对于1型糖尿病患者,由于自身免疫攻击的持续存在,移植后的胰岛及干细胞并不能逃避免疫系统的攻击,因此,免疫治疗若能与基因疗法结合,将大大提高治愈1型糖尿病的希望。
1型糖尿病的诊断和治疗一直是江苏省人民医院内分泌科的临床特色技术,我科于2010年成立了专门的胰岛移植团队,并赴加拿大Edm on ton胰岛移植中心进行交流培训。经过前期不断的探索和团队成员共同的努力,现已成功建立了经皮肝穿门静脉人胰岛细胞移植技术,并分别于2012年、2013年成功完成了2例3人次糖尿病肾病肾移植后胰岛移植(图1、2)。术后,两位患者恢复良好,未出现相关并发症及不良反应。患者低血糖反应得到纠正,胰岛素使用剂量较术前显著减少,C-肽水平较前有所提高。患者生活质量得到明显提高。
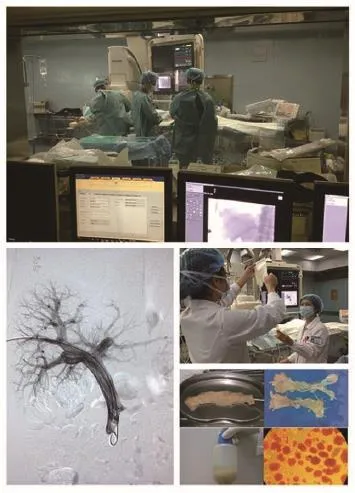
图1

图2
此外,我科于2010年在国内率先开展1型糖尿病免疫治疗(已在Clin icalTrails.gov上注册)首选“小剂量、多疗程”治疗方案对初发1型糖尿病患者进行临床免疫干预治疗(随访中,数据尚未发表),前期结果在多次国际会议交流上得到了各国专家学者的一致肯定。
1型糖尿病的治愈之路是漫长而曲折的,尽管摆在我们面前的难题还有很多,例如,如何寻找和监测抗原特异性T细胞,靶向消除致病性T细胞而不引起其他组织损伤;研究个体基因型和表型间的联系及环境因素对疾病发生发展的影响,从而对1型糖尿病高危人群进行预测并选择最佳治疗的时机;探究T细胞以外的发病机制等等,但我们已经取得了一些可喜的成果,相信随着科技的不断进步,在病程的不同阶段采取联合治疗措施,将有助于找到1型糖尿病根治的方法和出路。
[1] Eisenb a rth GS. Ban tin g Lec tu re 2009: An un fin ished jou rney: m o lecu lar pathogenesis to p reven tion o f type 1A d iabetes. Diabetes. 2010;59(4):759-74.
[2] M aa h s DM, W e s t NA, Law re n ce JM, M aye r-Dav is EJ. Ep id em io log y o f typ e 1 d iabe tes. En d o c rino log y an d m e tab o lism c lin ics o f No rth Am erica. 2010;39(3):481-97.
[3] M aah s DM, Rew e rs M. Ed ito ria l: M o rta lity an d ren a l d isease in typ e 1 d iab e tesm e llitus-p rog ress m ad e, m o re to be d one. The Jou rna l o f c lin ica l endocrino logy and m etabo lism. 2006;91(10):3757-9.
[4] W r it in g Te am fo r t h e D ia b e te s C, Com p lica t io n s Tria l/Ep id em io lo g y o f D iab e tes I, Com p lica tion s Resea rch G. Su stained e ffect o f in ten sive treatm en t o f type 1 d iabe tes m e llitus on deve lopm en t and p rog ression o f d iabetic neph ropathy: the Ep idem io logy o f Diabetes In terven tions an d Com p lica tion s (ED IC) stu d y. Jam a. 2003;290(16):2159-67.
[5] W illiam s P W. No tes On d iabe tes trea ted w ith ex trac t an d b y g ra fts o f sh eep’s pancreas. BM J, 1894, 12:1303-1304.
[6] Sh a p iro AM, La k e y JR,Ry a n EA, e t a l. Isle t transp lan tation in seven patien ts w ith typ e 1 d iab e tes m e llitu s u sin g a g lu co co rtico id-free im m unosu p p ressive reg im en. N Eng l J M ed, 2000,343: 230-238.
[7] Ha r lan DM, Ken yon NS, Ko rsg ren O, e t a1. Cu rren t ad van ces and travails in islet transp lan ta tion. Diabe tes, 2009, 58:2175-2184.
[8] N ic lau ss N, Bo sco D, M o re l P, e t a1. Ra p am y c in Im p a irs Pro life ra t io n o f Transp lan tation Isle t ce lls. Transp lan tation, 2011, 91(7):714-722.
[9] N ic lau ss N, Bo sco D, M o re l P, e t a1. In fluence o f dono r age on islet iso lation and transp lan tation ou tcom e. Transp lan tation, 201I, 91(3):360-366.
[10] M iy a g aw a S, N a k a tsu S, H a zam a K, e t a1. A n o ve l st ra teg y fo r p reven tin g PERV t ran sm issio n to h um an ce lls b y rem ode ling the viral enve lope g lycop ro tein. Xenotransp lantation, 2006, 13(3):258-263.
[11] Sig rist S, M ech ine-Neuv ille A, M and es K, e t a l. In fluen ce o f VEGF o n th e v iab ility o f en cap su la ted p an crea tic ra t isle ts a fte r tran sp lan ta tion in d iab e tic m ice. Ce ll Transp lant, 2003,12(6).
[12] Lum e lsk y N, B lo n d e l O, Laen g P, e t a l. Diffe ren tia tion o f em b ryon ic stem ce lls to in su lin-se c re tin g st ru c tu res sim ila r to p a n c re a t ic is le ts. Sc ie n c e, 2 0 0 1, 292(5520):1389-1394.
[13] M iy a za k i S, Yam a to E, M iy a za k i J. Regu lated exp ression o f p d x-1 p rom o tes in vitro d iffe ren tiation o f insu lin-p rodu cing ce lls from em b ryon ic stem ce lls. Diabe tes, 2004; 53(4):1030-1037.
[14] Kw on YD, Oh SK, Kim HS, e t a1. Ce llu la r m an ipu lation o f hum an em b ryonic stem ce lls b y TAT-PDX1 p ro te in tran sd u c tion. M o l, Ther. 2005;12(11):28-32.
[15] Nesha ti Z, M a tin MM, Bah ram i AR, e t a l. Differen tiation o f m esenchym al stem cells to insu lin-p roducing cells and their im pact on typ e 1 d iabe tic rats. Physio l Biochem.2010; 66(2):181-187.
[16] Ito T, Ita k u ra S, To d o ro v I, e t a l. M e se n ch ym a l s tem ce ll an d is le t cot ra n s p la n t a t io n p r om o t e s g r a f t re v a s c u la r iz a t io n a n d fu n c t io n. Transp lantation, 2010;89(12):1438-45.
[17] H u a n g Y, K u c ia M, H u s s a in LR, e t a l. Bo n e m a r row t ran sp lan ta t io n tem po rarily im p roves pancreatic fun ction instrep tozo tocin-induced d iabetes: po ten tial in vo lvem en t o f ve ry sm a llem b ryo n iclikece lls.Transp lan tation.2010;89(6): 677-685.
[18] Gra tw oh l A, Passw eg J, Bo ce lli-Tyn d a ll C, e t a l. Au to logous hem a top o ie tic stem cell transp lan tation fo r au toimm une d iseases. Bone Marrow Transp lan t. 2005; 35(9):869-879.
10.3969/j.issn.1672-7851.2015.01.018
