注射用灯盏花素豚鼠全身主动过敏性试验评价方法的比较
2015-03-02杨春雷骆永伟贾玉玲孙祖越
周 莉, 王 永, 杨春雷, 骆永伟,2, 姜 娟, 贾玉玲, 桂 博, 孙祖越
(1. 上海市计划生育科学研究所药理毒理学研究室, 中国生育调节药物毒理检测中心, 上海 200032;2. 复旦大学药学院, 上海 201203; 3. 昆明龙津药业股份有限公司, 云南 昆明 650101)
注射用灯盏花素豚鼠全身主动过敏性试验评价方法的比较
周 莉1, 王 永1, 杨春雷3, 骆永伟1,2, 姜 娟1, 贾玉玲1, 桂 博1, 孙祖越1
(1. 上海市计划生育科学研究所药理毒理学研究室, 中国生育调节药物毒理检测中心, 上海 200032;2. 复旦大学药学院, 上海 201203; 3. 昆明龙津药业股份有限公司, 云南 昆明 650101)
目的 通过《中国药典》2010年版一部附G中药注射液安全性检查法应用指导原则中 “过敏反应检查法”(以下简称为“药典法”)和《中药、天然药物免疫毒性(过敏性、光过敏反应)研究的技术指导原则》2005版中载明的方法(以下简称为“指导原则法”)分别评价并比较灯盏花素对豚鼠全身过敏反应,为药物临床前安全评价提供参考。方法 将豚鼠分为阴性对照组、阳性对照组、注射用灯盏花素5和50 mg·kg-1组,分别按照“药典法”和“指导原则法”观察豚鼠对注射用灯盏花素全身主动过敏反应。致敏阶段,豚鼠ip给予注射用灯盏花素溶液每只0.5 mL,剂量分别为5和50 mg·kg-1,隔日1次,共3次。“药典法”在首次致敏后第14和21天ip给予注射用灯盏花素每只1 mL激发;“指导原则法”在末次注射后第12天激发1次,观察豚鼠的过敏症状和过敏时间。结果 “药典法”:第1次激发(首次致敏后第14天)注射用灯盏花素5 mg·kg-1组在不同时间点出现喷嚏1声和(或)搔鼻1次的现象,注射用灯盏花素50 mg·kg-1组不同时间点出现喷嚏1声或2声和(或)搔鼻1次等现象,判定过敏反应阴性。第2次激发(首次致敏后第21天)灯盏花素5 mg·kg-1组给药后分别在不同时间点出现发抖、喷嚏1声或2声和(或)搔鼻1次的现象,判定过敏反应阴性;注射用灯盏花素剂量50 mg·kg-1组4只豚鼠(4/4)给药后在不同时间点分别出现喷嚏1声和3声、咳嗽1声和2声、搔鼻1次以及排尿等现象;1只豚鼠(1/4)出现连续喷嚏3声和发抖,判定过敏反应阳性。“指导原则法”:末次注射后第12天激发,注射用灯盏花素5 mg·kg-1组激发后10 min内均出现了不同程度的过敏反应症状,其中3只豚鼠出现搔鼻症状,为弱阳性;3只豚鼠出现喷嚏和(或)排尿症状,为阳性。注射用灯盏花素50 mg·kg-1组过敏症状包括搔鼻、喷嚏、咳嗽和(或)排尿症状,为阳性。结论 在进行临床前安全性评价豚鼠全身过敏试验过程中,从动物数量、评定标准、观察时间和剂量设置等多方面要采取2种方法的优势,利用“药典法”对供试品进行初筛,一旦有疑似反应,最好采用“指导原则法”进行更加细致的观察。
灯盏花素; 超敏反应; 药物评价, 临床前
超敏反应指机体受同一抗原再刺激后产生的一种表现为组织损伤或生理功能紊乱的特异性免疫反应,是异常或病理性免疫反应[1]。过敏试验是药物临床前安全性研究中一项重要的内容。近年来发现,临床前中药注射剂安全性评价过敏反应的高阴性率与临床出现较多过敏反应的结果不一致的现象,促使研究人员思考如何提高临床前过敏试验灵敏度[2]以及《中国药典》2010年版一部附G中药注射液安全性检查法应用指导原则中 “过敏反应检查法”(以下称“药典法”)[3]和《中药、天然药物免疫毒性(过敏性、光过敏反应)研究的技术指导原则》(以下称“指导原则法”)[4]中收载的豚鼠过敏试验方法是否能严格控制药品的安全性,以及与过敏反应与实验方案中的剂量设计、激发途径和致敏次数等是否有关等问题。注射用灯盏花素(野黄芩苷)是从菊科植物灯盏花中提取的黄酮类活性成分制成的中药制剂,具有轻度强心、扩张微细血管、提高心肌功能、改善心脑供血和降低白细胞自发活化率等药理作用,临床上常用于心脑血管疾病的治疗。近年来,注射用灯盏花素等中药注射剂在临床上广泛应用,不良反应报道也逐渐增多,主要表现为皮肤瘙痒、荨麻疹和过敏性皮炎等过敏样反应。本研究参照“药典法”和“指导原则法”2种评价方法,对注射用灯盏花素的全身主动过敏反应差异进行比较,并为临床前安全性评价研究中全身主动过敏试验评价方法提供参考。
1 材料与方法
1.1 动物豚鼠(Hartley品系,0009131),56只,雌雄各半,4月龄,上海生旺实验动物养殖有限公司,动物生产许可证号:SCXK(沪)2007-0007。豚鼠饲养在上海市计划生育科学研究所(中国生育调节药物毒理检测中心)普通级动物房,动物使用许可证号:SYXK(沪)2008-0027,室温18~28℃,相对湿度40%~70%,光照12~14 h,黑暗10~12 h。豚鼠饲养于400 mm×350 mm×200 mm塑料笼内,同性别豚鼠每组1笼,实验前检疫观察6 d。
1.2 主要试剂注射用灯盏花素(批号:20100127),昆明龙津药业股份有限公司;阳性对照牛血清白蛋白(批号:0332),上海日出生物科技有限公司;溶媒:生理盐水(批号:C10112606),山东华鲁制药有限公司。
1.3 药典法
1.3.1 分组根据体质量将豚鼠随机分为4组,分别为阴性对照组、阳性对照组、注射用灯盏花素5和50 mg·kg-1组,每组8只,雌雄各半。
1.3.2 剂量设置依据根据“药典法”,注射用灯盏花素加氯化钠注射液配制成含灯盏花素3 g·L-1的溶液,每只豚鼠每次给予0.5 mL进行致敏,给予1.0 mL进行激发;按照豚鼠平均体质量300 g计算,每只给予0.5 mL,则相当于灯盏花素5 mg·kg-1。临床试用方案:注射用灯盏花素的临床使用剂量为每人20~50 mg·d-1,每天1次,iv,按人均体质量60 kg计算,临床使用剂量为每天0.33~0.83 mg·kg-1。根据现有资料,以临床最大使用剂量设为豚鼠给药的最低剂量,约为1 mg·kg-1,以5倍的间距向上作为第2和第3剂量,第4剂量设为第3剂量的2倍,本试验选取第2和第4剂量考察在同种剂量下比较2种过敏反应评价方法的差异。给药容积0.5 mL;激发剂量均为致敏剂量的2倍,给药容积1.0 mL。
1.3.3 试验方法致敏阶段,豚鼠ip给予注射用灯盏花素溶液每只0.5 mL,剂量分别为5和50 mg·kg-1,隔日1次,共3次。溶媒对照组和阳性对照组给药方法和给药体积同注射用灯盏花素5和50 mg·kg-1组,阳性对照组每只给予牛血清白蛋白1~5 mg。激发阶段,将致敏的豚鼠分为2组,每组4只,分别在首次致敏后第14和21天每只豚鼠iv给予注射用灯盏花素1 mL激发,注射用灯盏花素5和50 mg·kg-1组激发剂量分别为10和100 mg·kg-1,为致敏剂量的2倍。
1.3.4 结果评价iv给予灯盏花素溶液30 min内,不得出现过敏反应,如同一只豚鼠出现竖毛、发抖、干呕、连续喷嚏3声、连续咳嗽3声、发绀和呼吸困难等现象中的2种或2种以上,或出现两便失禁、步态不稳或倒地、抽搐、休克和死亡现象之一者,判定灯盏花素的过敏反应呈阳性。
1.4 指导原则法
1.4.1 分组根据体质量将豚鼠随机分为4组,分别为阴性对照组、阳性对照组、注射用灯盏花素5和50 mg·kg-1组,每组6只,雌雄各半。
1.4.2 剂量设置依据根据指导原则法的要求,致敏采用2个剂量,低剂量组一般给予临床最大剂量,高剂量组给予低剂量的数倍量,激发剂量一般为致敏剂量的2~5倍量,给药容积1~2 mL;临床试用方案:人临床iv剂量为每人20~50 mg。
1.4.3 试验方法致敏阶段,豚鼠iv给予注射用灯盏花素溶液,注射剂量为5和50 mg·kg-1,隔日1次,共3次。阴性对照组和阳性对照组给药方法和给药体积同注射用灯盏花素5和50 mg·kg-1组,阳性对照组每只给予牛血清白蛋白1~5 mg。激发阶段,末次注射后第12天激发1次,注射用灯盏花素5和50 mg·kg-1组激发剂量分别为20和200 mg·kg-1,为致敏剂量的4倍。
1.4.4 结果评定致敏期间,每天观察每只豚鼠的症状。初次、最后1次致敏和激发当天测定每只豚鼠的体质量。激发阶段,静脉注射后立刻按表1症状详细观察每只豚鼠的反应、症状的出现和消失时间,一般应观察3 h。按表2判断过敏反应的发生程度。计算过敏反应的发生率。根据过敏反应发生率和发生程度进行综合判断;激发注射后,若发现有过敏反应症状时,可取健康未致敏豚鼠2只,自iv给予激发剂量的注射用灯盏花素,观察有无由于注射用灯盏花素引起的类似过敏反应症状,以供结果判断时参考。
Tab.1 Anaphylactic score and symptoms[4]

ScoreSymptom0Normal1Alysmus2Piloerection3Trembling4Scratchingnose5Sneezing6Cough7Ecphysesis8Micturition9Defecation10Lacimation11Dyspnea12Wheezingrale13Peliosis14Instabilityofgait15Leap16Pant17Convulsion18Circumgyration19Cheyne⁃Stokessign20Death
Tab.2 Criterion of active systemic anaphylaxis[4]
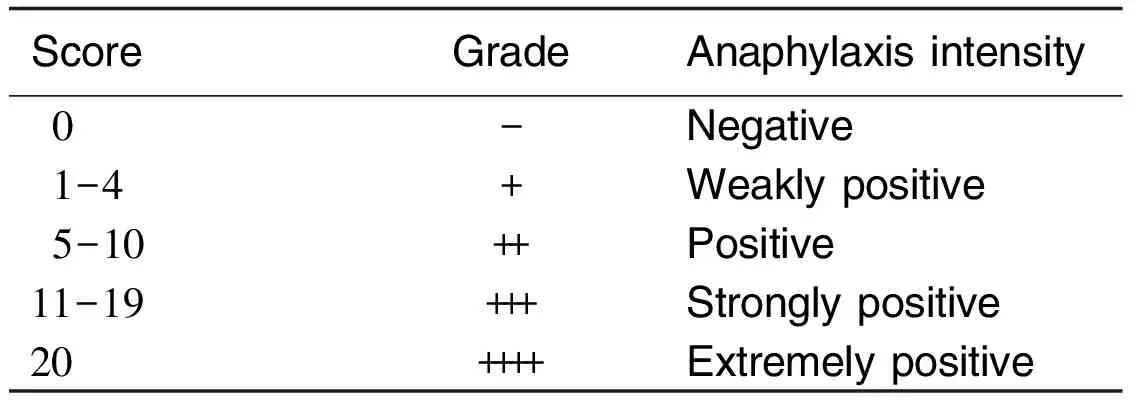
ScoreGradeAnaphylaxisintensity0-Negative1-4+Weaklypositive5-10++Positive11-19+++Stronglypositive20++++Extremelypositive
2 结果
2.1 致敏阶段两种试验方法中,豚鼠iv给予注射用灯盏花素,未观察到豚鼠出现明显异常。
2.2 “药典法”激发豚鼠过敏症状
2.2.1 第1次(首次致敏后第14天)激发豚鼠过敏症状溶媒对照组豚鼠在激发后30 min内均未见明显异常和过敏体征出现;阳性对照组4只豚鼠(4/4)在激发后30 min内均出现了不同程度的过敏体征,包括频繁搔鼻、连续喷嚏3声、连续咳嗽3声、发绀、呼吸困难、步态不稳或倒地、痉挛或抽搐和死亡(1/4);注射用灯盏花素5 mg·kg-1组2只豚鼠(2/4)给药后分别在不同时间点出现喷嚏1声和(或)搔鼻1次的现象;注射用灯盏花素50 mg·kg-1组4只豚鼠(4/4)分别在不同时间点出现喷嚏1声或2声和(或)搔鼻1次等现象;1只豚鼠(1/4)频繁搔鼻,3只豚鼠(3/4)连续喷嚏3声(表3)。
2.2.2 第2次(首次致敏后第21天)激发豚鼠过敏症状溶媒对照组豚鼠在激发后30 min内均未见明显异常和过敏体征出现;阳性对照组4只豚鼠(4/4)在激发后30 min内均出现了不同程度的过敏体征,包括频繁搔鼻、连续喷嚏3声、连续咳嗽3声、发绀、呼吸困难、步态不稳或倒地、痉挛或抽搐,甚至死亡(1/4);注射用灯盏花素5 mg·kg-1组3只豚鼠(3/4)给药后分别在不同时间点出现发抖、喷嚏1声或2声和(或)搔鼻1次的现象;注射用灯盏花素50 mg·kg-1组4只豚鼠(4/4)给药后在不同时间点分别出现喷嚏1声和3声、咳嗽1声和2声、搔鼻1次以及排尿等现象;1只豚鼠(1/4)出现连续喷嚏3声和发抖(表4)。
Tab.3 Result of breviscapine injection on active systemic anaphylactic reaction of guinea pigs

GroupnPrimaryprovocationMainanaphylacticreactionIncidenceofanaphylacticresponseResultofevaluationSolutionmedium4Normal0/4ComplianceBovineserumalbumin4Frequentscratchingnose,continuoussneezing3times,coughcontinuously3times,peliosis,dyspnea,instabil⁃ityofgaitorfall,convulsionanddeath4/4Non⁃complianceBreviscapineinjection5mg·kg-14Sneezingandscratchingnoserespectivelyonce0/4Compliance 50mg·kg-14Sneezingonceortwice,scratchingnoseonce;onefrequentscratchingnoseandcontinuoussneezing3times0/4Compliance
According to the ″Pharmacopoeia″ 2010 edition, an AttachedG in Traditional Chinese Medicine Injection Safety Test Application Guidelines ″Anaphylactic Reaction Test″, the results of anaphylactic reactions were observed.
Tab.4 Result of breviscapine injection on active systemic anaphylactic reaction of guinea pigs

GroupnSecondprovocationMainanaphylacticreactionIncidenceofanaphylacticresponse Resultof evaluationSoultionmedium4Normal0/4ComplianceBovineserumalbumin4Frequentlyscratchingnose,continuoussneezing3times,coughcontinuously3times,peliosis,dyspnea,instabilityofgaitorfall,convulsionanddeath4/4Non⁃complianceBreviscapineinjection5mg·kg-14Trembling,sneezingonceortwiceandscratchingnoseonce0/4Compliance 50mg·kg-14Trembling,sneezingonceortwice,scratchingnoseonce,cough,micturition,continuoussneezing3time1/4Non⁃compliance
According to the ″Pharmacopoeia″ 2010 edition, an AttachedG in Traditional Chinese Medicine Injection Safety Test Application Guidelines ″Anaphylactic Reaction Test″, the results of anaphylactic reactions were observed.
2.3 “指导原则法”激发豚鼠过敏症状
2.3.1 阳性对照牛血清白蛋白组豚鼠过敏症状激发后,牛血清白蛋白组6只豚鼠在激发后10 min内均出现了不同程度的过敏反应,症状包括搔鼻、咳嗽、喷嚏、排尿、步态不稳、痉挛、旋转和死亡,为强阳性或极强阳性。其中3只豚鼠死亡,剩余3只豚鼠的过敏反应症状在45~75 min内基本恢复(表5)。
2.3.2 注射用灯盏花素5 mg·kg-1组豚鼠过敏症状6只豚鼠在激发后10 min内均出现了不同程度的过敏反应症状,其中3只豚鼠出现搔鼻症状,为弱阳性;3只豚鼠出现喷嚏和(或)排尿症状,为阳性,过敏反应症状在35~50 min内基本恢复(表5)。
2.3.3 注射用灯盏花素50 mg·kg-1组豚鼠过敏症状6只豚鼠在激发后10 min内均出现了不同程度的过敏反应症状,症状包括搔鼻、喷嚏、咳嗽和(或)排尿症状,为阳性,过敏反应症状在35~50 min内基本恢复(表5)。
2.3.4 排除类过敏试验分别取健康未致敏的豚鼠2只(雌雄各1只),分别iv给予激发剂量的高剂量组和低剂量组灯盏花素,均未观察到过敏反应。结合灯盏花素注射液的不良反应在临床上主要表现为过敏反应,提示注射用灯盏花素在应用于临床时应重点关注其过敏反应。
3 讨论
随着注射用灯盏花素等中药注射剂在临床上的广泛应用,逐渐出现一些中药注射剂不良反应的报道,临床上灯盏花素的不良反应主要以过敏反应为主,严重的可出现过敏性休克[5-7]。目前评价豚鼠全身主动过敏试验的方法主要有“药典法”和“指导原则法”。本研究分别采用这2种方法评价注射用灯盏花素的全身过敏反应,对药物非临床安全性评价中豚鼠全身主动过敏试验进行比较。豚鼠全身主动过敏试验中“药典法”和“指导原则法”的区别见表6。
Tab.5 Result of breviscapine injection on active systemic anaphylactic reaction of guinea pigs

GroupnNumberofanimalswith anaphylacticreaction -++++++++++IncidenceofanaphylacticresponseAnaphylacticintensitySolutionmedium6600000/6NegativeBovineserumalbumin6000336/6StronglypositiveandextremelypositiveBreviscapineinjection5mg·kg-16033006/6Weaklypositiveandpositive 50mg·kg-16006006/6Positive
According to theTraditionalChineseMedicine,NaturalMedicineImmuneToxicity(Anaphylaxis,AnaphylacticReactionofLight)TechnologyGuidingPrinciplesin the 2005 Version, the results of anaphylactic reaction were observed.
Tab.6 Comparison of pharmacopoeia and ″Guiding Principle″ on active systemic anaphylactic reaction of guinea pigs

MethodNumberDesigndoseControlTimesofanaphylaxisProvocationdoseProvocationtimesTimeIndicator″Pharmacopoeia″61Non32timesofsensitiza⁃tion230minOnlyanaphylacticsym⁃ptomsareindicated″GuidingPrinciple″Atleast62Negativeandpositivegroup3-52-5timesofsensitiza⁃tion13hDetailedindicatorsshowninTab.1
动物数目:“药典法”规定动物数6只,但由于分2次激发,每次仅3只豚鼠,如果药品引起的过敏反应比较轻微时,可能会出现假阴性结果。而“指导原则法”要求每组至少6只,且1次激发,基本达到统计学要求的最低样本数[8]。郭姗姗等[9]对比研究BN大鼠和豚鼠对中药注射液过敏反应中,同等实验条件下,BN大鼠各组的过敏反应程度与豚鼠比较没有显著性差异,分析原因可能与实验样本数较少有关。剂量设置: 剂量设置中,“指导原则法”要求设置低和高剂量组,低剂量组给予临床最大剂量,高剂量组给予低剂量的数倍量。“药典法”设置1个剂量组,按照规定的剂量进行。为与“指导原则法”有可比性,本研究在“药典法”中设置低和高2个剂量组。“药典法”结果显示,低剂量组豚鼠2次激发后均未表现明显的过敏症状,而高剂量组第2次激发表现出过敏症状,判断该剂量组下注射用灯盏花素过敏反应呈阳性,即在此剂量下出现过敏体征。因此认为,致敏剂量与过敏体征有一定关系。张德波等[10]研究也认为,过敏反应发生与否,或表现出来的症状轻重与剂量密切相关。剂量如果太低,虽然在一定范围内,过敏反应发生率不变化,但很可能由于过敏反应轻微,而容易忽视所观察到的体征。过敏反应症状:“药典法”指出,应观察的过敏反应症状有13项;而“指导原则法”中过敏反应症状为20项, 尽管部分指标如不安宁和喘息等判定时可能带有一定的主观因素,但是这些体征描述还是可以给观察者更好地提示作用。另外,比较2种过敏体征判定标准,“指导原则法”似乎更加严格,例如咳嗽和喷嚏等体征即使仅出现1次,也会记录分值。本研究中2种方法的结果比较也说明了这一点。观察过敏症状时间:“药典法”要求观察时间为30 min,而“指导原则法”要求观察时间为3 h。本研究中,部分异常体征出现的最早时间为激发后15或22 min,在30 min后也观察到部分豚鼠出现过敏体征,按照“药典法”这部分过敏体征将不被记入结果,因此,如果以激发后30 min为限观察豚鼠的过敏反应症状,那么有可能出现误判或漏判。因此,“指导原则法”要求观察的时间更为合理。致敏次数:“药典法”中要求致敏次数3次,而“指导原则法”中要求为3~5次。有研究认为,若致敏次数过少,不利于抗体的产生,过敏反应较弱;致敏次数太多,会影响到实验操作成本并在致敏阶段引起过敏反应[11]。但是“指导原则法”给出了选择范围,使得实验人员可以根据药物的不同特点来选择合适的致敏次数。其他: “药典法”并未规定阴性和阳性对照组的设置,“指导原则法”则明确规定设置阴性和阳性对照组。豚鼠在试验过程中,如果食物、饮水或环境条件变化使豚鼠表现出一些相当于轻微过敏的症状,可能会影响实验人员的判断。因此,设置阴性和阳性对照组是必要的。“指导原则法”还进一步指明,激发后,若发现有过敏反应症状时,可取健康未致敏豚鼠2只,自静脉注射激发剂量的受试物,观察有无由于受试物作用引起的类似过敏反应症状,以供结果判断时参考,这种做法也会进一步排除假阳性。综上所述,在进行非临床安全性评价豚鼠全身过敏试验过程中,从动物数量、评定标准、观察时间和剂量设置等多方面,认定“指导原则法”过敏体征的出现比较合理。因此也提示,药物非临床安全性评价研究中,可以利用“药典法”对供试品进行初筛,一旦有疑似反应,最好采用“指导原则法”进行更加细致的观察。
[1] State Food and Drug Administration. Guidance for Industry Skin Irritation, Sensitization and Erythrolysis Testing of Generic Transdermal Drug Products(化学药物刺激性、过敏性和溶血性研究技术指导原则)[S]. Beijing: Chinese Medicine Science and Technology Press, 2007:116-132.
[2] Yang WF, Yu XZ, He P, Hao W, Li YK. Experimental study on anaphylactoid reactions of guinea pig induced by Danshen injection and its components[J].ChinaJChinMaterMed(中国中药杂志), 2012, 37(13):18894-18897.
[3] National Pharmacopoeia Committee.ChinesePharmacopoeia2010 Edition of a Report ofG Traditional Chinese Medicine Injection Safety Inspection Method Guidance(《中国药典》2010年版一部附G中药注射液安全性检查法应用指导原则)[S]. Beijing: Chinese Medicine Science and Technology Press, 2010:145.
[4] State Food and Drug Administration. The Immune Toxicity of Traditional Chinese Medicine, Natural Medicine (Anaphylaxis, Light Anaphylactic Reaction) Technology Guidelines for Research〔中药、天然药物免疫毒性(过敏性、光过敏反应)研究的技术指导原则〕[S]. Beijing: Chinese Medicine Science and Technology Press, 2007:244-254.
[5] Hu J, Guo C. Literature analysis of adverse drug reactions caused byErigeronbreviscapusand breviscapus injection[J].ChinaPharm(中国药房), 2011, 22(24):2258-2260.
[6] Mei QX, Fan WC, Zeng CY. Literature analysis of breviscapin injection-induced adverse reaction cases reported[J].ChinaLicensedPharm(中国执业药师), 2010, 7(4):3-6.
[7] Du J, Li JL, Fu W. Analysis of 106 cases of adverse drug reaction/event of Deng Zhan Hua Injection[J].ChinJPharmacovigilance(中国药物警戒), 2008, 5(4): 220-224.
[8] Liu CX, Sun RY.ExperimentalDesignandStatisticalBasisforDrugEvaluation(药物评价实验设计与统计学基础)[M]. Beijing: Military Medical Science Press, 1999:15-16.
[9] Guo SS, Wang YZ, Zhang Y, Li DF, Zong GZ, Gao YJ,etal. Allergic response of Shuanghuanglian injection in BN rats and guinea pigs[J].ChinJPharmacolToxicol(中国药理学与毒理学杂志),2009, 23(2):128-133.
[10] Zhang DB, Yang YQ, Feng C, Luo J. Study on the relations between hypersensitivity and the doses of allergen or immune time[J].DrugStandChina(中国药品标准), 2007, 8(3):18-20.
[11] Weng XC, Fan X, Wang QX, Shi C, Li LN, Ouyang ZH,etal. Research on the methods of active systemic anaphylaxis on guinea pig in drug safety evaluation[J].ChinJCompMed(中国比较医学杂志), 2012, 22(5):51-55.
(本文编辑: 齐春会)
“第五届中西部儿科医学发展论坛”征文通知
中西部儿科医学发展论坛是中西部地区儿科医学的一个学术盛会。该论坛的宗旨是“交流、合作和发展”,更好地推动我国中西部儿童医疗事业的持续性发展,促进基层儿科人才成长。由《儿科药学杂志》、《中华实用儿科临床杂志》和中国预防医学会主办,中西部儿科医学发展论坛组委会和重庆医科大学附属儿童医院承办的第五届中西部儿科医学发展论坛,定于2015年6月25-27日在重庆召开。本次会议主要针对中西部儿童健康状况和特点,交流和传播实用儿科医学知识和技术,切实解决中西部儿科医生工作中迫切需要解决的问题;本届重点关注“儿童营养保健与发育行为、儿童呼吸道疾病和儿童感染性疾病”三大主题,重点关注基层儿科医生临床研究相关问题;会议内容既注重前瞻性,更具有实用性;报告形式既有专家讲座,又有病例讨论;既有中青年学者论坛,又有与杂志主编的面对面交流。会议将邀请美国、英国、加拿大及国内院士、知名学者进行大会演讲和点评,相信这次会议对广大基础儿科医生定会有所裨益。本次会议有“国家级继续医学教育项目”支持。欢迎各位积极参加并踊跃投稿。
1 征文内容① 儿童营养、保健与发育行为:儿童营养新进展;儿童早期综合发展;早产儿营养;儿童肥胖症;儿童生长发育的促进和评估;儿童食物过敏;环境与儿童健康;儿童行为发育问题、障碍性疾病等。② 儿童呼吸道疾病:儿童呼吸系统感染性疾病;儿童哮喘及其他喘息性疾病;间质性肺疾病;呼吸睡眠障碍;呼吸系统疾病的影像学、肺功能、支气管镜检查等。③ 儿童感染性疾病:儿童细菌感染与对策;EB病毒感染;流感病毒感染早期识别与管理;儿童结核病;中枢神经系统感染;免疫缺陷与感染;不明原因发热等。
2 征文要求① 文章内容应具有科学性、创新性和实用性;② 来搞必须是未公开发表过的学术论文;③ 论文要求500~800字摘要,内容包括目的、方法、结果和结论4部分,格式按《儿科药学杂志》稿约要求。一律采用Word文档,小四号宋体。④ 来稿时注明作者姓名、单位、详细地址、邮政编码、联系电话和电子邮箱。⑤ 被录用论文将编入“会议论文集”,优秀论文将优先在《中华实用儿科临床杂志》或《儿科药学杂志》发表。
3 投稿方式稿件直接以电子邮件方式发送至会务组邮箱,E-mail: ekyxzz2012@163.com,邮件主题请注明“儿科医学发展论坛征稿”。会议征文联系人:刘雄志,杨 丹;电话:(023)63633143。截稿日期:2015年5月15日。
4 会议安排2010年6月25日全天报到,6月26-27日召开学术会议。会务费800元/人(学生代表400元/人),食宿由会务组统一安排,费用自理。会议地点:重庆市(具体见第二轮通知)。
5 会务组联系方式第五届中西部儿科医学发展论坛会务组,地址:重庆市渝中区中山二路136号重庆医科大学附属儿童医院,联系人:曾敏莉,王乐乐,电话:(023)63633143。
第五届中西部儿科医学发展论坛组委会 2015年1月
Comparison of methods for active systemic anaphylactic reactionof guinea pigs induced by breviscapine injection
ZHOU Li1, WANG Yong1, YANG Chun-lei3, LUO Yong-wei1,2, JIANG Juan1,JIA Yu-ling1,2, GUI Bo1, SUN Zu-yue1
(1.ShanghaiInstituteofPlannedParenthoodResearch&NationalEvaluationCenterforToxicologyofFertilityRegulatingDrugs,Shanghai200032,China; 2.SchoolofPharmacy,FudanUniversity,Shanghai201203,China; 3.KunmingLongjinPharmaceuticalCompany,Kunming650101,China)
OBJECTIVE To compare the difference of methods for active systemic anaphylactic reaction induced by breviscapine injection between ″Pharmacopoeia″ 2010 edition, an AttachedG in Traditional Chinese Medicine Injection Safety Test Application Guidelines ″ Anaphylactic Reaction Test″(thereafter referred to as the method of ″Pharmacopoeia″) and the Traditional Chinese Medicine, Natural Medicine Immune Toxicity (Anaphylaxis, Anaphylactic Reaction of Light) Technology Guiding Principles in the 2005 Version (thereafter referred to as the method of ″Guiding Principle″) and provide reference for non-clinical safety evaluation of drugs. METHODS According to the methods of ″Pharmacopoeia″ and ″Guiding Principle″, respectively, the effect of breviscapine injection on active systemic anaphylactic reaction of guinea pigs was investigated. The guinea pigs were divided into four groups, negative control group, positive control group, breviscapine injection 5 and 50 mg·kg-1groups. In the sensitization phase, the guinea pigs were ip administrered with breviscapine injection 0.5 mL each every other day for 3 times. The dose was 5 and 50 mg·kg-1, respectively. For the method of ″Pharmacopoeia″, on the 14th and 21st days after the first sensitization, the guinea pigs were iv administrered with breviscapine injection 1 mL. For the method of ″Guiding Principle″, the guinea pigs were provocated on the 12th day after the first sensitization. Each group was studied by observing the symptom of anaphylactic reaction and immune time. RESULTS For the method of ″Pharmacopoeia″, on the 14th day after the first sensitization, there was 1 guinea pig with sneezing and (or) the nose-scratching at different time in the 5 mg·kg-1group. In the 50 mg·kg-1group, there was one or two cases of sneezing and (or) 1 case of nose-scratching. The 5 and 50 mg·kg-1dose groups conformed to the regulations. On the 21st day after the first sensitization, trembling occurred in the 5 mg·kg-1group, with 1 or 2 guinea pigs sneezing and (or) scratching the nose. There were 4 guinea pigs (4/4) with sneezing 1 and 3 times, cough once or twice, 1 scratching nose and urination at different time, and 1 guinea pigs (1/4) appeared 3 times consecutive sneezing and shivering in 50 mg·kg-1group. The 5 mg·kg-1group conformed to the regulations, while the 50 mg·kg-1group did not. For the method of ″Guiding Principle″, the 5 mg·kg-1group was weak positive or positive, with different degrees of symptoms of an anaphylactic reaction, including 3 guinea pigs scratched nasal symptoms. And the 50 mg·kg-1group of anaphylactic symptoms including scratching nose, sneezing, coughing and (or) urination, showed positive. CONCLUSION During the active systemic anaphylactic reaction of drugs non-clinical safety evaluation of drugs the advantage of either method should be brought into play. The method of ″Pharmacopoeia″ may be used for preliminary screening of test samples. In case pf suspected reactions, the method of ″Guiding Principle″ should be used for more detailed observations.Key words: breviscapine injection; hypersensitivity; drug evaluation, preclinical
SUN Zu-yue, E-mail: sunzy64@163.com
上海市实验动物创新行动计划项目(14140- 901302)
周 莉,女,研究员,主要从事药物生殖药理毒理学、前列腺疾病药理毒理学的研究和新药临床前安全性评价,E-mail: zhoulijss@163.com;孙祖越,男,博士,研究员,主要从事药物生殖药理毒理学、前列腺疾病药理毒理学研究和新药临床前安全性评价。
孙祖越, E-mail: sunzy64@163.com
Foundation item: The project supported by Shanghai ″Innovative Action Plan″ Experimental Animal Study (14140901302)
2014-06-22 接受日期: 2015-03-20)
R965.2
A
1000-3002(2015)02-0265-07
10.3867/j.issn.1000-3002.2015.02.013
--------------------
