均相酶免疫分析技术在治疗药物监测中的应用
2015-03-02齐谢敏虞留明朱婷婷储小曼南京军区南京总医院药理科南京000苏州博源医疗科技有限公司苏州563
齐谢敏,虞留明,李 冬,朱婷婷,储小曼*南京军区南京总医院药理科,南京 000;苏州博源医疗科技有限公司,苏州 563
均相酶免疫分析技术在治疗药物监测中的应用
齐谢敏1,虞留明2,李 冬2,朱婷婷1,储小曼1*
1南京军区南京总医院药理科,南京 210002;2苏州博源医疗科技有限公司,苏州 215163
均相酶免疫技术是一种基于液相均相竞争性反应体系的免疫测定技术,目前,基于该技术建立的药物浓度测定方法以其独特优势已成功应用于临床治疗药物和兴奋剂等小分子以及蛋白质等大分子的检测,但大多依靠进口试剂。本文对均相酶免疫技术的研究现状、技术原理、技术优点进行了综述,重点介绍了该技术在治疗药物监测方面的临床应用以及需要注意的问题,并对该技术的应用前景进行了展望。该技术具有检测速度快、特异性强、自动化程度高等优点,但面临进口试剂价格昂贵、运送周期长等问题,因此我国对该技术的自主研发平台及试剂需求显得尤为迫切。
均相酶免技术;治疗药物监测;半抗原;开放式生化仪
一些药物由于其生物利用度及药动学的个体差异大、治疗窗范围窄、治疗剂量与中毒剂量接近等因素,导致临床极易发生中毒反应或疗效不佳[1-3]。因此,必须检测这些药物的体内浓度,为临床制定个体化给药方案提供参考依据。而准确、快速的药物浓度监测方法是合理给药方案的前提。始于20世纪60年代的治疗药物检测 (therapeutic drug monitoring,TDM)通过测定体液中药物浓度,能有效监测患者药物治疗效果,根据患者临床特点设计个体化给药方案,指导临床个体化用药,及时避免因药物浓度过高而引发的毒副反应或药物浓度过低、延误疾病的治疗。均相酶免疫技术(homogeneous enzyme immunoassay,HEIA)作为一种药物浓度检测方法,因其独特优势在国外已应用多年。该技术是一种基于液相均相体系的竞争性反应,兼具了“抗原和抗体”及“酶和底物”两种系统的特点,具有检测速度快、定量准确、精密度高、特异性强等优点。同时可应用于各种类型的生化分析仪,实现样本的高通量和自动化测定,可用于检测治疗药物、兴奋剂等分子量在2000道尔顿以下小分子,也可用于多肽、蛋白质及多糖等大分子的检测[4-6],具有广泛的应用前景。
HEIA技术在国外报道较早,但由于技术难度大,能够应用此技术研发临床诊断试剂的公司并不多。美国Syva公司于1972年首次报道该技术,其注册商标为酶扩大免疫测定技术 (enzyme multiplied immunoassay technique,EMIT),但该公司的 EMIT产品直到 20世纪90年代才广泛应用于TDM和毒品检验领域。随着基因工程的发展,Thermofisher公司的Henderson等于1986年开发出克隆酶供体免疫测定(clone enzyme donor immunoassay,CEDIA)方法,均相酶免疫技术得到了进一步发展。HEIA技术主要用于小分子物质的测定,由于新一代抗体技术可以通过特异性小分子多肽片段(2~12个氨基酸)制备抗蛋白质抗体,HEIA技术也应用到蛋白质等大分子物质的检测[7]。
目前,国外只有西门子 (Siemens)、赛默飞世尔(Thermofisher)、奎斯特(Quest Diagnostics)等公司拥有基于HEIA开发的试剂,例如西门子开发的Emit®2000 Vancomycin Assay kit等。国内研发HEIA试剂的IVD(in vitro diagnos tic)公司较少,应用于临床检测的HEIA试剂一直处于空白状态。近年来,国内已有IVD企业开始自主研发HEIA技术平台,并且已成功运用此技术平台开发出甘胆酸检测试剂、TDM系列试剂等多种可用于临床检验的产品,填补了国内空白[8]。
1 均相酶免疫分析技术原理
HEIA技术运用竞争结合的分析方法,酶标记半抗原和非标记半抗原具有相同的与限量抗体竞争结合的能力。抗体与酶标记半抗原结合后,形成空间位阻,封闭了酶与底物的结合位点,从而降低酶对底物的催化效率。通过测定底物终端物的特定波长的吸光度变化,即可测定反应系统中总酶活性变化,推算出被测样本中半抗原含量。用于HEIA的标记酶有溶解酵素[9]、苹果酸脱氢酶[10]、β-D-半乳糖苷酶[11]以及葡萄糖-6-磷酸脱氢酶(G6PDH)等[12-13],目前常用的为葡萄糖-6-磷酸脱氢酶。
以G6PDH为例,HEIA技术原理是:“G6PDH-小分子(半抗原)”偶联物催化6-磷酸葡萄糖(G6P)转化为6-磷酸葡萄糖酸(6PG),同时将辅酶氧化型烟酰胺腺嘌呤二核苷酸(NAD+)转化成还原型烟酰胺腺嘌呤二核苷酸(NADH),NADH在340 nm处有吸收峰,在无抗体和分析物时,整个反应的信号最强,达到“+++++”(图1a)。
有抗体而无待测物时,“G6PDH-小分子”偶联物与抗体结合,G6PDH的活性受到抗体最大限度的抑制,整个反应的信号最弱,为“+”(图1b)。
实际测定时,待测物竞争性结合部分抗体,与抗体结合的“G6PDH-小分子”偶联物被释放出来。待测物越多,释放出来的酶标记偶联物就越多,反应信号也就越强。通过建立340 nm处吸光值与待测物标准品浓度的标准曲线,计算出未知样本浓度(图1c)。

图1 HEIA技术原理
2 均相酶免疫分析技术的优点
TDM技术主要有光谱法、色谱法、免疫法三类。光谱法由于其灵敏度低、所需样本量大而在临床检测中受限;色谱法虽提高了灵敏度,但对样本前处理及所需试剂、样本的纯净度要求均较高,不符合临床快速、简便的操作需求;非均相酶免疫测定法需分离结合和游离的标记物,才能测定各自浓度,操作繁琐。而HEIA发生在一个液相均相体系中,无需分离结合与游离的标记物,具有如下突出优点:
(1)特异性强、定量准确。使用的抗体可特异性地针对待测物,增强母体药物专属性,减少代谢物交叉反应。影响特异性的主要原因是交叉反应,主要来源于结构类似物或药物代谢物产生的非特异性信号,而HEIA是基于抗原-抗体反应,专一性强,能识别化学结构非常相似的物质,甚至是立体异构体。
(2)灵敏度高,可达到pg/mL水平[14]。HEIA中酶标记半抗原与抗体结合后产生空间位阻降低酶活性,一旦待测物与其竞争结合抗体,释放出来的酶标记半抗原对其催化的底物高度灵敏,从而产生检测信号,灵敏度较高。
(3)精密度高,批内、批间变异系数均小于 5%。由于HEIA是通过酶催化反应检测吸光度进行定量,其试剂性质较稳定;化学发光、放射免疫法可能产生信号衰减导致反应结果不稳定,而HEIA通过检测吸光值定量,信号重现性好;HEIA是均相反应体系,完全消除了抗原、抗体分离带来的误差,进一步提高方法精密度和重现性。
(4)检测时间短、通量高。HEIA在液相均相体系中完成,抗体抗原反应达到平衡的时间比固相短;且酶促反应时间较短,在数十秒内即可检测到吸光值变化。以Olympus5400型生化分析仪为例, 每小时检测样本量超过2000例。
(5)操作简便、自动化程度高,可在开放式生化分析仪进行检测。样本前处理一般只需分离血清或血浆即可;HEIA在均相反应体系进行,不需分离抗原抗体,简化操作;通过检测吸光值定量,普通生化仪即可满足检测要求,分析仪可识别样本条码,使结果与样本完全匹配。
3 均相酶免疫技术在TDM中的应用
用药不当致死率远远高于同期各种传染病死亡率,而用药不当死亡人数中,大多是剂量不当所致。TDM指导下制定和调整的给药方案是药物治疗学发展的必然趋势,它将临床用药从传统经验模式提高到更科学的水平,而精确的监测手段使TDM临床应用得以实现。国外早期HEIA技术应用主要集中于TDM[15]。1975年Bastiani[16]首先报道了利用HEIA技术测定苯妥因及苯巴比妥的含量。此后,国外学者又陆续报道了利用HEIA测定甲氨喋呤[17]、丁丙诺菲[18]、卡马西平[19]、芬太尼等药物浓度。
抗癫痫药物副作用较大,蒋颖等[20]对EMIT测定的患者丙戊酸、卡马西平等抗癫药物血药浓度结果进行回顾性调查,维持有效血药浓度具有可观的疗效,而重要的TDM数据是真正做到个体化给药的必要途径之一。
免疫抑制剂主要用于预防治疗移植术后排异反应和移植物抗宿主病,浓度过高过低产生高毒性或排异反应,导致移植失败,TDM可有效预防不良反应发生。有报道采用HEIA法测定45例肾移植患者体内免疫抑制剂他克莫司血药浓度,73.7%的检测结果均在有效血药浓度范围内,定期检测他克莫司的血药浓度,对避免患者发生中毒或排斥反应意义重大[21]。Luo等[22]采用EMIT技术简便、快速地检测肾移植患者体内环孢素A血药浓度,验证了其100~400 ng·mL-1的治疗剂量,当高于或低于该界限时,毒性反应和排异率明显增加,根据TDM结果调整剂量可避免不良反应发生,对保证临床疗效和安全有着重要的作用。有报道称,EMIT和荧光偏振免疫分析法(fluorescence polarization immunoassay,FPIA)测定环孢素A血药浓度,结果存在显著差异,前者测定结果偏低[23-24]。但是崔彦等[25]对EMIT和FPIA测定环饱素A血药浓度结果进行比较时,发现这两种方法测定结果没有统计学差异,EMIT结果偏低可能是由于实验条件、操作等未标准化所致。研究结果表明,EMIT和HPLC[26-27]、MEIA(microparticle enzyme immunoassay)[28]、PETINIA(particle-enhanced turbidimetric inhibition immunoassay)[29]等方法检测结果相关性较好、分析结果无显著性差异。
心血管病药物治疗和中毒剂量接近,TDM可协助调整剂量,避免不良反应发生。乔小云[30]等评价和控制了均相酶免疫法检测患者地高辛血药浓度的质量,研究表明,在该实验室条件下,日内、日间质控的相对标准偏差(RSD)均在2%~7%,平均回收率在97%~104%,证实了均相酶免疫法是监测地高辛血药浓度的一种较理想的测定方法。朱春香等[31]用HEIA法监测患者地高辛血药浓度,结果表明75岁以上患者平均浓度超过治疗窗上限,同时应注意维拉帕米、奎尼丁等合并用药的影响。除监测血药浓度外,HEIA还能用于尿药浓度测定,Wang等[32]采用该技术快速测定人体尿样中芬太尼浓度,检测限达1 ng·mL-1。目前HEIA用于临床TDM的药物见表1。
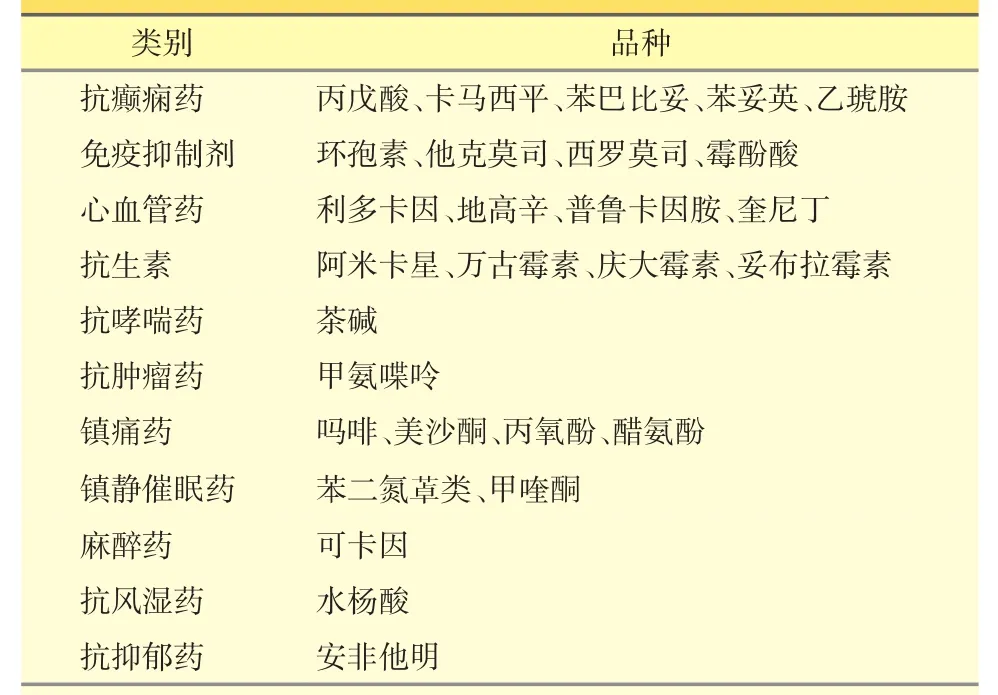
表1HEIA技术检测的临床TDM药物
4 HEIA技术应用于TDM需要注意的问题
HEIA技术提供了快速准确的血药浓度测定结果,怎样正确应用该技术和检测结果、制定合理的个体化给药方案是TDM的关键。
(1)试剂存放。由于HEIA是基于酶促反应,因此,温度对体系活性影响较大。试剂保存温度一般控制在2~8℃,温度升高会影响酶标偶联物活性和稳定性。
(2)校正标准曲线。相对于普通生化试剂,HEIA试剂成分更加复杂,既有底物等化学试剂,又包含酶、抗体等一系列生物活性物质,加之酶标偶联物是通过化学偶联制备,对酶的结构已经产生了一定破坏,因此,体系稳定性会随放置时间延长受到一定影响,及时定期校正标准曲线对确保检测准确性至关重要。
(3)特殊药物。相对于其他治疗药物检测范围,甲氨喋呤浓度变化较大,免疫试剂很难覆盖整个检测范围,一些临床样本需要稀释或选择合适的标准曲线范围检测。为减少试剂消耗,选择合适的稀释倍数和标准曲线范围,并尽量保证稀释后的样本浓度落在标准曲线中段尤为重要。骨科甲氨喋呤给药一般为6 h滴注,剂量8 g,用药量较大,若为用药后24 h血样,5~10倍稀释后浓度约为1 μmol·L-1,即在标准曲线范围内适当位置;血液科给药一般为24 h滴注,剂量3 g,48 h后样本可直接检测;中医科等给药量少的样本可不稀释,直接检测。肝肾功能不全等特殊人群需再做相应调整。
(4)特殊情况。HEIA监测肾移植患者他克莫司的血药浓度,结果显示,女性患者血药浓度高于男性,老年组血药浓度显著低于中、青年组,他克莫司给药时应注意性别、年龄等影响因素;联合用药时应注意药物相互作用的影响,采用EMIT监测使用不同保肝药的肾移植患者术后体内环孢素浓度,结果表明,术后使用的大多保肝药物均会影响环孢素血药浓度,在合并用药时应予以关注;不同处方可能有不同的药动学特征[33],从静注改为口服,或改用不同商品名药物,都可能导致药物浓度波动,发生不良反应。同时TDM仅适用于血药浓度与药效定量关系相一致的药物,例如有些药物药理作用持续时间比其在血中停留时间长得多,或不可逆地结合作用部位,这时TDM结果往往不能反映其疗效。
5 展 望
HEIA技术具有灵敏度高、特异性强、准确性好、操作简便、安全无污染,可实现自动化检测等优点,既可以测定小分子物质,如药物及激素(甲状腺激素等[34]),又可以测定大分子物质。但试剂大多依靠进口,依赖专用仪器,监测成本高,患者经济负担重。国内自主研发的检测试剂大大降低了成本,可改变以往依赖进口试剂和专用仪器、费用昂贵的现状。随着基因工程、酶工程等技术的发展,HEIA技术将得到进一步发展与应用,例如肝功能指标(甘胆酸、总胆汁酸、透明质酸),肾功能指标(肌酐),心血管功能指标(同型半胱氨酸),糖尿病指标(1,5-脱水-D-山梨醇),骨质疏松标志物(脱氧吡啶酚)指标的检测,还有望应用于食品安全、毒品[35-36]、环境监测[37-38]等更多领域。
传统TDM需要患者用药一段时间后测定血药浓度,此时可能已发生药效不佳或不良反应,而目前进行监测的药物占临床常用药10%左右,药物基因组学的发展使得基因分型可预测特定人群的药物反应,基因导向结合TDM指导临床个体化用药,可为患者提供更为安全、有效的给药剂量,为推动TDM发展建立了新的研究平台。
[1] 李 辉,李晓华.应用动态血压评估乐卡地平治疗青年原发性高血压患者疗效的临床分析[J].医学研究生学报,2013,26(2):172-4.
[2] 季曙明,陈劲松,孙启全,等.环孢素转换至他克莫司治疗慢性移植肾肾病的临床和病理观察[J].医学研究生学报,2011,24(1):34-8.
[3] 陈 冰,杨婉花,张伟霞,等.中国成年患者万古霉素群体药动学研究[J].药学与临床研究,2013,21(6):605-9.
[4] Loor R,Pope L,Boyd R,et al.Monitoring cyclosporine of pre-dose and post-dose samples using nonextraction homogeneous immunoassay[J]. Ther Drug Monit,2004,26(1):58-67.
[5] Loor R,Lingenfelter C,Wason PP,et al.Multiplex assay of amphetamine,methamphetamine,and ecstasy drug using CEDIA® technology[J].J Anal Toxicol,2002,26(5):267-73.
[6] Chiu ML,Lai D,Monbouquette HG.An influenza hemagglutinin A peptide assay based on the enzyme-multiplied immunoassay technique[J]. J Immunoass Immunoch,2011,32(1):1-17.
[7] Vogt B,Karl J,Mayr A.Homogeneous immunoassay method [P].US: 20030003602,20030102.
[8] Patient RK,McGhee JD.The GATA family (vertebrates and invertebrates)[J].Curr Opin Genet Dev,2002,12(4):416-22.
[9] Roncancio D,Yu H,Xu X,et al.A label-free aptamer-fluorophore assembly for rapid and specific detection of cocaine in biofluids[J].Anal Chem,2014,86(22),11100-6.
[10] He H,Liang Q,Shin MC,et al.Significance and strategies in developing delivery systems for bio-macromolecular drugs[J].Frontiers of Chemical Science and Engineering,2013,7(4):496-507.
[11] Grote J,Beligere G,Rege S.Methodology for the regiospecific synthesis and characterization of methotrexate conjugates[J].Tetrahedron Lett,2012,53(39):5331-4.
[12] Pandey B,Bhattarai JK,Pornsuriyasak P,et al.Square-wave voltammetry assays for glycoproteins on nanoporous gold[J].J Electroanal Chem,2014,717(15):47-60.
[13] Weng X,Jiang H,Li D.A miniaturized system for rapid and quantitative determination of a cocaine metabolite by a homogeneous enzyme immunoassay[J].Instrum Sci Technol,2013,41(5):512-23.
[14] Murthy V,Karmen A.A study of the CEDIA digoxin immunoassay[J]. Clin Chem,1990,36(3):559-61.
[15] Was'J.A comparison of the immunochemical methods,PETINIA® and EMIT®,with that of HPLC-UV for the routine monitoring of mycophenolic acid in heart transplant patients[J].Ther Drug Monit,2014 (6):1235-9.
[16] Bastiani R.Performance evaluation of the EMIT diphenylhydantoin and phenobarbital assays[J].Clinical study,1975(20):139-42.
[17] Suh-Lailam B,Juenke J,Thompson C,et al.Performance characteristics of three assays for the therapeutic drug monitoring of methotrexate [J].Ther Drug Monit,2013(3):155.
[18] Belsey SL,Couchman L,Flanagan RJ.Buprenorphine detection in urine using liquid chromatography-high-resolution mass spectrometry: comparison with cloned enzyme donor immunoassay(ThermoFisher)and homogeneous enzyme immunoassay (Immunalysis)[J].J Anal Toxicol, 2014,38(7):438-43.
[19] McMillin GA,Juenke JM,Tso G,et al.Estimation of carbamazepine and carbamazepine-10,11-epoxide concentrations in plasma using mathematical equations generated with two carbamazepine immunoassays[J].Am J Clin Pathol,2010,133(5):728-36.
[20] 江 颖,梁健健.216例次抗癫痫药物血药浓度监测结果分析[J].广东药学院学报,2013(3):302-4.
[21] 李美珠,李炜煊,李启欣,等.均相酶增强免疫法监测他克莫司血药浓度在肾移植患者中的临床应用[J].国际检验医学杂志,2014,35(8):1078-83.
[22] Luo XH,Xue WJ,Tian PX,et al.The clinical value of enzyme-multiplied immunoassay technique monitoring the plasma concentrations of cyclosporine A after renal transplantation[J].JPA,2011,1(2):139-42.
[23] 伍三兰,马 林,陈东生,等.酶扩大免疫测定技术与荧光偏振免疫法测定全血环孢素浓度的比较[J].中国医院药学杂志,2012,32(4):295-8.
[24] 张 静,王 羽,王璐璐,等.测定环孢素全血浓度的2种方法对比及临床应用[J].中国新药与临床杂志,2011,30(5):374-6.
[25] 崔 彦,周金玉,孙增先,等.酶放大免疫法与荧光偏振免疫法检测环孢素A血药浓度对比研究[J].中国药业,2013,22(19):17-8.
[26] Milone MC,Shaw LM.Therapeutic drug monitoring for immunosuppressive agents[J].Immunotherapy in Transplantation:Principles and Practice,2012(19):95-113.
[27] Trifilio SM,Scheetz M,Borensztajn J,et al.Variability of cyclosporine concentrations by HPLC and TDX monoclonal assay methods,application of a correction factor,and description of a novel clinical approach to determine the practical consequences of changing assay technique[J]. Clin Transplant,2013,27(1):154-61.
[28] Bartlomiejczyk I,Zochowska D,Sanko-Resmer J,et al.Therapeutic monitoring of tacrolimus concentrations in blood of renal and liver transplant recipients:comparison of microparticle enzyme immunoassay and enzyme multiplied immunoassay methods[J].Transplant Proc,2006, 38(1):94-6.
[29] Vergara Chozas J,Sáez-Benito Godino A,Zopeque García N,et al. Analytical validation of a homogeneous immunoassay for determination of mycophenolic acid in human plasma[J].Transplant Proc,2012,44 (9):2669-72.
[30] 乔小云,王 羽,王璐璐,等.均相酶扩大免疫分析法监测地高辛血浓度的质量控制与评价[J].中国药师,2010,13(3):387-9.
[31] 朱春香,罗万慰,夏 军,等.我院2011-2012年164例次地高辛血药监测浓度回顾性分析[J].中国药房,2014,25(2):136-9.
[32] Wang G,Huynh K,Barhate R,et al.Development of a homogeneous immunoassay for the detection of fentanyl in urine[J].Forensic Sci Int, 2011,206(1):127-31.
[33] Irshaid Y,Hamdi A,Al Homrany M.Evaluation of therapeutic drug monitoring of antiepileptic drugs[J].Int J Clin Pharm Ther,2003,41 (3):126-31.
[34] Karapitta CD,Sotiroudis TG,Papadimitriou A,et al.Homogeneous enzyme immunoassay for triodothyronine in serum[J].Clin Chem,2001, 47(3):569-74.
[35] Nguven T,Truong L,Anne L.Automated homogeneous enzyme immunoassay for detection of tetrahydrocannabinol(Delta-9-THC)in human oral fluid[J].Clin Chem,2006,23(6):112-6.
[36] Barnes AJ,Young S,Spinelli E,et al.Evaluation of a homogenous enzyme immunoassay for the detection of synthetic cannabinoids in urine[J].Forensic Sci Int,2014,241(3):27-34.
[37] Sánchez-Martínez ML,Aguilar-Caballos MP,Gómez-Hens A.Longwavelength homogeneous enzyme immunoassay for the determination of amikacin in water samples[J].Talanta,2009,78(1):305-9.
[38] Dzantiev BB,Urusov AE,Zherdev.Modern techniques of immunochemical analysis:Integration of sensitivity and rapidity[J].Biotechnologia Acta,2013,6(4):94-104.
Homogeneous Enzyme Immunoassay and Its Application in Therapeutic Drug Monitoring
QI Xie-min1,YU Liu-ming2,LI Dong2,ZHU Ting-ting1,CHU Xiao-man1*
1Department of Pharmacology,Jingling Hospital,Nanjing 210002,China;2Suzhou Evermed Biomedical Co.Ltd,Suzhou 215163,China
The Homogeneous Enzyme Immunoassay (HEIA)is a liquid competitive immunoassay.Detection methods developed based on this system are applied for testing of a variety of small molecules,such as therapeutic drugs and stimulants,as well as macromolecules successfully,while most depend on commercially imported kits.We are summarizing here the current research status,test principle and advantages of HEIA,especially its clinical applications in therapeutic drug monitoring(TDM) and issues that should be noticed in TDM.Further details on HEIA development and future utilizations for clinical testing are also discussed.Tests developed with this system are fast,specific and automated.This methodology can be widely used for TDM,while the commercially imported kits based on it are expensive with long delivery cycles.It is urgent to develop products with domestic independent intellectual property rights.
Homogeneous enzyme immunoassay;Therapeutic drug monitoring;Hapten;Open biochemistry analyzer system
R917
A
1673-7806(2015)01-047-04
齐谢敏,女,博士后,研究方向:药物基因组学Tel:025-80860196 E-mail:qixiemin369@126.com
*通讯作者储小曼,女,教授,主任药师,研究方向:临床药理学与药物基因组学 E-mail:chuxm59@126.com
2014-09-17
2014-11-19
