新疆的微藻及其群落结构
2015-03-01蕾徐亮亮胡春香
吴 蕾徐亮亮胡春香
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉430072; 2. 中国科学院大学, 北京100049)
新疆的微藻及其群落结构
吴 蕾1, 2徐亮亮1胡春香1
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉430072; 2. 中国科学院大学, 北京100049)
为了解新疆的微藻资源及其群落特征, 研究于2013年5月和2014年6月对新疆包括荒漠、草甸、农田、滩涂等土壤生境和湖泊、水库、河流、池塘、沟渠等水体生境中的微藻进行了采样调查, 共采集到标本329个, 其中水样256个, 土样73个。经室内鉴定发现, 陆生藻有77种, 优势种呈蓝藻-绿藻型, 主要是席藻属(Phormidium)的种类、具鞘微鞘藻(Microcoleus vaginatus)、土生绿球藻(Chlorococcum humicola); 水生藻有 272种, 优势种呈绿藻-硅藻-蓝藻型, 主要集中在颤藻属(Oscillatoria)、席藻属(Phormidium)、栅藻属(Scenedesmus)、单针藻属(Monoraphidium)和舟形藻属(Navicula)。整体而言, 北部中温带干旱区的微藻较南部暖温带极端干旱区更丰富, 而且主要集中在中温带干旱区的滩涂、湖泊和河流生境。依多维尺度分析发现,土壤生境下同一气候区的滩涂和草甸的微藻群落结构较为相似, 荒漠和农田生境的群落结构无气候区域差异。在水生生境下, 暖温带极端干旱区河流中的群落结构与其他4种水境中差别较大; 中温带干旱区的湖泊和河流相似, 其他生境中的差别都较大, 这说明气候带和生境类型都对微藻群落有影响。
新疆; 微藻组成; 优势种; 群落结构; 多维尺度分析
目前, 已知藻类有3万余种, 其中微藻有2万余种, 占到70%左右[1]。根据微藻所处环境的不同, 常分为陆生微藻和水生微藻。陆生微藻是土壤中具有叶绿素行放氧型光合作用的有机物生产者, 对土壤的形成和土壤肥力的提高有显著作用, 已成为评定土壤质量的重要指标之一[2]。水生微藻是水体生态系统中重要的初级生产者[3], 其组成和多样性直接影响着生态系统的结构和功能[4—7], 因而其群落结构能很好地反映水生生态系统的营养和水质状况[8]。
新疆位于中国的西北边陲, 土地面积在 1.6× 1012m2以上, 约占全国的 1/6, 是我国最大的省区,也是典型的干旱地区[9]。截止2009年底, 新疆荒漠化土地总面积为 1.1×1012m2, 占新疆总面积的64.34%[10]。由于其地处欧亚大陆的中心地带, 高山环绕, 呈典型的大陆性干旱气候, 全疆年降水量平均为134.0 mm[11]。辖区内有世界第二大沙漠塔克拉玛干沙漠, 博斯腾湖是中国最大的内陆湖泊之一。最高的托木尔峰海拔7435.3 m, 而位于吐鲁番盆地的艾丁湖是世界第二陆地最低点, 海拔为–154 m。新疆北部为阿尔泰山, 南部为昆仑山, 天山东西横贯中部, 将新疆隔成南北两大盆地, 形成了“三山夹两盆”的独特地貌类型。如此特殊的地理位置和特有的气候特征, 使微藻在长期的进化过程中形成了丰富多样的群落结构。
目前, 有关新疆藻类群落结构的研究仅有零星报道, 且大多针对具体的水库[12, 13]、河流湖泊[14—16]以及部分区域[17]的浮游植物, 或者固氮蓝藻分布[18],缺乏对整个地区微藻的调查。本研究旨在调查新疆地区微藻群落结构, 了解其生境和自然群落特征,探究微藻分布规律与生境类型、气候区域间的关系,进一步反应不同生态系统的健康及稳定情况[19], 为微藻资源的开发提供基础资料。
1 材料与方法
1.1 研究区概况
根据新疆气候区域划分[20]和采样位点(图 1)的结合, 将研究区域分为了北部中温带干旱区(MTA)和南部暖温带极端干旱区(WTA)。其中, 中温带干旱区年平均降雨量为 221.5 mm, 年蒸发量在1600—2200 mm; 暖温带极端干旱区年平均降雨量为47.3 mm, 年蒸发量在2000—3000 mm[11]。
根据不同土质特点及其植被覆盖类型, 将新疆土壤大致分为 4类: 草甸土壤、荒漠土壤、盐碱土壤和风沙土壤, 其中新疆的盐碱土不论是面积还是种类, 在全国都是最多的。新疆地区河流众多, 除额尔齐斯河注入北冰洋外, 其他均为内陆河。河流水源的补给主要靠山地降水和高山冰雪融水。境内湖泊大多为河流的终点湖, 面积变化大, 由于降水少蒸发大, 湖泊水量常补给不足, 而导致湖水日益浓缩, 盐度逐渐增大。沙漠、戈壁、荒漠、高原、河流、湖泊、盐湖、沼泽等构成了新疆多种多样的地质地貌类型。
1.2 标本采集
2013年5月和2014年6月, 共采集329个样品 (图1), 其中水体样品256个, 涵盖了湖泊、水库、河流、池塘、沟渠5种生境。土壤样品73个, 涵盖了荒漠、草甸、农田、滩涂4种生境 (表1)。根据所处的气候带不同, 将土壤环境分成 8类生境, 用MD、MM、MF、MS 分别表示中温带干旱区的荒漠、草甸、农田、滩涂生境; WD、WM、WF、WS分别表示暖温带极端干旱区的荒漠、草甸、农田、滩涂生境。将水体环境分成10类, 用ML、MRe、MRi、MP、MDi分别表示中温带干旱区的湖泊、水库、河流、池塘、沟渠生境; WL、WRe、WRi、WP、WDi分别表示暖温带极端干旱区的湖泊、水库、河流、池塘、沟渠生境。相同生境的标本间隔至少有15 km, 记录各样点的具体位置、pH、温度、土质、气压、植被等状况。
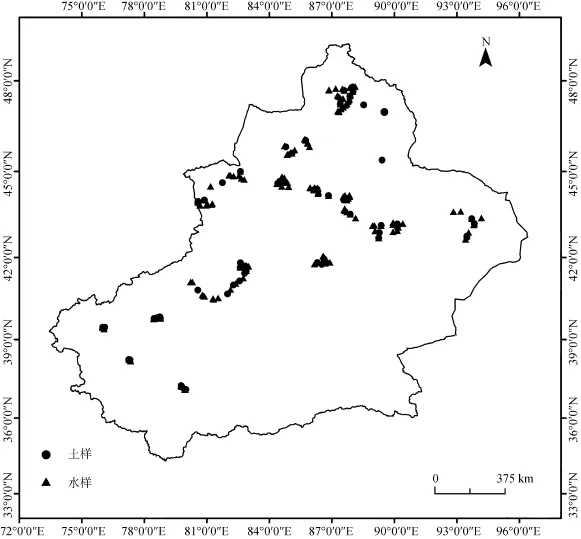
图1 新疆地区采样点分布图Fig. 1 Sampling locations in Xinjiang region

表1 新疆地区不同生境下采样点数目Tab. 1 The number of sampling points in different habitats of Xinjiang region
5种水体生境界定标准如下: 水库是人为建造的, 是介于湖泊和河流之间的一类生态系统; 湖泊是四周陆地所围之洼地, 不与海洋直接联系的水体;河流指由一定区域内地表水和地下水补给, 经常或间歇地沿着狭长凹地流动的水流; 沟渠指为灌溉或排水而人工修建的水道的统称, 多数用石头, 沙子砌成的; 池塘是指比湖泊小的水体, 是依靠天然的地下水源和雨水或以人工的方法引水进池, 属于封闭的生态系统。
土壤标本的采集 采样时选取不同生境下的土壤, 用铁铲除去覆于土壤表面的杂质, 取其深度0—10 cm的土壤。将样品装进无菌干燥的牛皮纸袋中带回实验室, 放入干燥器中存放。
水生微藻的采集 使用 25#浮游生物网在水面表层呈 “∞” 字形缓慢捞取浮游植物样品, 并将网内浓缩液置于30 mL塑料水样瓶中保存。
1.3 微藻鉴定
陆生微藻采用显微镜直接观察和室内培养箱培养观察相结合的方法。称取2 g土壤样品, 放入干净的研钵中进行研磨, 加入20 mL的无菌水摇匀, 取1滴制成临时装片, 在显微镜下观察并拍照。另一部分研磨后的样品加水静置24h, 取液体涂布在BG11 或 F/2的固体培养基中, 放入培养箱内培养 4—7d,在显微镜下观察拍照, 二者结果相结合得出最终镜检结果。
水生微藻在水样摇匀后, 制临时装片在显微镜下直接观察并拍照。
因样品数量较多, 藻种类型均采用直接观察法进行鉴定。
种类鉴定参照 《中国淡水藻类——系统、分类及生态》、《中国淡水藻志》、《淡水微型生物图谱》[21—23]等文献。
1.4 微藻群落优势种的确定
优势种是根据物种的出现频率及个体数量来确定, 用优势度表示。优势度计算公式
式中: Y 是优势度, fi是第 i 物种的出现频率, Pi是第 i 物种个体数占总个体数量的比例, 当 Y ≥0. 02时, 确定为优势种。
1.5 统计分析
采用多维尺度分析法(Multidimentional scaling, MDS) 进行群落结构分析, 数据处理采用SPSS 19.0软件。
2 结果
2.1 微藻种类组成
陆生微藻 73个土壤样品中共发现微藻 77 种(仅鉴定到属的按 1种计, 下同), 隶属于 3门 39属。其中, 蓝藻门种类最多, 18属44种, 占总种类数的57.14%; 绿藻门次之, 19属31种, 占40.26%;硅藻门最少, 仅2属2种, 占2.60%, 分别为舟形藻Navicular sp.和等片藻Diatoma sp.。
在同一生境下, 中温带干旱区(MTA)的陆生藻种类数均高于暖温带极端干旱区(WTA)(表2)。硅藻仅在MTA地区出现, 而在WTA地区未出现, 这可能与 WTA地区的高光强、高温以及较高的盐度等因素有关。在MTA的草甸、农田和滩涂生境下, 蓝藻与绿藻多样性较高, 其中滩涂生境的藻种多样性最为丰富, 荒漠生境下微藻种类数最少。
为了揭示不同采样点陆生微藻组成的差异, 本研究对8种土壤生境的微藻种类数进行了MDS分析(图2), 胁强系数为0.002(小于0.05), 说明尺度分析得到的结果与实际情况能够很好吻合, 可以正确解释样点间的相似关系。根据MDS分析结果, 8种样点大致可以分为3个类群, 类群1为MS、MM, 类群2为WS、MD、WD、WM, 类群3为MF、WF。
水生微藻 256个水体样品中共发现微藻272种, 隶属于8门100属。其中, 绿藻种类最多, 46 属136种, 占总种类数的50.00%; 蓝藻次之, 20属60种, 占22.06%; 硅藻23属58种, 占21.32%; 裸藻有3属6种, 占2.21%; 金藻4属6种, 占2.21%;甲藻2属3种, 占1.10%; 黄藻1属2种, 占0.74%;隐藻1属1种, 占0.37%。
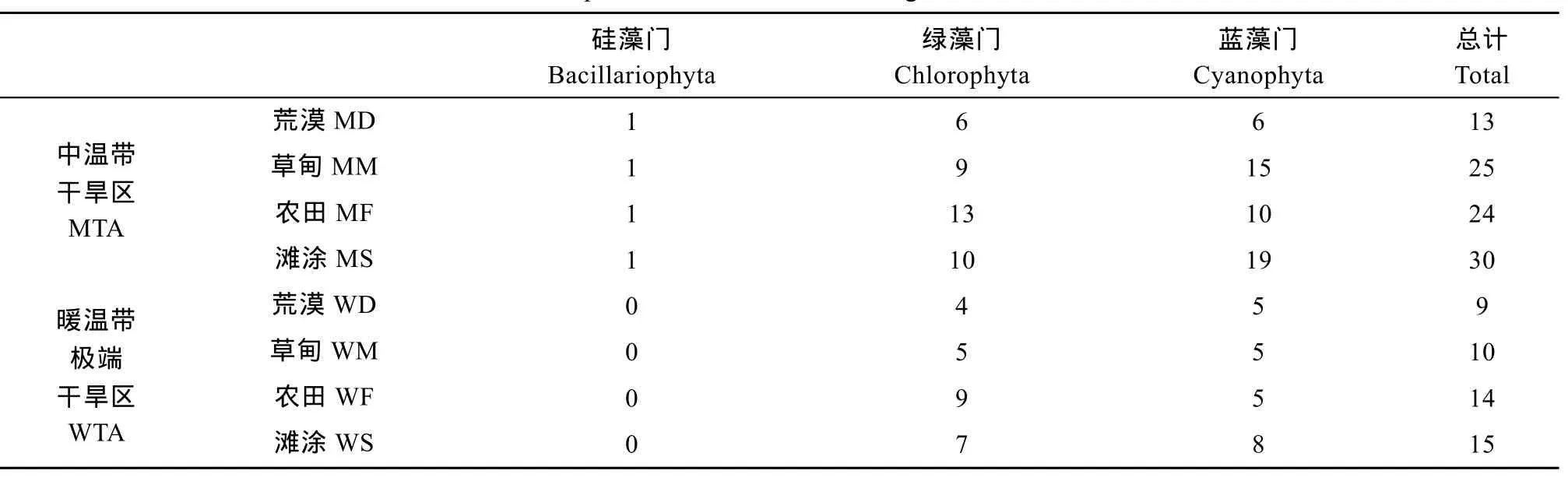
表2 不同生境中的陆生微藻门类组成Tab. 2 The composition of terrestrial microalgae in different habitats
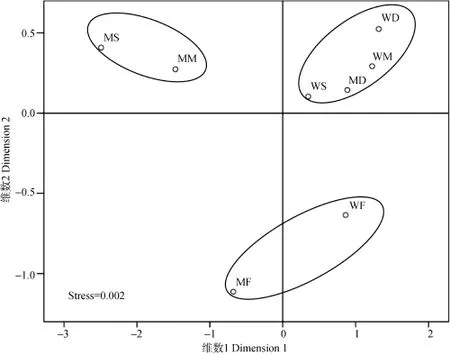
图2 新疆地区8个样点类型下陆生微藻群落的多维尺度分析Fig. 2 Multidimensional Scaling Analysis of terrestrial microalgae communities at 8 sites in Xinjiang region
河流生境下的微藻种类数最为丰富, 水库和湖泊次之, 沟渠最少。水生微藻种类数在中温带干旱区(MTA)均高于暖温带极端干旱区(WTA)(表 3), 与陆生藻分布规律一致。隐藻、甲藻和黄藻仅出现在MTA地区。
通过MDS分析发现(图3), 10种水生生境样点间胁强系数为 0.010(小于 0.05), 说明吻合很好, 可以正确解释样点间的相似关系。将10种采样点分为5个类群, 类群1为MRi、ML; 类群2为WRi、MDi;类群3为WL、WP、WDi、WRe; 类群4为MP; 类群5为MRe。
2.2 微藻优势种统计
陆生微藻 调查区土壤中的优势种共有9种,集中在绿藻门和蓝藻门(表4)。
比较不同气候区的优势种发现, MTA的优势种类(7种)稍高于WTA (4种)。在MTA地区的生境中,小球藻(Chlorella vulgaris)、土生绿球藻(Chlorococcum humicola)和纤细席藻(Phormidium tenue)
是常见的优势种类, 而在 WTA地区, 窝形席藻(Phormidium faveolarum)作为优势种出现在所有采样生境中。
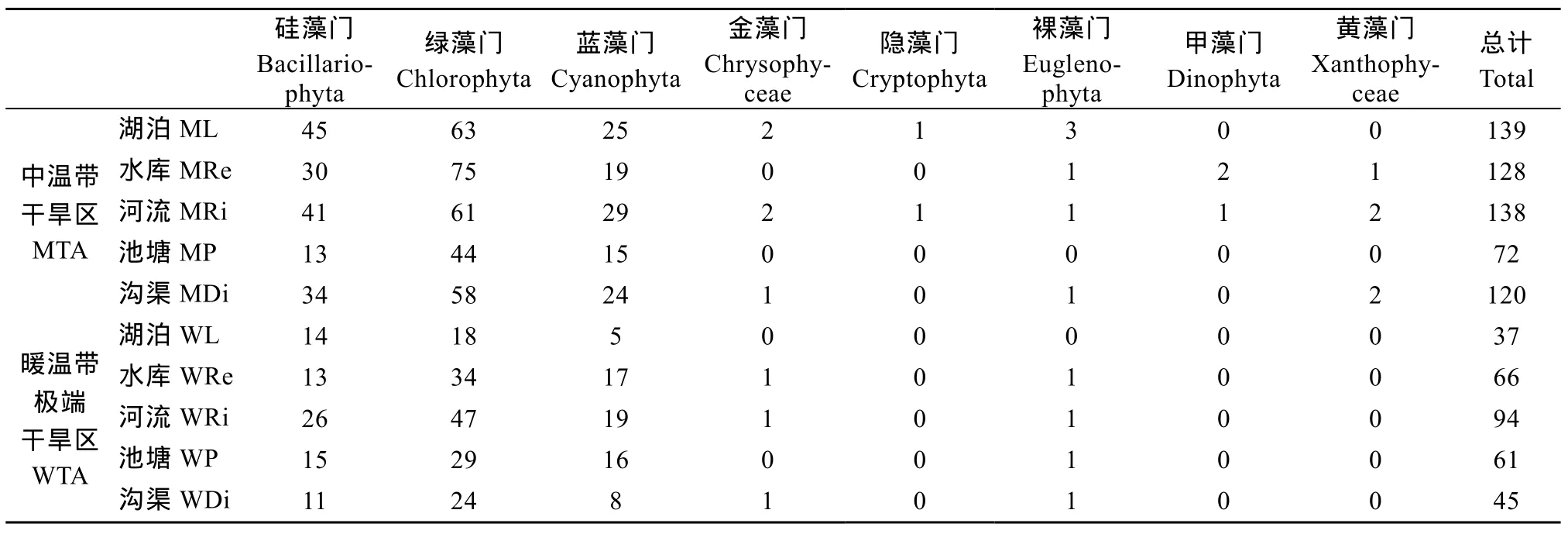
表3 不同生境中的水生微藻门类组成Tab. 3 The composition of aquatic microalgae in different habitats

图3 新疆地区10个样点类型下水生微藻群落的多维尺度分析Fig. 3 Multidimensional Scaling Analysis of aquatic microalgae communities at 10 sites in Xinjiang region
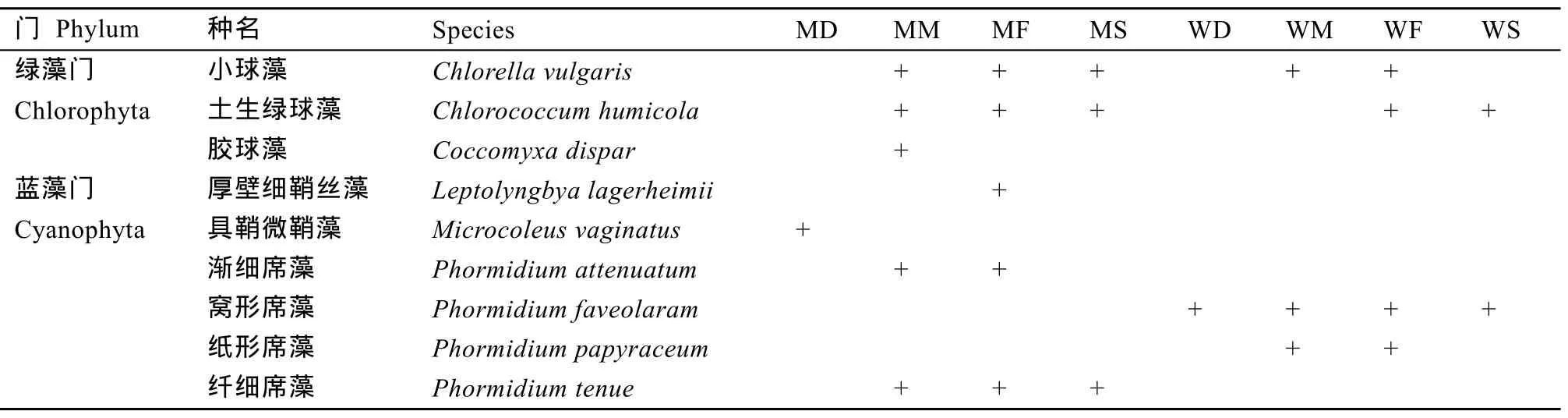
表4 新疆地区8种土壤生境下微藻优势种Tab. 4 The dominant microalgal species of 8 soil habitats in Xinjiang region
对比不同生境下优势种组成发现, 荒漠生境下优势种较单一, 一般为蓝藻门的具鞘微鞘藻和窝形席藻, 而其他生境优势种相对较为丰富。
水生微藻 水环境下微藻优势种出现较陆生生境下更为广泛(表5), 共出现42种, 其中绿藻门最多, 有9属21种, 占总数的50.00%; 硅藻门次之, 有7属11 种, 占26.19%; 蓝藻门最少, 6属10种, 占23.81%。

表5 新疆地区10种水体生境下微藻优势种Tab. 5 The dominant microalgal species of 10 water habitats in Xinjiang region
比较不同气候区优势种组成发现(表5), MTA地区的优势种种数(40种)远高于WTA地区的 (15种)。尽管在MTA和WTA地区有一些共同优势种类的出现, 但在两个气候区相同的生境条件下, 优势种组成仍存在一定差异。例如在湖泊生境下(表6), MTA地区优势种共出现了14种, 而在WTA地区湖泊生境中优势种仅有纤细席藻一种。
不同生境间比较发现(表7), 沟渠生境中所含优势种种类最多, 其次是河流、水库和湖泊, 池塘中所含优势种种类最少。
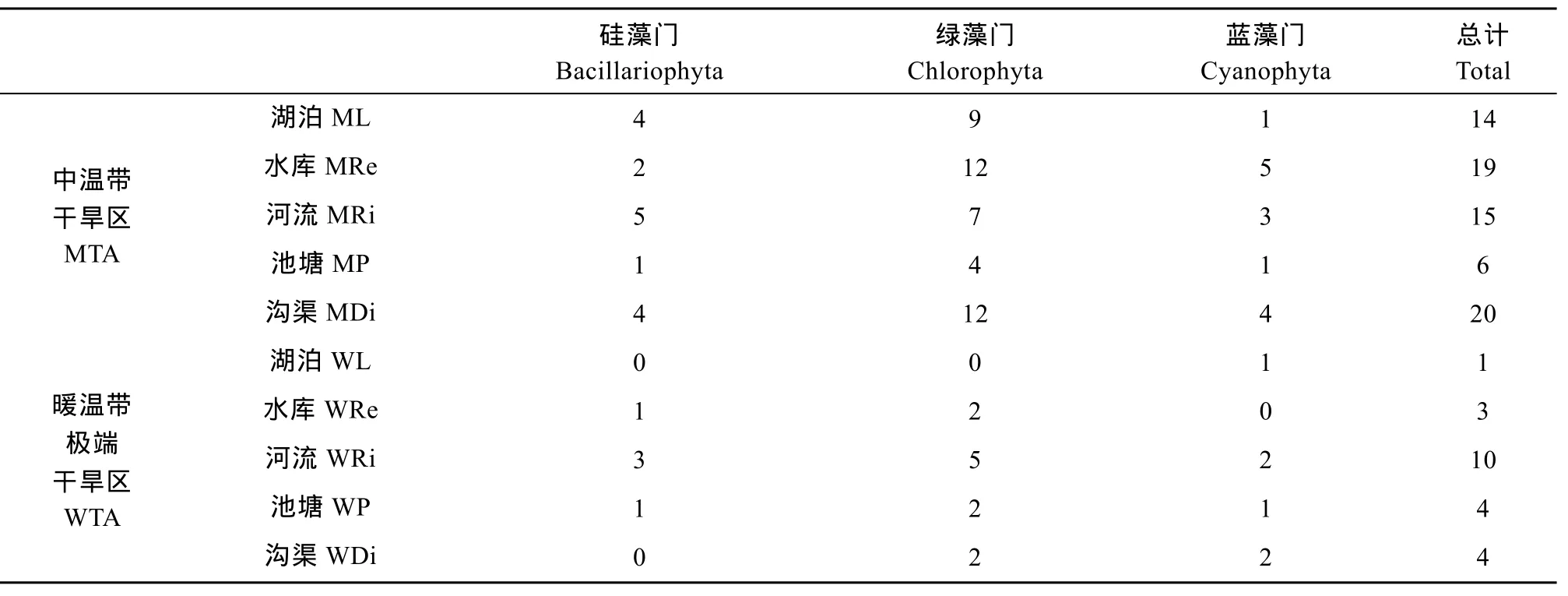
表6 不同气候区5种水体生境下微藻优势种门类组成Tab. 6 The composition of dominant microalgal species in 5 water habitats of different climatic region
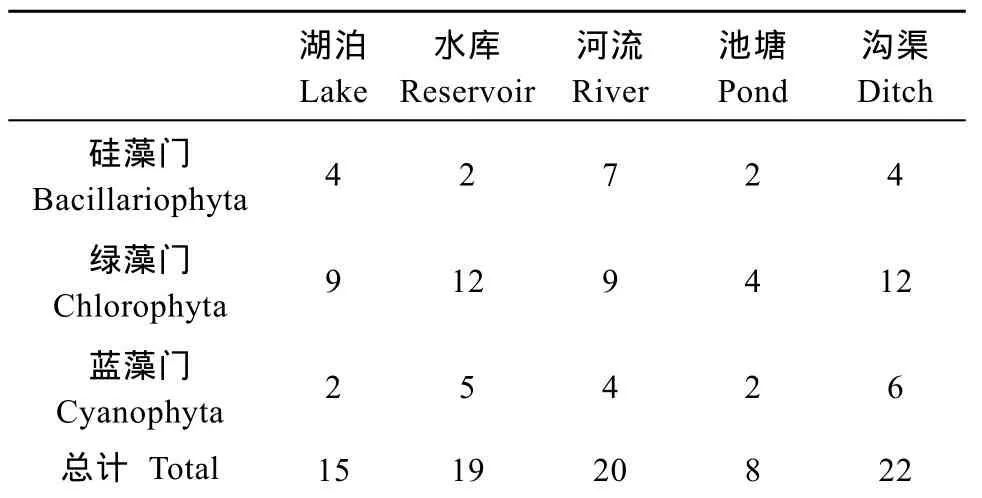
表7 5种水体生境下微藻优势种门类组成Tab. 7 The composition of dominant microalgal species in 5 water habitats
通过MDS分析发现 (图4), 胁强系数为0.169(大于0.05), 说明吻合性一般。大致看出, 2个气候区的湖泊 (WL、ML)、池塘 (WP、MP) 生境较为相近, MRi和WRe较为相近, WDi和WRi较为相近, MDi和MRe均相对独立。
3 讨论
3.1 不同生态系统对微藻的影响
藻类能够适应各种生活条件, 丰富多样的生态环境是藻类多样性的一个重要基础, 因此在研究藻类群落结构时不可忽视对其生态环境的研究[24]。
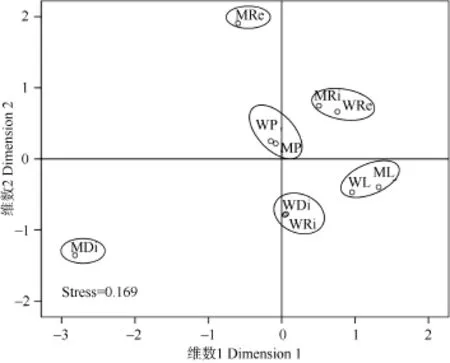
图4 新疆地区10个样点类型下水生微藻优势种组成的多维尺度分析Fig. 4 Multidimensional Scaling Analysis of dominant species of aquatic microalgae at 10 sites in Xinjiang region
本研究通过比较新疆地区土壤微藻和水体微藻种类组成及其优势种发现, 土壤环境中蓝藻种类较为丰富; 而水体环境中绿藻种类占据优势。在这 2种大环境下发现有共同优势种, 即绿藻门的小球藻,以及蓝藻门中丝状的渐细席藻、窝形席藻、纤细席藻, 说明这几种藻对环境的适应性强, 分布广泛。
3.2 不同生境类型对陆生微藻的影响
相较于胡春香等[25]对兰州陆生藻的报道, 蓝藻和绿藻的优势种大体一致, 然而新疆地区陆生藻中硅藻数量较少。滩涂生境的微藻种类最为丰富, 这可能是因为滩涂位于潮浸过渡地带, 易受河流和泥沙的冲刷, 地下水位高, 水质一般为淡水或弱矿化水, 营养丰富, 适于更多的微藻生存。在荒漠生境下微藻种类数最少, 可能与荒漠土本身的特性有关,地表多石砾, 有机质含量低, CaCO3含量高, 盐化和碱化现象明显, 不利于微藻生长。
3.3 不同气候区、生境类型对水生微藻的影响
隐藻、甲藻和黄藻仅出现在 MTA地区, 说明MTA的水质类型多样, 营养程度差别较大。水体环境中黄藻是喜清水的藻种, 说明MTA部分水质属于寡营养型(os)[19]。而啮蚀隐藻(Cryptomonas erosa)和飞燕角甲藻(Ceratium hirundinella)是富营养型(α-ms)水体的指示种, 表明MTA部分水体也存在富营养化隐患[19]。
河流生境下的微藻种类数最为丰富, 大体是绿藻-硅藻-蓝藻型, 其他门类所占比例很小, 这与洪松等[26]有关中国河流水生生物群落的报道相一致,可能由于河流分支多, 尤其大型河流流域面积广阔,流经区域易受到自然环境和社会条件的影响[27], 环境复杂多变, 水体流动, 营养充足, 适于不同微藻种类生存, 因而多样性最为丰富。湖泊生境微藻种类组成也呈绿藻-硅藻-蓝藻型, 与东湖[28]、太湖[29]、巢湖[30]、乌伦古湖[15]的浮游植物种类组成比例大体一致, 与博斯腾湖[16]的不太相似, 它是以硅藻为主要类群。水库生境与三峡水库[31]类型一致, 都以绿藻门、硅藻门种类数居多。沟渠的微藻种类数最少,但其优势种最多, 这可能与其相对单一的环境条件有关。池塘的微藻种类数相对较少, 优势种也不明显, 这说明池塘水质较差, 营养物质供应不足, 环境恶劣, 有利于复杂生态系统的形成。
湖泊生境优势种呈绿藻-硅藻型, 蓝藻门优势种仅为渐细席藻和纤细席藻, 与报道的富营养化湖泊太湖、巢湖、东湖均以蓝藻为绝对优势种, 尤其是微囊藻 Microcystis sp.这一特性不相一致[29—31], 但是针杆藻 Synedra sp.、直链藻 Melosira sp.、栅藻Scenedesmus sp. 也是营养水平较高的湖泊中的常见指示种。水库生境优势种呈绿藻-蓝藻型, 也出现了富营养化指示种群-栅藻和颤藻Oscillatoria sp.[31],说明部分水体同样存在富营养化隐患。
3.4 新疆微藻群落结构
多维尺度分析能在低维空间较好的反映相似矩阵的信息[32], 结果的胁强系数 (Stress) 值可作为MDS 空间构形图拟合度的指标, 当胁强系数值0.20以上为不好、0.10为一般、0.05为好、0.00完全配合[32]。通过 MDS分析了不同气候区不同生境下的微藻种类组成都取得了较理想的结果。整体而言, MTA的微藻种类及优势种数目普遍高于 WTA,土壤环境中MTA的滩涂、草甸和农田藻种资源较为丰富; 水体环境中MTA的湖泊、河流藻种资源较为丰富。这说明南北气候的差异、不同生境类型都会对微藻群落结构有很大影响, 当然与人为干扰、生物因素等也有一定关联, 还需进一步探究。
致谢:
感谢兰书斌博士、张青一博士、欧阳海龙博士在野外采样工作中给予的支持。
[1] Xing D F, Zhang Z, Zhang F Q, et al. Progress in the study of bio- oil fuel production by algae pyrolysis [J]. Chemical Industry, 2008, 26(3): 38—42 [邢定峰, 张哲, 张福琴, 等.藻类热解生产生物质燃料研究进展. 化学工业, 2008, 26(3): 38—42]
[2] Han C C, Yang Y, Liu B R, et al. Influencing factors of soil microbial diversity in grassland [J]. Pratacultural Science, 2014, 31(12): 2242—2250 [韩丛丛, 杨阳, 刘秉儒, 等. 草地土壤微生物多样性影响因子. 草业科学, 2014, 31(12): 2242—2250]
[3] Lundy M. E, Spencer D F, Van Kessel C, et al. Managing phosphorus fertilizer to reduce algae, maintain water quality, and sustain yields in water-seeded rice [J]. Field Crops Research, 2012, 131: 81—87
[4] Cañavate J P, Pérez-Gavilan C, Mazuelos N, et al. Flushing-related changes of phytoplankton seasonal assemblages in marsh ponds of the warm temperate Guadalquivir river estuary (SW Spain) [J]. Hydrobiologia, 2014, 744(1): 15—33
[5] Quintana X D, Arim M, Badosa A, et al. Predation and competition effects on the size diversity of aquatic communities [J]. Aquatic Sciences, 2014, 77(1): 45—57
[6] Hansen G J, Carey C C. Fish and phytoplankton exhibit contrasting temporal species abundance patterns in a dynamic north temperate lake [J]. Plos One, 2015, 10(2): e0115414
[7] Li W. Macroecological patterns of phytoplankton in the northwestern North Atlantic Ocean [J]. Nature, 2002, 419: 154—157
[8] Domingues R B, Barbosa A B, Sommer U, et al. Phytoplankton composition, growth and production in the Guadiana estuary (SW Iberia): unraveling changes induced after dam construction [J]. Science of the Total Environment,2012, 416: 300—313
[9] Dai X G, Wang P, Zhang K J. A study on precipitation trend and fluctuation mechanism in northwestern China over the past 60 years [J]. Acta Physica Sinica, 2013, 62(12): 1—11[戴新刚, 汪萍, 张凯静. 近 60 年新疆降水趋势与波动机制分析. 物理学报, 2013, 62(12): 1—11]
[10] Sand prevention and control leading group in the Xinjiang Uygur Autonomous Region. Desertification and desertification bulletin in Xinjiang [J]. Xinjiang Forestry, 2011, 12: 6—7 [新疆维吾尔自治区防沙治沙领导小组. 新疆荒漠化和沙化状况公报. 新疆林业, 2011, 12: 6—7]
[11] Erkejan, Apar, Yin J X, et al. Characteristic analysis the precipitation in Xinjiang in the past 50 years [J]. Journal of Shihezi University (Natural Science), 2011, 29(6): 737—741[叶尔克江, 阿帕尔, 尹建新, 等. 新疆近50年自然降水量气候变化特征分析. 石河子大学学报(自然科学版), 2011, 29(6): 737—741]
[12] Xue J Z, Cai Z, Wang Q, et al. Phytoplankton ecology of Fuhai reservoir in Xinjiang province [J]. Freshwater Fisheries, 2011, 41(2): 78—87 [薛俊增, 蔡桢, 王琼, 等.新疆福海水库浮游植物生态初步研究. 淡水渔业, 2011, 41(2): 78—87]
[13] Wu H X, Wang Q, Cai Z, et al. Studying the phytoplankton of Hongshan Reservoir in Jimunai [J]. Journal of Hydroecology, 2010, 3(4): 50—54 [吴惠仙, 王琼, 蔡桢, 等. 新疆吉木乃红山水库浮游植物研究. 水生态学杂志, 2010, 3(4): 50—54]
[14] Li J, Zhou Q, Xie C X, et al. Studies on the community structure of periphyton in the Irtysh River of Xinjiang Uygur autonomous region [J]. Acta Hydrobiologica Sinica, 2014, 38(6): 1033—1039 [李君, 周琼, 谢从新, 等. 新疆额尔齐斯河周丛藻类群落结构特征研究. 水生生物学报, 2014, 38(6): 1033—1039]
[15] Liu Y, Chen J Z, Li H, et al. Phytoplankton community structure in Lake Ulungur in Xinjiang Uygur Autonomous Region [J]. Journal of Lake Sciences, 2009, 21(6): 855—864[刘宇, 沈建忠, 李鸿, 等. 新疆乌伦古湖浮游植物群落结构. 湖泊科学, 2009, 21(6): 855—864]
[16] Li H, Ma Y W, Qi F, et al. Phytoplankton in Bosten lake: community characteristics and driving factors [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 921—928 [李红, 马燕武, 祁峰, 等. 博斯腾湖浮游植物群落结构特征及其影响因子分析. 水生生物学报, 2014, 38(5): 921—928]
[17] Jiang Z F, Ren M R, Ren B, et al. Study on population characteristics of plankton in various waters of Xinjiang Aletai area [J]. Chinese Journal Fisheries, 1994, 7(1): 30—39 [姜作发, 任慕莲, 任波, 等. 新疆阿勒泰地区不同水体浮游生物种群特点的初步研究. 水产学杂志, 1994, 7(1): 30—39]
[18] Zhang B, Zhang Y, Downing A, et al. Distribution and composition of cyanobacteria and microalgae associated with biological soil crusts in the Gurbantunggut Desert, China [J]. Arid Land Research and Management, 2011, 25(3), 275—293 [19] Kuang Q J, Ma P M, Hu Z Y, et al. Study on the evaluation and treatment of lakeeutrophication by means of algae biology [J]. Journal of Safety and Environment, 2005, 5(2): 87—91 [况琪军, 马沛明, 胡征宇, 等. 湖泊富营养化的藻类生物学评价与治理研究进展. 安全与环境学报, 2005, 5(2): 87—91]
[20] Zheng J Y, Yin Y T, Li B Y. A new scheme for climate regionalization in China [J]. Acta Geographica Sinica, 2010, 65(1): 3—12 [郑景云, 尹云鹤, 李炳元. 中国气候区划新方案. 地理学报, 2010, 65(1): 3—12]
[21] Hu H J, Wei Y X. The Freshwater Algae of China—Systematics, Taxonomy and Ecology [M]. Beijing: Science Press. 2006, 1023 [胡鸿钧, 魏印心. 中国淡水藻类—系统、分类及生态. 北京: 科学出版社, 2006, 1023]
[22] Bi L J, Hu Z Y. Flora Algarum Sinicarum Aquae Dulcis [M]. Beijing: Science Press. 2004, 198 [毕列爵, 胡征宇. 中国淡水藻志 (5—8、13、15卷). 北京: 科学出版社. 2004, 198]
[23] Zhou F X, Chen J H. Freshwater Microbiological Map [M]. Beijing: Chemical Industry Press. 2010, 367 [周凤霞, 陈剑洪. 淡水微型生物图谱. 北京: 化学工业出版社. 2010, 367]
[24] Qiu X Z, Zhao H X. Community structure and biodiversity of phytoplankton in Shahu Lake, N ingxia [J]. Journal of Hydroecology, 2011, 32(1): 20—26 [邱小琮, 赵红雪. 宁夏沙湖浮游植物群落结构及多样性研究. 水生态学杂志, 2011, 32(1): 20—26]
[25] Hu C X, Zhang B C, Ma H Y, et al. Species composition and community structure of terrestrial algae in the biological crusts of Lanzhou Northern Hill [J]. Journal of Northwest Normal University (Natural Science), 2003, 39(1): 59—63[胡春香, 张斌才, 马红樱, 等. 兰州北山生物结皮中陆生藻种类组成与群落结构. 西北师范大学学报, 2003, 39(1): 59—63]
[26] Hong S, Chen J S. Structure characteristics of aquatic community from the main rivers in China [J]. Acta Hydrobiologica Sinica, 2002, 26(3): 295—305 [洪松, 陈静生. 中国河流水生生物群落结构特征探讨. 水生生物学报, 2002, 26(3): 295—305]
[27] Jiang Y, Peng Q Z, Liao J Y, et al. Advances and prospects for research into phytoplankton and river habitats [J]. Resources Science, 2013, 35(3): 461—472 [江源, 彭秋志,廖剑宇, 等. 浮游藻类与河流生境关系研究进展与展望.资源科学, 2013, 35(3): 464—472]
[28] Ye Y T, Hu S H,Wang Y Y, et al. Phytoplankton community structure from the main district in Dong Lake and its relationship to environmental factors [J]. Journal of Anhui Agricultural Sciences, 2011, 39(23): 14213—14216 [叶艳婷,胡胜华, 王燕燕, 等. 东湖主要湖区浮游植物群落结构特征及其与环境因子的关系. 安徽农业科学, 2011, 39(23): 14213—14216]
[29] Qian K M, Chen Y W, Song X L. Long-term developmentof phytoplankton dominant species related to eutrophication in Lake Taihu [J]. Ecological Science, 2008, 27(2): 65—70 [钱奎梅, 陈宇炜, 宋晓兰. 太湖浮游植物优势种长期演化与富营养化进程的关系. 生态科学, 2008, 27(2): 65—70]
[30] Li J, Cui K, Lu W X, et al. Community dynamics of spring-summer plankton in Lake Chaohu [J]. Acta Hydrobiologica Sinica, 2015, 39(1):185—192 [李静, 崔凯,卢文轩, 等. 春季和夏季巢湖浮游生物群落组成及其动态分析. 水生生物学报, 2015, 39(1): 185—192]
[31] Shen H L, Cai Q H, Shao M L, et al. Community structure characteristics of phytoplankton along a cascade Xiangxi River Basin, Three Gorges Reservior [J]. Journal of Lake Sciences, 2012, 24(2): 197—205 [申恒伦, 蔡庆华, 邵美玲, 等. 三峡水库香溪河流域梯级水库浮游植物群落结构特征. 湖泊科学, 2012, 24(2): 197—205]
[32] Wu R J, Li R X, Zhu M Y, et al. Multivariate analysis with primer on marine phytoplankton community structure in mesocosm system [J]. Oceanologia et Limnologia Sinica, 2006, 37(4): 316—321 [吴荣军, 李瑞香, 朱明远, 等. 应用 PRMER 软件进行浮游植物群落结构的多元统计分析.海洋与湖沼, 2006, 37(4): 316—321]
THE MICROALGAE AND THEIR COMMUNITY STRUCTURE IN XINJIANG AREA
WU Lei1, 2, XU Liang-Liang1and HU Chun-Xiang1
(1. Key Laboratory of Algal Biology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
We conducted studies in May 2013 and June 2014 in Xinjiang to better understand the community structure of microalgae in this area and the impacts of habitational environments on their distribution. The sampling sites were located in different aquatic (lakes, rivers, ditches, ponds, reservoirs) and terrestrial (deserts, meadows, farmlands, shallows) habitats in Xinjiang. Two hundred and twenty microalgae samples were collected including 185 water samples and 35 soil samples. Seventy-seven species of terrestrial microalgae were identified, and 9 of them (mainly Cyanophyta and Chlorophyta) were dominant, such as Phormidium, Microcoleus vaginatus, and Chlorococcum humicola. There were 272 of aquatic species, 42 of which were dominant, and the dominant species were a complex of Chlorophyta, Bacillariophyta and Cyanophyta, including Oscillatoria, Phormidium, Scenedesmus, Monoraphidium, Navicula and so on. Compared to the southern warm-temperate extreme arid zone, microalgae species were more abundant in the northern mid-temperate arid zone, especially enriched in shallows, rivers and lakes. According to the multidimensional scaling analysis, terrestrial habitats such as beaches and meadows had similar community structures of microalgae in the same climate zone, while deserts and farmlands had the same community structure in spite of the climate difference. As for the aquatic habitats, there were remarkable differences in the community structure between rivers and other 4 aquatic habitats in the warm-temperate extreme arid zone; in the mid-temperate arid zone, the community structures in the lakes and rivers were similar, but there was a great difference among other aquatic habitats. Our study indicated that different climates and habitational environments may have impacts on microalgae species.
Xinjiang; Microalgal species; Dominant species; Community structure; Multidimensional Scaling
S932.8
A
1000-3207(2015)06-1207-10
10.7541/2015.157
2014-11-05;
2015-04-11
科技部科技基础性工作专项(2012Y112900)资助
吴蕾(1989—), 女, 河南开封市人; 工程硕士; 主要从事微藻生物质研究工作。E-mail: wulei545545@163.com
胡春香, 女, 研究员; E-mail: cxhu@ihb.ac.cn
