扇形游仆虫和红色伪角毛虫丙氨酸转氨酶基因的分子克隆与序列分析
2015-03-01刘书兴洪雅真林晓凤李继秋
刘书兴 洪雅真 林晓凤 李继秋
(华南师范大学生命科学学院, 广东省高等学校生态与环境科学重点实验室, 原生动物实验室, 广州 510631)
研究简报
扇形游仆虫和红色伪角毛虫丙氨酸转氨酶基因的分子克隆与序列分析
刘书兴 洪雅真 林晓凤 李继秋
(华南师范大学生命科学学院, 广东省高等学校生态与环境科学重点实验室, 原生动物实验室, 广州 510631)
原生动物是低等的真核生物, 具有个体微小, 结构简单, 繁殖迅速等生物学特征, 是一类复杂的、生理学功能高度集中的单细胞动物[1]。原生动物在地球上分布极广,是微食物网的重要组成部分, 在自然界物质循环和能量流动中具有枢纽作用, 因此具有重要的生态学功能和地位[2]。再者, 许多种类对栖息地环境变化十分敏感, 常作为环境指示生物用于水环境监测中[3, 4]。因此开展原生动物的生态学及其相关学科研究具有重要意义。
代谢酶活性及其基因表达水平作为重要的生物标记物已被广泛应用于环境监测和风险评估中[5, 6]。丙氨酸转氨酶(Alanine aminotransferase, EC 2.6.1.2)是一种以磷酸吡哆醛为辅酶的代谢酶, 其广泛存在于有机体内, 通过催化丙氨酸和酮戊二酸与谷氨酸和丙酮酸之间的可逆反应把生物体内的糖代谢与氨基酸代谢相联[7, 8], 因此丙氨酸转氨酶在糖异生、氨基酸代谢等细胞进程中具有重要作用。丙氨酸转氨酶活性常作为指示生物组织和细胞损伤程度的重要指标[9], 使其在生态毒理学中作为生物标志物具有巨大的应用前景。但是有关原生动物丙氨酸转氨酶活性及其基因表达作为生物标记物的研究尚未见报道。
开展相关酶的分子克隆与序列分析则是研究其应用的前提和基础。指示生物物种间生物标记物的物种间差异一直是生物监测领域的研究热点[10, 11]。基于此, 本研究拟对扇形游仆虫和红色伪角毛虫ALT基因全长cDNA进行克隆、序列分析、系统进化等方面的研究, 旨在为扇形游仆虫和红色伪角毛虫作为海洋水体的指示生物及其 ALT在生态毒理学研究提供前期的信息和资料。
1 材料与方法
1.1 材料
本研究所用扇形游仆虫(Euplotes vannus)和红色伪角毛虫(Pseudokeronopsis rubra)均采自大亚湾沿岸, 于华南师范大学原生动物学研究室种库 16℃、用灭菌海水在培养皿(D=9 cm)中并加以大米粒富集细菌单克隆培养保种。
总RNA极速抽提试剂盒(RNAfast200)购自上海飞捷生物技术有限公司; RQ1 RNase-FreeDNase购自Promega公司; 琼脂糖DNA纯化回收试剂盒购自天根生化科技有限公司, DH5α大肠杆菌(Escherichia coli)感受态购自广州东胜生物科技有限公司, pMD18-T vector、Ex Taq DNA聚合酶、M-MLV RTase cDNA Synthesis Kit、SMARTerTMRACE cDNA Amplification Kit购自宝生物工程(大连)有限公司。
1.2 RNA的提取与cDNA合成
采用孔径为20 µm的筛绢初步富集处于对数生长期的扇形游仆虫和红色伪角毛虫, 溶菌酶处理24h后, 灭菌海水冲洗, 离心(3000 r/m, 3min)富集得到的虫体(细胞数>2×105)用于提取总RNA。按照试剂盒说明书(RNAfast200)依次进行裂解、去除杂质和洗脱获得总RNA。经DNase消化, M-MLV RTase反转录合成的cDNA为供试材料。5′和3′RACE-Ready cDNA分别使用SMARTerTMRACE试剂盒中的5′-CDS Primer A和3′-CDS Primer A反转录合成。
1.3 纤毛虫ALT全长cDNA的克隆
根据 NCBI中已报道的原生生物的丙氨酸转氨酶氨基酸序列, 进行同源性比对, 依据保守区域的氨基酸序列利用 Primer Premier 5.0设计简并引物 Akf和 Akr(表1)(由上海生工生物技术服务有限公司合成)。分别以扇形游仆虫cDNA和红色伪角毛虫cDNA为模板, 使用设计的兼并引物扩增扇形游仆虫 ALT (EvALT)和红色伪角毛虫ALT (PrALT)的部分片段。依照琼脂糖DNA纯化回收试剂盒说明, 对目的产物进行切胶回收。参考pMD18-T Vector连接试剂盒中的说明书将目的基因连接到pMD18-T载体上, 并转入DH5α大肠杆菌感受态细胞。挑取单菌落进行菌落 PCR检测, 同时进行 LB液体培养基摇菌。选取经PCR检测, 且产物条带大小正确的单菌落对应的菌液,送深圳华大基因科技有限公司测序鉴定。
经NCBI BLAST分析检测测序结果为所需的目的基因。在获得EvALT和PrALT DNA片段基础上, 设计特异性引物Ev-5′、Ev-3′和Pr-5′、Pr-3′(表1), 结合SMARTerTMRACE cDNA Amplification 试剂盒中的通用引物NUP(表1)进行5′和3′RACE-PCR, 分别扩增EvALT的5′、3′端序列和PrALT的5′、3′端序列。扩增体系及循环参数根据试剂盒说明书进行设置。PCR产物的回收、连接、转化及测序同前。测序结果在 NCBI上进行比对分析, 确定为目的片段, 将5′端和3′端序列与目的基因片段序列进行拼接,获得EvALT cDNA全长和PrALT cDNA全长。
1.4 ALT氨基酸序列分析
在 GenBank数据库中进行基因序列相似性和同源性查找, 利用BioEdit软件进行同源性比对。全长序列的开放阅读框(Open Read Frame, ORF)序列使用DNAstar软件进行分析。用DNAstar的EditSeq程序将获得的ALT cDNA全长序列进行翻译, 获得氨基酸序列后, 在NCBI protein blast上进行检测[12]。对该蛋白质的等电点和相对分子量利用在线程序Compute pI/Mw tool进行评估, 蛋白质的亲/疏水性分析利用DNAstar的Protein工具[13], I-TASSER蛋白模型预测软件预测蛋白质的空间结构, 应用SignalP4.1和TMHMM2.0在线分析软件预测该蛋白的信号肽[14], 判断其是否属于分泌蛋白以及形成跨膜结构域等。
1.5 ML进化树的构建
从GenBank数据库中获得19条ALT蛋白序列, 其中3条来自纤毛虫原生动物。利用BioEdit软件进行序列比对, 并用Phyml软件构建ALT的最大似然树。
2 结果
2.1 ALT基因全长cDNA序列的克隆和分析
扇形游仆虫ALT序列特征 克隆得到扇形游仆虫ALT的中间片段序列为255 bp, 5′端序列为433 bp, 3′端序列为713 bp且含有Poly A结构及终止密码子TAA。拼接后最终获得长度为1231 bp的EvALT cDNA全长序列, 最大开放阅读框为1095 bp, 编码364个氨基酸, 预测分子量约为 40.95 kD, 等电点为 4.74, GenBank登录号为KP100062。该氨基酸组成中带正电荷氨基酸(K、R)33个, 占9.07%, 带负电荷氨基酸(D、E)51个, 占14.01%, 整个蛋白带负电荷, 疏水性氨基酸(A、I、L、F、W、V)116 个, 占31.87%, 极性氨基酸(N、C、Q、S、T、Y)102个, 占 28.02%。亲/疏水性分析结果显示: EvALT蛋白在23—68、98—115、205—230、301—329和 355—364区域为疏水性区域, 在1—19、82—99、138—160、230—260 和324—354区域为亲水区域。信号肽预测结果显示该基因编码的多肽链无信号肽, 不属于分泌蛋白, 未形成跨膜结构域。纤毛虫属于单细胞生物, 因此该蛋白为胞内酶。
红色伪角毛虫ALT序列特征 克隆得到红色伪角毛虫ALT的中间片段序列为259 bp, 5′端序列为463 bp, 3′端序列为760 bp且含有Poly A结构及终止密码子TGA。拼接后最终获得长度为1164 bp的PrALT cDNA全长序列,最大开放阅读框为1077 bp, 编码358个氨基酸, 预测分子量约为40.22 kD, 等电点为5.23, GeneBank登录号为KP100063。该氨基酸组成中带正电荷氨基酸(K、R)36个, 占10.06%, 带负电荷氨基酸(D、E)45个, 占12.57%, 整个蛋白带负电荷, 疏水性氨基酸(A、I、L、F、W、V)105 个, 占29.33%, 极性氨基酸(N、C、Q、S、T、Y)101个, 占28.21%。亲/疏水性结果显示: PrALT蛋白在15—23、36—50、128—138和 350—360区域为疏水性区域, 在1—15、75—110、145—180、230—275和322—353区域为亲水区域。信号肽预测结果显示该基因编码的多肽链无信号肽, 不属于分泌蛋白, 未形成跨膜结构域。
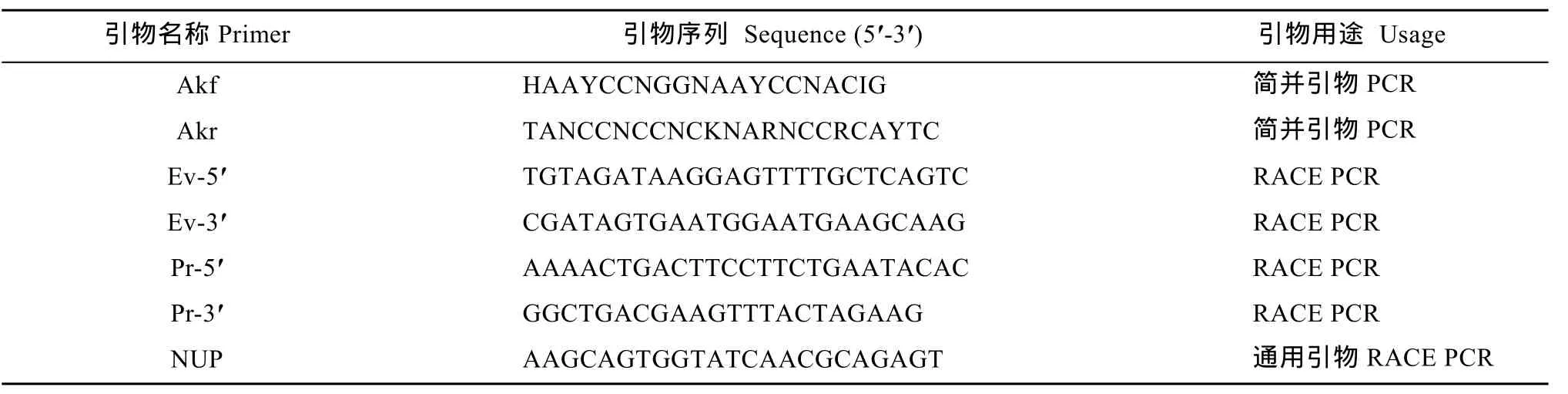
表1 本文研究所用引物及用途Tab. 1 Sequences of primers used in this study
2.2 ALT氨基酸序列比对分析和基因功能区域
将获得的 EvALT编码的氨基酸序列通过 BLAST P搜索 NCBI的蛋白质数据库, 发现该序列与三棱尖毛虫(Oxytricha trifallax)的ALT氨基酸序列同源性为49%; 与草履虫(Paramecium tetraurelia)的 ALT氨基酸序列同源性为50%; 与尾刺耐格里原虫(Naegleria gruberi)的 ALT氨基酸序列同源性为49%。将获得的PrALT编码的氨基酸序列通过BLAST P搜索NCBI的蛋白质数据库, 发现该序列与三棱尖毛虫的 ALT氨基酸序列同源性为 64%;与小瓜虫(Ichthyophthirius multifiliis)的 ALT氨基酸序列同源性为50%。
保守区域分析显示, EvALT和PrALT氨基酸序列都包括一个完整的I型转氨酶亚基和 10个保守的辅酶磷酸吡哆醛(PLP)结合位点。因此, 可以判断扩增得到的两条cDNA全长序列为丙氨酸转氨酶蛋白家族基因。
2.3 丙氨酸转氨酶蛋白的空间结构
I-TASSER蛋白模型预测扇形游仆虫丙氨酸转氨酶和红色伪角毛虫丙氨酸转氨酶蛋白二级结构, 结果如图1、2所示, 由无规则卷曲、α-型螺旋和β型结构组成。
I-TASSER蛋白模型预测软件结果表明扇形游仆虫ALT和红色伪角毛虫ALT与人类ALT2 (PDB:3ihjA)结构相似性最高, 分别达 43%和 42%。因此选取人类的ALT2为模板, 预测扇形游仆虫 ALT和红色伪角毛虫ALT的空间结构, 结果如图3、4所示。I-TASSER预测结果表明, 扇形游仆虫ALT的预测结合位点和红色伪角毛虫ALT的预测结合位点与大麦(Hordeum vulgare)ALT (PDB:3tcmA)的预测结合位点的整体相似性分别达97.8% 和97.7%。
2.4 ALT氨基酸序列系统发育分析
ALT氨基酸序列构建最大似然树(图 5)。结果显示,扩增得到的EvALT和PrALT氨基酸序列与三棱尖毛虫、嗜热四膜虫(Tetrahymena thermophila)、以及草履虫ALT氨基酸序列聚为一簇, 亲缘关系最近。氨基酸序列聚类分析表明, EvALT和PrALT氨基酸序列与其他纤毛虫种类的 ALT氨基酸序列同源性均较高, 进一步证实该蛋白应属于丙氨酸转氨酶家族成员。
3 讨论

图1 扇形游仆虫ALT蛋白二级结构图(黑色实线表示无规卷曲; 波浪线表示α-型螺旋; 箭头实线表示β-型结构)Fig. 1 Predicted secondary structure of E. vannus ALT (Randon coil is indicated with black solid lines; α-helix is indicated with wavy lines; β-sheet is indicated with arrow lines)

图2 红色伪角毛虫ALT蛋白二级结构图(黑色实线表示无规卷曲; 波浪线表示α-型螺旋; 箭头实线表示β-型结构)Fig. 2 Predicted secondary structure of P. rubra ALT (Randon coil is indicated with black solid lines; α-helix is indicated with wavy lines; β-sheet is indicated with arrow lines)

图3 I-TASSER蛋白模型预测的扇形游仆虫ALT空间结构Fig. 3 The spatial structure of E. vannus ALT predicted by I-TASSER protein model
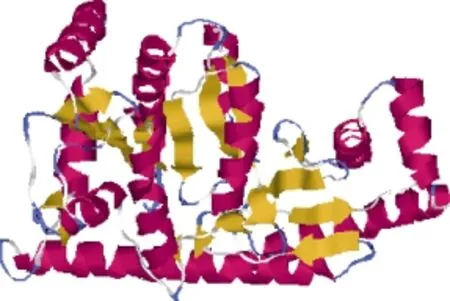
图4 I-TASSER蛋白模型预测的红色伪角毛虫ALT空间结构Fig. 4 The spatial structure of P. rubra ALT predicted by I-TASSER protein model
扇形游仆虫和红色伪角毛虫均为海洋水体中习见种,主要生活在水体底部, 具有部分重叠的生态位。扇形游仆虫通常为长方形, 但在营养充分时虫体常变形为阔椭圆形, 可在大范围盐度变化的环境内存活并极易繁殖为水体内的优势种[15]; 红色伪角毛虫体型细长, 运动较慢,主要以各类小型原生生物为食[16]。因其自身的特点, 扇形游仆虫和红色伪角毛虫在生态毒理学中常作为检测水体重金属、杀虫剂等污染的指示生物[17]。
代谢活力和代谢途径改变是生物体生长发育过程中提高抗逆性的一条重要途径[18], 具有重要的生理意义。转氨酶是一类以磷酸吡哆醛为辅酶的代谢酶, 而丙氨酸转氨酶是丙氨酸代谢途径的一个关键酶和限速酶[19], 其表达强度和酶活性将会影响生物个体的生长状况。本研究所克隆得到的扇形游仆虫丙氨酸转氨酶和红色伪角毛虫丙氨酸转氨酶均具有转氨酶家族Ⅰ所具有的典型结构特点[20],转氨酶家族Ⅰ的一个保守亚基折叠形成一个倒 U型的空间结构, 该结构特点使辅酶 PLP与丙氨酸转氨酶蛋白结合较为松弛[21], 导致酶活性变化易于受外源异质性物质影响。为此, 丙氨酸转氨酶家族Ⅰ所具有的典型结构特点为丙氨酸转氨酶作为生物标记物提供了结构上的可能。Wee等[22]研究发现鲶鱼丙氨酸转氨酶活性能对养殖水体氨态盐梯度变化做出敏感响应, 表明了该酶具有作为环境监测生物标记物的巨大潜力。
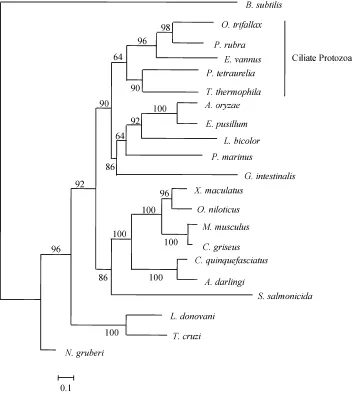
图5 根据不同物种的ALT氨基酸序列构建的最大似然树Fig. 5 Phylogenetic tree inferred from different species of ALT amino acid sequences using maximum likelihood method
对 ALT构建最大似然树及聚类分析, 可为不同物种间ALT亲缘关系进行比较分析。三棱尖毛虫、嗜热四膜虫和草履虫都属于纤毛虫原生动物, 系统发育树显示扇形游仆虫和红色伪角毛虫与以上三种纤毛虫的ALT聚集为一簇, 亲缘关系最近; 而与鱼类和哺乳类动物的 ALT亲缘关系较远, 这与动物的经典分类一致。推测也可能是ALT在进化过程中处于环境选择性等压力支配下发生了演化, 以适应不同物种在不同的环境中更有利于发挥其生物学功能[23]。
本工作可为深入探究原生动物ALT酶活性、基因表达和蛋白表达等作为生物标记物的研究提供重要的生物学信息。如将扇形游仆虫和红色伪角毛虫作为指示生物,通过测定扇形游仆虫和红色伪角毛虫丙氨酸转氨酶活性、基因表达和蛋白表达的变化, 监测海洋养殖水体中渔药、铵态氮和重金属等污染状况。但是有关生物标记物的反应模式与剂量间的关系受诸多因素的影响, 例如, 物种特异性、暴露时间、污染物性质等, 因此, 评价酶活性、基因表达和蛋白表达等作为生物标记物的有效性, 还需要针对以上影响因素做进一步的研究。
[1] Song W B, Zhao Y J, Xu K D, et al. Pathogenic Protozoa in Mariculture [M]. Beijing: Science Press. 2003, 10 [宋微波,赵元 莙, 徐奎栋, 等. 海水养殖中的危害性原生动物. 北京: 科学出版社. 2003, 10]
[2] Zhang W, Wang R. Summertime ciliate and copepod nauplii distributions and micro-zooplankton herbivorous activity in the Laizhou Bay, Bohai Sea, China [J]. Estuarine, Coastaland Shelf Science, 2000, 51(1): 103—114
[3] Sauvant M P, Pepin D, Bohatier J, et al. Effects of chelators on the acute toxicity and bioavailability of aluminium to Tetrahymena pyriformis [J]. Aquatic Toxicology, 2000, 47: 259—275
[4] Nicolau A, Mota M, Lima N. Effect of different toxic compounds on ATP content and acid phosphatase activity in axenic cultures of Tetrahymena pyriformis [J]. Ecotoxicology and Environmental Safety, 2004, 57(2): 129—135
[5] Xu J, Jing N. Effects of 2,4-dinitrotoluene exposure on enzyme activity, energy reserves and condition factors in common carp (Cyprinus carpio) [J]. Journal of Hazardous Materials, 2012, 203—204(4): 299—307
[6] Nair P M, Park S Y, Lee S W, et al. Differential expression of ribosomal protein gene, gonadotrophin releasing hormone gene and Balbiani ring protein gene in silver nanoparticles exposed Chironomus riparius [J]. Aquatic Toxicology, 2011, 101(1): 31—37
[7] Anemaet I G, Metón I, Salgado M C, et al. A novel alternatively spliced transcript of cytosolic alanine aminotransferase gene associated with enhanced gluconeogenesis in liver of Sparus aurata [J]. The International Journal of Biochemistry & CellBiology, 2008, 40(12): 2833—2844
[8] Zelada C, Montemartini M, Cazzulo J J, et al. Purification and partial structural and kinetic characterization of an alanine aminotransferase from epimastigotes of Trypanosoma cruzi [J]. Molecular and Biochemical Parasitology, 1996, 79: 225—228
[9] Cajaraville M P, Bebianno M J, Blasco J, et al. The use of biomarkers to assess the impact of pollution in coastal environments of the Iberian Peninsula: a practical approach [J]. The Science of the Total Environment, 2000, 247: 295—311
[10] Castro-Ferreira M P, Roelofs D, van Gestel C A, et al. Enchytraeus crypticus as model species in soil ecotoxicology [J]. Chemosphere, 2012, 87(11): 1222—1227
[11] Duquesne S, Riddle M, Schulz R, et al. Effects of contaminants in the Antarctic environment–potential of the gammarid amphipod crustacean Paramorea walkeri as a biological indicator for Antarctic ecosystems based on toxicity and bioacccumulation of copper and cadmium [J]. Aquatic Toxicology, 2000, 49: 131—143
[12] Wang R, Xiao Q, Gui J F. Molecular cloning and expression analysis of fructose-1, 6-bisphosphatase in gibel carp [J]. Acta Hydrobiologica Sinica, 2010, 34(6): 1131—1135 [王锐,肖青, 桂建芳. 银鲫果糖-1,6-二磷酸酶的分子克隆与表达分析. 水生生物学报, 2010, 34(6): 1131—1135]
[13] Hu M Q, Xiao R L, Zhang Z Y, et al. Cloning and character analyses on acidic ribosomal proten gene from Euplotes octocarinatus [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 546—551 [胡苗清, 肖瑞琳, 张志云, 等. 八肋游仆虫酸性核糖体蛋白基因克隆与特征分析. 水生生物学报, 2012, 36(3): 546—551]
[14] Sun J, Wang B J, Sun S J, et al. CDNA cloning and sequence analysis of hemocyanin in Fenneropenaeus chinensis [J]. Progress in Fishery Sciences, 2010, 31: 80—87 [孙杰, 王宝杰, 孙姝娟, 等. 中国对虾血蓝蛋白基因cDNA的克隆与序列分析. 渔业科学进展, 2010, 31: 80—87]
[15] Song W. On two marine cyrtophorid ciliates from China, with description of Chlamydonella derouxi nov. spec. and Orthotrochilia pilula (Deroux, 1976) nov. comb., and reestablishment of the genus Orthotrochilia nov. gen. (Protozoa, Ciliophora, Cyrtophorida) [J]. Hydrobiologia, 2003, 499: 169—177
[16] Song W, Warren A, Roberts D, et al. Comparison and redefinition of four marine, coloured Pseudokeronopsis spp. (Ciliophora: Hypotrichida), with emphasis on their living morphology [J]. Acta Protozoologica, 2006, 45: 271—287
[17] Gomiero A, Sforzini S, Dagnino A, et al. The use of multiple endpoints to assess cellular responses to environmental contaminants in the interstitial marine ciliate Euplotes crassus [J]. Aquatic Toxicology, 2012, 114—115: 206—216
[18] Cramer G R, Ergül A, Grimpletet J, et al. Water and salinity stress in grapevines: early and late changes in transcript and metabolite profiles [J]. Functional & Integrative Genomics, 2007, 7(2): 111—134
[19] Kikuchi H, Hirose S, Toki S, et al. Molecular characterization of a gene for alanine aminotransferase from rice (Oryza sativa) [J]. Plant Molecular Biology, 1999, 39: 149—159
[20] Tanase S, Kojima H, Morino Y. Pyridoxal 5′-phosphate binding site of pig heart alanine aminotransferase [J]. Biochemistry, 1979, 18(14): 3002—3007
[21] Duff S M, Rydel T J, McClerren A L, et al. The enzymology of alanine aminotransferase (AlaAT) isoforms from Hordeum vulgare and other organisms, and the HvAlaAT crystal structure [J]. Archives of Biochemistry and Biophysics, 2012, 528(1): 90—101
[22] Wee N L, Tng Y Y, Cheng H T, et al. Ammonia toxicity and tolerance in the brain of the African sharptooth catfish, Clarias gariepinus[J]. Aquatic Toxicology, 2007, 82, 204—213
[23] Nam H, Conrad T M, Lewis N E. The role of cellular objectives and selective pressures in metabolic pathway evolution [J]. Current Opinion in Biotechnology, 2011, 22(4): 595—600
CLONING AND CHARACTERIZATION OF ALT GENE IN TWO SPECIES OF CILIATES (EUPLOTES VANNUS AND PSEUDOKERONOPSIS RUBRA)
LIU Shu-Xing, HONG Ya-Zhen, LIN Xiao-Feng and LI Ji-Qiu
(Laboratory of Protozoology, Key Laboratory of Ecology and Environment Science in Guangdong Higher Education, College of Life Science, South China Normal University, Guangzhou 510631, China)
扇形游仆虫; 红色伪角毛虫; 丙氨酸转氨酶; RACE; 序列分析
Euplotes vannus; Pseudokeronopsis rubra; Alanine aminotransferase; RACE; Sequence characterization
Q344+.1
A
1000-3207(2015)06-1261-05
10.7541/2015.165
2014-09-23;
2015-03-23
国家自然科学基金项目(31222050, 41476128)资助
刘书兴(1989—), 男, 江西上饶人; 硕士; 研究方向为生态毒理学。E-mail: liushuxing66@163.com
李继秋, E-mail: lijiqiu@126.com
