小鼠肝内胆管上皮细胞的分离与鉴定
2015-02-27王艳红张蓓蓓汤仁仙郑葵阳徐州医学院病原生物学与免疫学教研室感染与免疫实验室江苏徐州221004
王艳红,张 波,李 波,张蓓蓓,于 倩,颜 超,华 慧,汤仁仙,郑葵阳(徐州医学院病原生物学与免疫学教研室,感染与免疫实验室,江苏徐州221004)
小鼠肝内胆管上皮细胞的分离与鉴定
王艳红,张波,李波,张蓓蓓,于倩,颜超,华慧,汤仁仙,郑葵阳*
(徐州医学院病原生物学与免疫学教研室,感染与免疫实验室,江苏徐州221004)
摘 要:为建立一种简单可靠的小鼠肝内胆管上皮细胞(MIBECs)分离培养方法,用Ⅳ型胶原酶进行门静脉灌注,取出肝内胆管,用DNaseⅠ、pronase E和Ⅳ型胶原酶分类消化,小鼠肝内胆管组织细小、均匀的细胞团培养于含100mL/L胎牛血清(FBS)和10ng/mL表皮生长因子(EGF)、肝细胞生长因子(HGF)和胰岛素转铁蛋白硒(ITS)的DMEM/F12培养基中。细胞贴壁后,利用细胞角蛋白19免疫荧光法鉴定目的细胞。在培养的过程中,用CCK8测定细胞的生长曲线。结果显示,成功分离出MIBECs,细胞纯度约95%。细胞培养3d~7d内呈对数生长状态。以上结果表明本分离培养方法是一种简单可靠的小鼠肝内胆管上皮细胞分离纯化培养技术。
关键词:小鼠;肝内胆管上皮细胞;分离;鉴定;培养
肝内胆管上皮细胞(intrahepatic bile duct epithelial cells,IBECs)约占肝细胞总数的5%,其在肝内胆道系统内形成复杂的网状管形结构[1]。IBECs具有复杂的生理代谢功能,参与肝脏的代谢、排泌、免疫等生理过程,在肝脏疾病的发生发展过程中起一定的作用。研究表明,常见的肝内胆管病变例如原发性硬化性胆管炎[2]、胆管癌[3]等疾病,都是以IBECs为病变靶位,进而引起肝内胆管上皮损伤。因此,了解正常IBECs的生物学特征和病变IBECs的病理特征对研究肝内胆管病变的发病机制、诊断和治疗具有重要意义。由于小鼠是最常用的实验动物,并且MIBECs对各种试验具有重要的意义。目前,虽然已经存在一些分离和鉴定MIBECs的方法,但这些方法均有一定的缺点,如分离步骤多、分离时间长、活性和收率相对较低、花费多等[4]。为进一步改善和解决这些问题,经过反复试验,成功分离、鉴定、培养了MIBECs,为研究肝内胆管的生理功能和相关疾病奠定了一定的基础。
1 材料与方法
1.1材料
1.1.1实验动物 6周龄Balb/c小鼠,平均体重18g,雌雄不拘,为扬州大学动物实验中心产品。
1.1.2试剂 DMEM/Fl2培养基、100×ITS为Gibco公司产品;pronase E为Roche公司产品;表皮生长因子(EGF)、肝细胞生长因子(HGF)为PeproTech公司产品;100mL/L胎牛血(FBS)为四季青公司产品;青链霉素、Ⅰ型鼠尾胶原、Ⅵ型胶原酶、DNaseⅠ、CCK8为Sigma公司产品;兔抗小鼠细胞角蛋白19抗体(CK19)为Santa Cruze公司产品;Alexa Fluor○R594驴抗兔IgG荧光二抗为introvigen公司产品。
1.2方法
1.2.1MIBECs的分离与培养
1.2.1.1小鼠经麻醉后行门静脉插管[5],DMEM培养基驱除肝内血液(图1)。
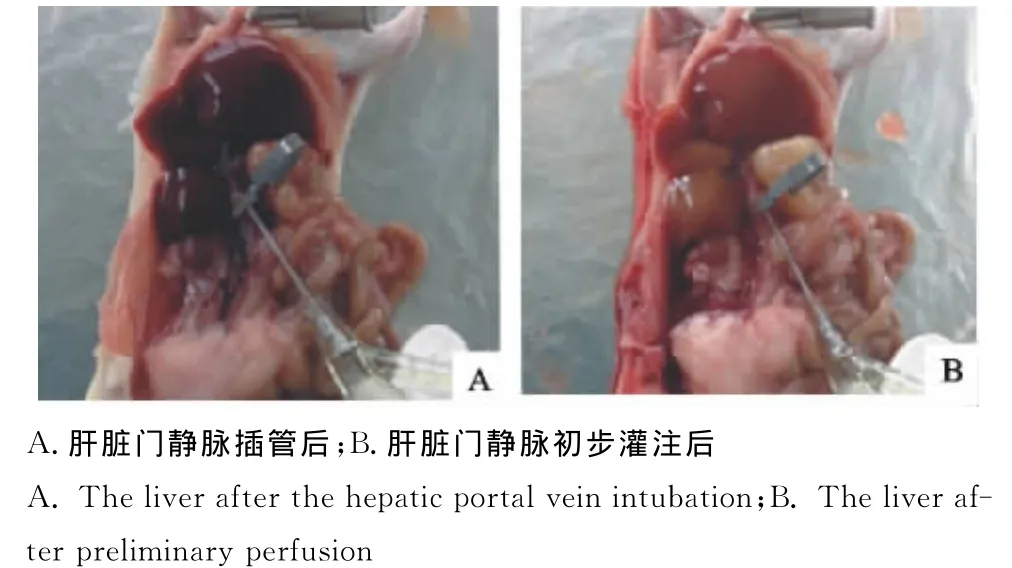
图1 肝脏门静脉插管Fig.1 The hepatic portal vein intubation
1.2.1.2迅速取下连接针头的肝脏,置于5g/L胶原酶中,循环灌注,约7min(图2)。
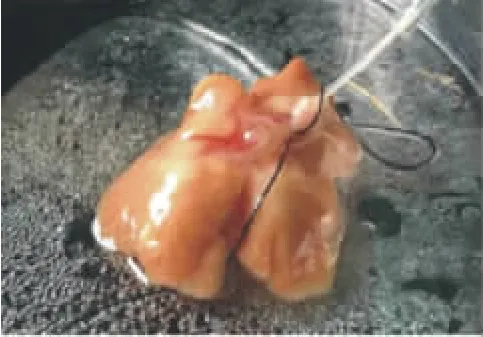
图2 肝脏循环灌注后Fig.2 The liver after circulation perfusion
1.2.1.3去掉肝脏表面包膜,初步去除肝细胞。
1.2.1.4震荡去除大部分肝脏细胞,用弯头镊从胆囊处向下夹住大部分大胆管成分,去除杂质,再次震荡后得到完整的肝内胆管树(图3)。

图3 胆管树Fig.3 Biliary tree
1.2.1.5用两把弯镊将胆管树细小分支磨碎,20U/mL DNaseⅠ、1g/L pronase E和0.5g/L的Ⅳ型胶原酶37℃振荡消化50min;再将剩余的大胆管剪碎成约1mm3,20U/mL DNaseⅠ、1g/L pronase E和0.5g/L的Ⅳ型胶原酶37℃振荡消化1h。
1.2.1.6200目不锈钢筛网过滤细胞悬液,用含100 mL/L FBS的DMEM培养基洗涤2次后,800r/min离心5min,弃上清,将收集的细胞铺到一个100mL玻璃培养瓶中,置于37℃、体积分数为5% CO2培养箱中培养2h。收集培养基,800r/min离心5 min,弃上清,将沉淀重悬于含100 mL/L FBS和10ng/mL EGF和HGF的DMEM/F12培养基中[6]。
1.2.1.7用台盼蓝染色排除法检测MIBECs活细胞数,活细胞为无色透明,死细胞为蓝色[7]。
1.2.1.8调整细胞浓度至1×105个/mL,接种于已用I型鼠尾胶原包被好的50mL塑料培养瓶中,置于37℃、体积分数为5% CO2培养箱中培养。24h后换液,以后每2d换液1次。每天用倒置显微镜观察其形态和生长的基本情况。
1.2.2生长曲线的测定 将细胞以每孔5×104个/mL细胞接种于Ⅰ型鼠尾胶原包被的96孔细胞培养板中,每孔体积200μL,置于培养箱内培养。分别于第2、3、5、7、9、11、13d[6,8]时各组每个观测孔中分别加入CCK8试剂20μL,反复吹打均匀。把培养板放在培养箱内培养4h后,用酶标仪在450nm波长处测定OD值[8]。
1.2.3MIBECs的鉴定及纯度鉴定
1.2.3.1免疫荧光细胞化学法鉴定 48孔培养板中包被I型鼠尾胶原,MIBECs就会贴附在板上生长。培养6d后,在-20℃甲醇固定20min。PBS 洗2次,2min/次共3次,3g/L Tritonx-100通透5min,PBS洗涤3次。50mL/L FBS阻断20℃,30min,PBS洗涤后加一抗兔抗小鼠CK19 (5μg/mL),4℃过夜。第2天PBS洗涤3次,12min/次,加Alexa Fluor○R594驴抗兔IgG荧光二抗(1∶1 000),37℃孵育30min,PBS冲洗3次,滴加DAPI染料(1μg/mL),室温静置15min,PBS洗涤后每孔加100μL PBS放到荧光显微镜下拍照。
1.2.3.2采用荧光显微技术鉴定细胞纯度[9],DAPI染料可将所有细胞核都显示,而CK19能将MIBECs的细胞质显示出来,将两种染色叠加在一起,即可判断双重染色的细胞是MIBECs,而只有单重染色的细胞不是MIBECs。计算每个视野下双重染色的细胞数量和细胞核染色数量,随机抽取10个视野计算细胞纯度。
2 结果
2.1细胞形态
通过台盼蓝拒染法检测观察到,分离的MIBECs存活率约90%。细胞接种24h~48h见细胞贴壁,呈立方形单层生长,聚团,形成大小不等的“细胞岛”(图4)。
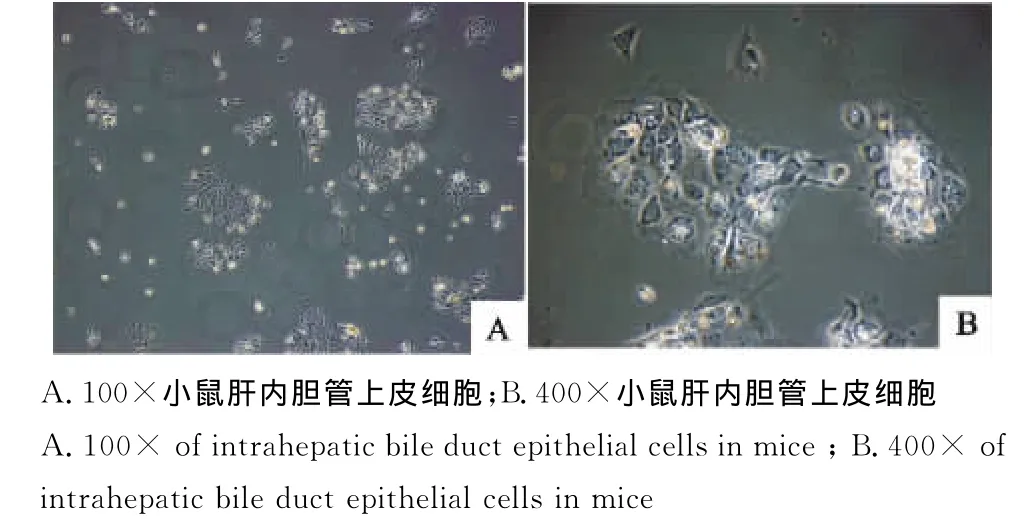
图4 鼠肝内胆管上皮细胞形态观察Fig.4 Morphological observation of intrahepatic bile duct epithelial cells in mice
2.2MIBECs鉴定及纯化结果
免疫荧光化学法检测细胞中CK19的表达,检测后荧光显微镜观察显示,胆管上皮细胞单层立方形(200×),呈团聚状分布。MIBECs细胞质CK19呈红色荧光的阳性表达,细胞纯度达到了95%(图5)。
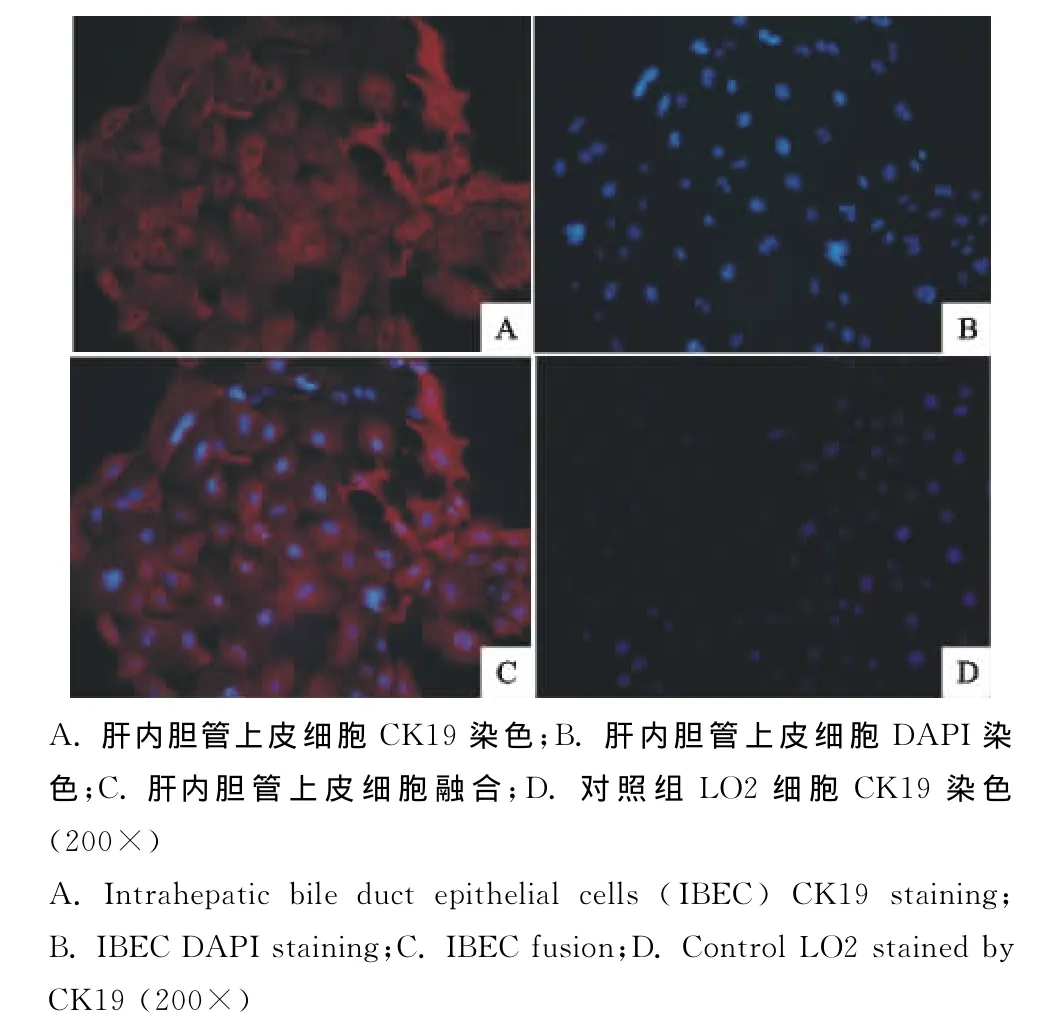
图5 肝内胆管上皮细胞染色的显微镜观察Fig.5 Microscopic examination of intrahepatic bile duct epithelial cells(IBEC)staining
2.3细胞的生长变化
2.3.1细胞形态的变化 MIBECs 24h~48h贴壁,在培养的第3天至第7天细胞聚团生长、增殖迅速,以后逐渐进入平台期;在培养第9天,细胞无明显增生,杂质细胞有增生,在培养第11天,有细胞出现空泡、拉丝、拉网及变形等现象,杂质细胞生长旺盛。
2.3.2CCK8法测细胞生长曲线 MIBECs 24h~48h贴壁生长,在培养的第3天至第7天增殖快,呈对数增长状态;在培养的7d~9d增殖慢,9d~13d进入平台期,无明显增殖现象。MIBECs的生长曲线见图6。
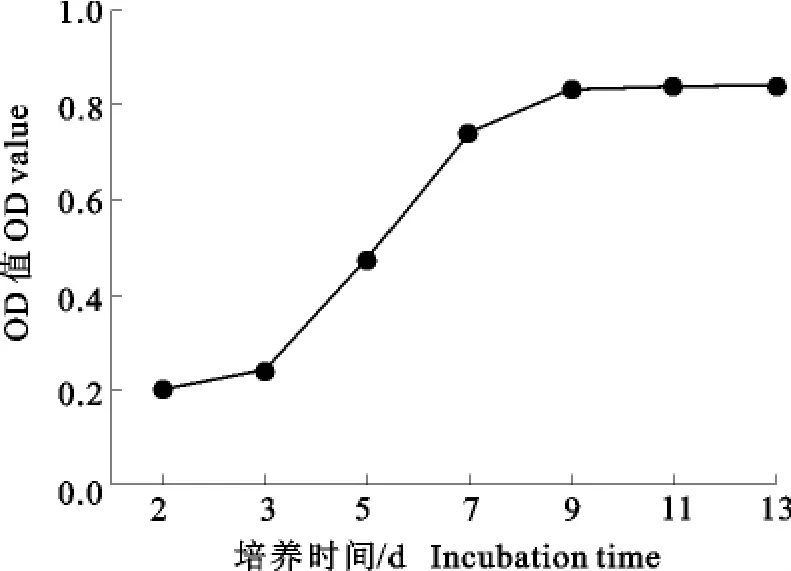
图6 MIBECs生长曲线Fig.6 The growth curve of MIBECs
3 讨论
IBECs仅占肝脏细胞总数的5%,其在肝内构成一个末端封闭的三维网状导管系统。由于其数量少,无法灌流而且与其他非实质细胞如肝星状细、肝窦内皮细胞密度相近,是较难分离和培养的细胞[10]。小鼠是最常用的实验动物,且因其个体小、门脉系统的血管和胆管均很细小,因此较大鼠或兔子而言,MIBECs更难分离。然而其在胆管免疫防御中发挥了重要作用,因此其分离培养具有重要的意义。
根据文献报道,IBECs的体外分离多通过门静脉插管,以胶原酶进行全肝灌流,解离肝细胞,然后进行再次消化获得肝内胆管,酶消化后利用Percoll非连续密度梯度离心法[8]或免疫分离法[4]进行纯化。然而,单用密度梯度离心法提纯的胆管上皮细胞仅达10%,尚需进一步纯化。另外,免疫分离法价格昂贵且获得的IBECs数量较少,且并不适宜在无免疫分离条件的实验室推广。
本研究进行了小鼠胆管上皮细胞分离条件的优化,即先采用门静脉胶原酶灌注肝脏先行消化之后成功分离出肝内胆管树,之后根据胆管的大小分类再次消化得到MIBECs。然而,小鼠的胆管树体积较小,反复振荡清洗易损失末端小胆管组织。这就要求我们采取适当的振荡力度和时间,以求最大限度保护细胞不被振荡丢弃。之后要去除肝外胆管组织并取下相应的肝内胆管进行消化。因为细胞消化时会产生大量的DNA使其粘连在一起,使得消化下来的细胞难以通过不锈钢筛网,所以加入适量的DNaseⅠ可使粘连的细胞分散。而pronase E能水解纤维蛋白和黏蛋白,有助于死亡的细胞降解而有助于MIBECs的分离。在上述操作基础上利用反复贴壁法来纯化MIBECs,这是基于MIBECs在玻璃瓶中不易贴壁,而成纤维细胞和神经胶质细胞等杂质细胞相对容易贴壁的特性[11]。本研究将胶原酶消化后的细胞悬液置于玻璃培养瓶中培养2h,经过贴壁选择后将细胞置于鼠尾胶包被好的塑料培养瓶中培养。
有文献报道,体外原代培养的MIBECs会失去分化和增殖的能力,所以需要适当使用细胞外基质以促进其体外增殖和分化。Ⅰ型鼠尾胶原的胶状物具有多孔的结构,已有很多实验人员将其用于IBECs的体外培养,其有利于营养物质和氧气的交换,为体外细胞提供了良好的贴壁生长环境[12]。因此,我们选择鼠尾胶包被好的塑料培养瓶中培养原代培养MIBECs。另外也有文献称,原代培养IBECs最好分离后1d~14d的细胞,这是出于对胆管上皮细胞形态、功能及生长调控等角度的考虑[13]。所以我们也观察了原代MIBECs培养后形态的变化,结果发现,MIBECs 24h~48h贴壁,在培养的第3天至第7天细胞聚团生长、增殖迅速,以后逐渐进入平台期;在培养第9天,细胞无明显增生,杂质细胞增生较多,在培养第11天,有细胞出现空泡、拉丝、拉网及变形等现象,杂质细胞生长旺盛。CCK8法测细胞生长曲线也证实了MIBECs在培养的第3天至第7天增殖快,呈对数增长状态;在培养的第7天至第9天增殖慢,第9天至第13天进入平台期,无明显增殖现象。
在培养IBECs的研究中,国内外研究者大多使用霍乱毒素、胰岛素、三碘甲状腺原氨酸、转铁蛋白、亚硒酸钠、地塞米松、EGF和肝细胞生长因子等成分促进细胞体外生长[14],其成分复杂,并且价格昂贵。本研究去繁就简,反复摸索后选用了EGF、HGF和ITS加入培养基,便即可以使细胞生长旺盛并能用于进一步试验。本研究通过更简单有效实用的方法得到纯度较高、活性较好的MIBECs,可在绝大多数实验室推广。这为体外研究MIBECs的生理及病变机制提供了良好的试验平台。然而,细胞生长10d后杂质细胞的增生和无法传代生长仍然是困扰我们的一个问题。因此,如何优化细胞并提高细胞的增殖能力,以达到我们的试验目的将是我们以后的一个研究方向。
参考文献:
[1] 李郑红,陆伦根.胆管细胞免疫生物学研究进展[J].肝脏,2014:(4):291-294.
[2] Griffiths L,Jones D E.Pathogenesis of primary biliary cirrhosis and its fatigue[J].Dig Dis,2014,32(5):615-625.
[3] Maroni L,Pierantonelli I,Banales J M,et al.The significance of genetics for cholangiocarcinoma development[J].Ann Transl Med20131328.
[4] Tabibian J H,Trussoni C E,O'Hara S P,et al.Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis[J].Lab Invest,2014,94 (10):1126-1133.
[5] Katayanagi K,Kono N,Nakanuma Y.Isolation,culture and characterization of biliary epithelial cells from different anatomical levels of the intrahepatic and extrahepatic biliary tree from a mouse[J].Liver,1998,18(2):90-98.
[6] Chai Chengwei,Zheng Shuaiyu,Feng Jiexiong,et al.A novel method for establishment and characterization of extrahepatic bile duct epithelial cells from mice[J].In Vitro Cell Dev Biol Animal,2010,46:820-823.
[7] 张柳平,邵根宝,潘耀谦,等.成年小鼠睾丸间质细胞的分离、鉴定及功能检测[J].动物医学进展,2013,34(9):40-43.
[8] 高建军,马利林,朱建伟,等.壳聚糖-胶原复合载体对肝内胆管上皮细胞生长的影响[J].肝胆胰外科杂志,2006,18(3):150-153.
[9] 杨 航,易 琼,李圆方,等.两种不同消化法对小鼠乳腺上皮细胞培养的影响[J].动物医学进展,2014,35(3):59-64.
[10] 张 煊,李崇辉,叶 晟,等.人增生肝外胆管上皮细胞的原代培养及组织学特点[J].中华实验外科杂志,2010,27(7):886-888.
[11] Shibeshi W,Abraham G,Kneuer C,et al.Isolation and culture of primary equine tracheal epithelial cells[J].In Vitro Cell Dev Biol Anim,2008,44(7):179-184.
[12] Hashimoto W,Sudo R,Fukasawa K,et al.Duetular network fornmtion by rat biliary epithelial cells in the dynamical culture with collagen gel and dimethylsulfoxide stimulation[J]. Am J Pathol,2008,173(2):494-506.
[13] Clare Wise.Epithelial Cell Culture Protocols[M].Humana Press,2002:37-52.
[14] Nagaya M,Katsuta H,Kaneto H,et al.Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells[J].J Endocrinol,2009,201(1):37-47.
Isolation,Identification and Cultivation of Intrahepatic Bile Duct Epithelial Cells from Mouse
WANG Yan-hong,ZHANG Bo,LI Bo,ZHANG Bei-bei,YU Qian,YAN Chao,HUA Hui,TANG Ren-xian,ZHENG Kui-yang
(Laboratory of Infection and Immunity,Department of Pathogenic Biology and Immunology,Xuzhou Medical College,Xuzhou,Jiangsu,221004,China)
Abstract:To establish a simple and reliable method for isolation and cultivation of intrahepatic bile duct epithelial cells(MIBECs)from mouse,the portal vein was perfused with typeⅣcollagenase,subsequently intrahepatic bile duct was taken out and then digested with DNaseⅠ,pronase E andⅣtype collagenase into small and uniform cells which were culured in DMEM/F12medium containing 100mL/L FBS and l0ng/ mL EGF,HGF and ITS.After cells attached to the sidewall,cells were identified by immunofluorescence assay of cytokeratin 19.During cell growth process,cell growth curve was determined by CCK8.The results showed that we have successfully isolated MIBECs by this method,and cell purity is about 95%. And CCK8tests showed MIBECs were in logarithmic growth state within cultured 3d-7d.These results suggest that this method is simple and reliable for isolation and purification and culture assay of MIBECs.
Key words:mouse;intrahepatic biliary epithelial cell;isolation;identification;culture
作者简介:王艳红(1987-),女,江苏淮安人,硕士研究生,主要从事寄生虫感染与免疫学研究。*通讯作者
基金项目:国家自然科学基金项目(81171590,31302077);家畜疫病病原生物学国家重点实验室开放课题(SKLVEB2013KFKT005);江苏高校优势学科建设工程资助项目(2014年)
收稿日期:2015-01-14
中图分类号:R33
文献标识码:A
文章编号:1007-5038(2015)07-0043-04