2009年-2014年云南边境禽流感病毒H5N1亚型神经氨酸酶基因进化分析
2015-02-27刘庆亮张文东胡媛媛胡挺松赵焕云段博芳范泉水张应国宋建领张富强云南农业大学云南昆明60云南省动物疫病预防控制中心云南昆明6001成都军区疾病预防控制中心四川成都61001云南省热带亚热带动物病毒病重点实验室云南昆明60云南省农业职业技术学院云南昆明6001
曾 伟,刘庆亮,孔 强,张文东,胡媛媛,胡挺松,赵焕云,段博芳,邱 薇,范泉水,张应国,宋建领,张富强*(1.云南农业大学,云南昆明60;.云南省动物疫病预防控制中心,云南昆明6001;.成都军区疾病预防控制中心,四川成都61001;.云南省热带亚热带动物病毒病重点实验室,云南昆明60;.云南省农业职业技术学院,云南昆明6001)
2009年-2014年云南边境禽流感病毒H5N1亚型神经氨酸酶基因进化分析
曾伟1,2,3,刘庆亮1,2,3,孔强1,2,3,张文东2,胡媛媛5,胡挺松3,赵焕云2,
段博芳2,邱薇3,范泉水3,张应国2,宋建领4,张富强3*
(1.云南农业大学,云南昆明650223;2.云南省动物疫病预防控制中心,云南昆明650051;3.成都军区疾病预防控制中心,四川成都610041;4.云南省热带亚热带动物病毒病重点实验室,云南昆明650224;5.云南省农业职业技术学院,云南昆明650031)
摘 要:为了解云南边境禽流感病毒H5N1亚型神经氨酸酶(NA)基因变异及进化特征,2009年-2014年期间在云南边境采集境外家禽和野生鸟类棉拭子样品1 500份,经禽流感H5/N1亚型病毒特异性多重RT-PCR检测,对阳性样品进行病毒NA基因扩增、纯化、克隆和测序,并与已知毒株和参考毒株进行序列比对及系统进化分析。结果从1 500份样品中检出禽流感病毒H5N1亚型阳性样品60份;60阳性样品病毒HA基因测序获得21种NA序列,可划分为4个不同进化分支。NA基因与HA基因呈现不同进化关系;云南边境毒株NA aa275位点未发生变异,因此变异毒株对神经氨酸酶抑制剂Oseltamivir(达菲)类抗病毒药物可能无抗性或耐药性;2009年-2014年期间云南边境H5N1亚型病毒NA间具有遗传差异,NA基因进化分支4已成为当地流行的优势毒株。
关键词:禽流感病毒;H5N1亚型;神经氨酸酶;基因
禽流感(Avian influenza,AI)是由A型流感病毒(Influenza virus)引起的一种禽类的感染疾病综合征。禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科(Orthomyxoviridae)A型流感病毒属(Influenza viruse)成员[1]。神经氨酸酶(Neuraminidase,NA)由基因组节段6所编码,是一种唾液酸酶,可以在流感病毒感染靶细胞时,识别细胞表面病毒受体末端的唾液酸残基,促进病毒能够进入细胞[2]。NA的另一个功能是为将出芽的病毒粒子清理通道,有利于病毒粒子的成熟和释放[3]。
1996年在广东自鹅体内分离获得高致病性禽流感病毒H5N1亚型(AGSGD196);1997年从中国香港因流感发病死亡的3岁儿童病例标本中分离获得H5N1亚型病毒(A/Hong Kong/156/97),首次确诊人感染高致病性禽流感病例,其后在香港共发现18人感染,其中6人死亡,引起了国内外的广泛关注[4]。之后,我国科学家从猪和家禽的体内分离得到H5N1亚型病毒,再次证实病毒已经具备跨越种间屏障感染哺乳动物的能力[5]。Keawcharoen J等[6]报道了2003年12月在泰国动物园的虎和豹中检出了高致病性禽流感病毒H5N1亚型;在随后的2004年10月,在泰国另一个动物园中的笼养虎也暴发了高致病性禽流感病毒H5N1亚型疫情,感染虎分离毒株与泰国家禽流行毒株一致,造成147头虎死亡,并证明存在虎与虎之间的传播[7]。禽流感病毒自然感染宿主谱广,水禽及野生鸟类是其储存宿主,可作为家禽及哺乳动物禽流感发生、发展、分布和流行的主要传染源[8]。2003年以来,包括我国在内的65个国家或地区家禽/野生鸟类暴发高致病性禽流感H5N1亚型疫情,仅东南亚超过2亿只家禽被扑杀,并在10个国家存在人感染病例649例,其中死亡385例,病死率超过59%(http://www. who.int)。
虽然近年来全球H5N1亚型疫情报道呈逐年递减趋势,但与云南省接壤或相邻的东南亚及南亚国家,高致病性禽流感疫情及人感染病例绵延不断,每年均有发生,逐渐显现地方流行态势,成为全球高致病性禽流感分布流行的主要区域,难以根除[9-10]。开展云南境外高致病性禽流感H5N1亚型病原监测及病毒NA基因测序分析,掌握我国周边禽流感病原分布、变异和进化特点,对禽流感研究及防控,防范境外流感病毒新基因型入侵有重要意义。
1 材料与方法
1.1材料
1.1.1毒株、样品采集与菌株 灭活的禽流感H5N1、H9N2亚型病毒毒株为哈尔滨维科生物技术开发公司产品,作为检测的阳性对照和阴性对照;采集的样品为2009年-2014年期间云南边境家禽和野生鸟类咽喉或泄殖腔拭子样品1 500份(样品采自邻近云南边境的5个境外集市,其中中越边境鸡、鸭咽喉或泄殖腔拭子各370份,鹅样品30份,麻雀45份;中缅边境鸡、鸭咽喉或泄殖腔拭子各300份,孔雀60份,鹧鸪25份)。置总RNA裂解液中灭活后,低温运送至实验室;大肠埃希菌DH5α感受态细胞,由云南省动物疫病预防控制中心实验室制备、保存。
1.1.2主要试剂 总RNA提取液(TaKaRa RNAiso Reagent)、病毒RNA/DNA提取试剂盒(TaKaRa MiniBEST Viral DNA/RNA Extraction Kit Ver.3.0)、TaKaRa One Step RNA PCR Kit (AMV)、Premix Taq酶、DNA Marker DL 2 000、pMD18-T Vector、感受态细胞制备试剂为宝生物工程(大连)有限公司产品;DNA凝胶回收试剂盒、小量柱式质粒纯化试剂盒为爱思进生物技术(杭州)有限公司及宝生物工程(大连)有限公司产品;氯仿、异丙醇采用分析纯试剂。
1.2方法
1.2.1总RNA提取、H5/N1亚型RT-PCR及多重RT-PCR 按照试剂盒提供的操作手册,自咽喉及泄殖腔拭子样品病毒裂解液和灭活的禽流感H5N1、H9N2亚型病毒样品(阳性对照和阴性对照)中提取总RNA,采用课题组已建立的H5/N1亚型特异性RT-PCR及多重RT-PCR进行检测[11]。
1.2.2NA基因的扩增、纯化 采用课题组已建立的方法[12],自多重RT-PCR阳性核酸样品中扩增病毒NA基因。NA引物序列如下:上游引物:5′-CACCATGAATCCAAATAAGAAGA-3′;下游引物:5′-CTACTTGTCAATGGTGAATGG-3′。反应条件:50℃30min,94℃2min;95℃15s,42℃30s,68℃2min,35个循环;68℃10min;产物于4℃或-20℃保存。对RT-PCR产物进行凝胶切割纯化,电泳分析定量后稀释至50ng/μL。
1.2.3重组质粒构建和鉴定 取1μL纯化产物与1μL pMD18-T载体(50ng/μL)进行连接反应,连接产物10μL加入到100μL DH5α感受态细胞中,涂布于0.1mg/mL Ampcilin抗性平板,37℃过夜培养,经PCR对单个菌落进行鉴定。阳性菌落增殖培养后提取质粒,送深圳华大基因科技有限公司测序。
1.2.4序列比对、同源性及系统进化分析 采用DNA Man、MEGA6分子生物学软件进行序列比对、同源性及系统进化分析。
2 结果
2.1H5/N1亚型RT-PCR及多重RT-PCR检测
从1 500份家禽和野禽咽喉及泄殖腔拭子样品中检出禽流感H5N1亚型禽流感病毒阳性样品60份,均为家禽样品,其中中越边境检出阳性39份(鸡23份、鸭16份,阳性率分别为6.22%、4.32%),中缅边境检出阳性21份(鸡15份、鸭6份,阳性率分别为5.00%、2.00%)。在130份野生鸟类样品中未检出阳性。
2.2NA基因系统进化分析
对60份禽流感H5N1亚型阳性样品病毒NA基因进行测序,经序列比对,确认获得21个不同序列(其中2009年1份、2010年6份、2011年4份、2012年3份、2013年5份、2014年2份)。将所获得的NA序列数据与国内外已知代表毒株序列构建系统进化树,进行NA基因进化分析。所引用的代表毒株序列来自文献和GenBank,毒株信息见表1。2009年-2014年云南边境H5N1亚型病毒可划分为4个不同的进化分支,见表2。
2009年-2014年云南境外禽流感病毒H5N1亚型具有遗传差异,云南境外毒株可能是多进化(亚)分支毒株经基因重排(重配)变异产生,进化分支2.3.4毒株ACKBS11150110和ACKWS56600111与中国安徽(2005)分离毒株遗传关系密切;划分为进化分支1;进化分支2.3.4毒株ADKLC91950409、ADKWS21250110、ADKLC34400710、ADKDL56600411、ADKDH21250411、ACKNJ31350112及进化分支2.3.2毒株ADKDL7175101、ACKDQ41450411与中国贵州(2009)、中国湖南(2009)分离毒株遗传关系密切,划分为进化分支2;进化分支2.3.2毒株ADKLC76800112与中国湖南(2008)、中国香港(2010)、韩国(2008)分离毒株遗传关系密切,划分为进化分支3;进化分支2.3.2毒株ADKWS76801010、ACKZT1620160411、ACKBN431112、ACKKX010513、ACKKJ140513、ACKYX590113、ACKYX250113、ACKBS150513及进化分支2.3.4毒株ACKLC800114、ACKZT270114与中国广西(2009)、中国河北(2010)分离毒株遗传关系密切,可划分为进化分支4(图1)。
表1 序列比对及系统发育分析中引用的H5N1亚型参考毒株Table 1 Reference strains of H5N1subtype viruses used in sequence alignment and phylogenetic analysis
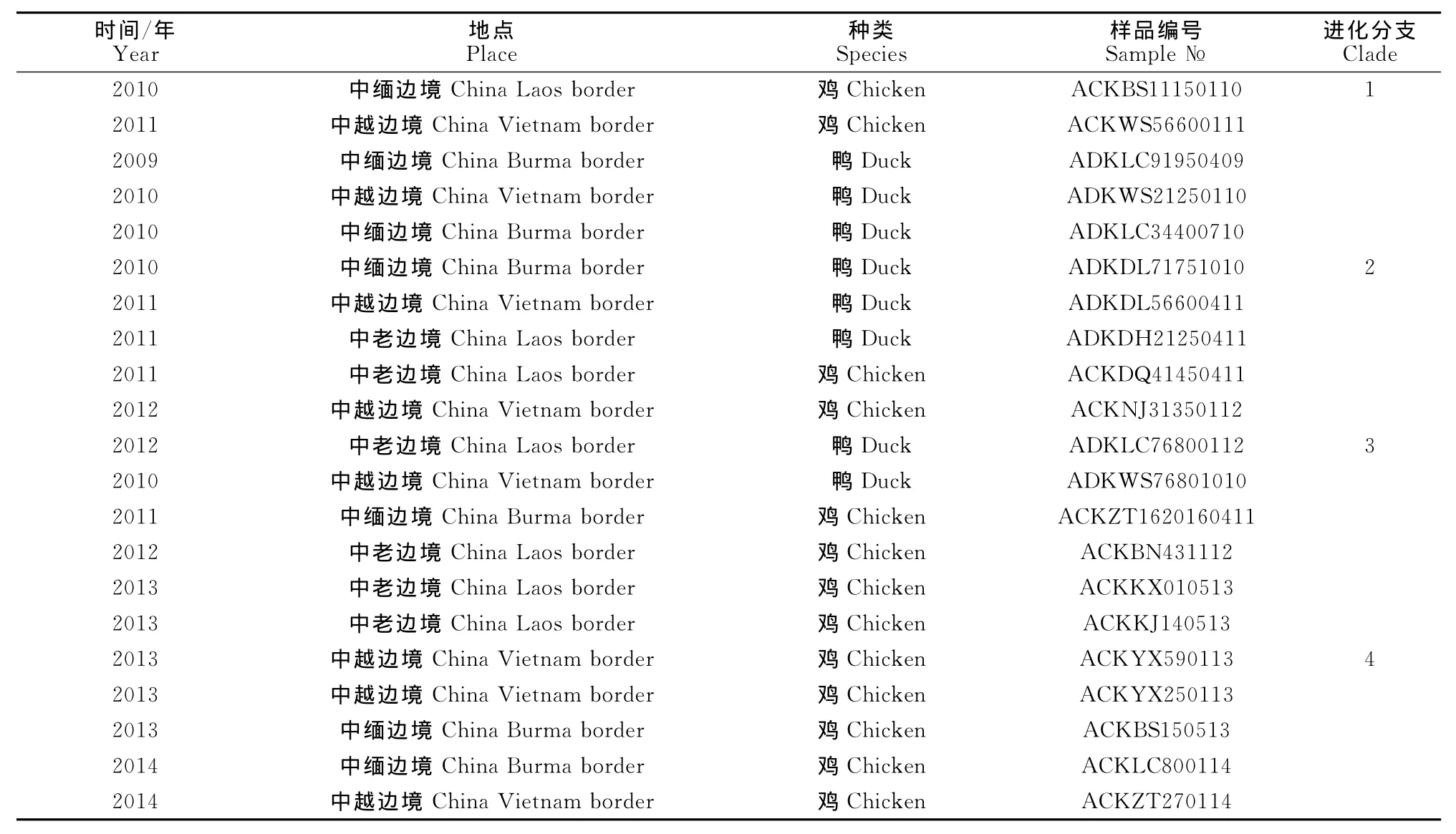
表2 2009年-2014年云南边境H5N1亚型病毒NA基因进化分支表Table 2 Analysis of NA genes of avian influenza H5N1subtype viruses in the border of Yunnan province during 2009to 2014
2.3NA基因氨基酸序列比对分析
所测的21份云南边境禽流感病毒H5N1阳性样品病毒NA基因推导其编码的氨基酸序列,并与代表毒株进行序列比对分析,结果显示,所有毒株NA蛋白在5、95、386aa位点存在氨基酸替代,分别由Q→K、S→R/K、S→EN;另外,进化分支1阳性样品病毒NA基因在396aa(I→T)位存在氨基酸替代,;进化分支2阳性样品病毒NA基因8(I→M)、38(I→F)、42(N→V)、259(E→K)、346(V→I)、364 (S→G)、389(V→M)、396aa(I→T)位存在氨基酸替代,;进化分支3阳性样品病毒NA基因163(V→M)、258(M→I)、346aa(V→I)位存在氨基酸替代;进化分支4阳性样品病毒NA基因8(I→V)、42(N →T)、163(V→I)、192(T→I)、240(T→A)、258(M →IV)、304(V→I)、389aa(V→M)位存在氨基酸替代(表3)。
图1 云南边境禽流感病毒H5N1亚型NA基因系统发育分析Fig.1 Phylogenetic analysis based on NA genes of H5N1 viruses from boundary of Yunnan province
2.4NA潜在糖基化位点比对分析
H5N1亚型禽流感原型毒株(AGSGD196,Clade 0)NA蛋白存在7个潜在的糖基化位点,分别位于50-52、58-60、63-65、68-71、88-90、146-148、235-237 aa。云南省禽流感H5N1亚型毒株NA基因测序结果表明包含1个完整的ORF,编码449个氨基酸。与原型毒株(AGSGD196,Clade 0)相比,在51-70aa位置缺失,因而均少了4个潜在糖基化位点,部分肽链上有2个~3个潜在的糖基化位点,分别位于88-90、146-148、235-237aa位点。NA为糖蛋白,其糖基化位点的数量和分布区域的改变可引起病毒抗原性、致病性等生物学特性的改变。本文所测阳性样品ACKWS56600111在386-388aa出现一个新的糖基化位点(NFS),ACKBS46501010、ADKLC36400710、ACKNJ31350112分别在88-90(NSS →NSA)、146-148(NGT→NGI)、235-237aa(NGS→NGP)潜在糖基化位点消失,ACKYX250113由于89位S→P导致88-90aa(NSS→NPS)潜在糖基化位点消失。云南边境阳性样品病毒NA蛋白糖基化位点存在特有变异,此变异是否引起NA基因生物学功能及病毒致病性的改变有待进一步立项研究。
表3 H5N1病毒NA基因氨基酸替代位点比对分析Table 3 Alignment of amino acid substitution sites on NA genes of H5N1viruses
3 讨论
2009年-2014年云南边境禽流感病毒H5N1亚型NA基因根据遗传关系可划分为4个不同的进化分支(1~4),与HA基因系统发育分析结果相比较,HA基因和NA基因进化不同步,HA基因同一进化分支(如2.3.2分支)毒株其NA基因可能来源于不同进化分支(进化分支2-4),而NA基因同一进化分支毒株(如进化分支4)其HA基因也可能来源不同(2.3.2分支和2.3.4分支),表明2009年-2014年云南边境禽流感病毒H5N1亚型不同毒株间HA、NA基因存在基因重排或基因重配,呈现病原生物多样性。
NA基因不同进化分支毒株某些位点存在特有氨基酸替代或变异,进而可能引起病毒NA基因抗原性或生物学功能的改变,如进化分支2阳性样品病毒NA基因在364位点由S→G、396位点由I→T,该变异为HA进化分支2.3.4特有的变异;进化分支4阳性样品病毒NA基因42位点由N→T、aa240位点由T→A,改变异为HA进化分支2.3.2特有的变异;5、95、346、386aa位点变异为进化分支2特有的变异,8、163、192aa位点变异为进化分支4特有的变异,可作为NA进化分支分子序列鉴定的依据。有研究表明,NA蛋白275aa位氨基酸由组氨酸(H)→酪氨酸(Y)后,变异毒株对NA抑制剂Oseltamivir(达菲)类抗病毒药物有抗性或耐药性[13],云南边境毒株NA aa275位点未发生变异,说明云南边境禽流感病毒H5N1亚型对Oseltamivir(达菲)类抗病毒药物可能无耐药性,Oseltamivir(达菲)暂且可作为治疗药物。
NA茎部缺失增强了禽流感病毒的细胞适应性,降低了使子代病毒释放的解凝能力,可能与现阶段禽流感病毒H5N1亚型宿主范围进一步扩大有关[14-16],Matrosovich M等[17]发现,NA茎部氨基酸的缺失,可减弱禽流感病毒从细胞释放的能力,也是禽流感病毒从野生宿主到家养宿主的适应。本文获得的21株NA基因出现了茎部基因的缺失,从而导致NA颈部氨基酸的缺失,该缺失是否会真正影响禽流感病毒感染宿主的能力及其释放,还有待进一步研究。
参考文献:
[1] Beato M S,Mancin M,Yang J L,et al.Antigenic characterization of recent H5N1highly pathogenic avian influenza viruses circulating in Egyptian poultry[J].Virology,2013,435:350-356.
[2] Taisuke H,Yoshihiro K P.Pandemic threat posed by avian influenza A viruses[J].Clini Microbiol Rev,2001,14(1):129-149.
[3] 王全英,乔传玲,申之义,等.禽流感病毒神经氨酸酶的结构及其生物学功能[J].动物医学进展,2005,26(12):40-43.
[4] Claas E C J,Osterhaus A D M E,Beek R V,et al.Human influenza A H5N1virus related to a highly pathogenic avian influenza virus[J].Lancet,1998,351:472-477.
[5] Kuiken T,Rimmelzwaan G,Van Riel D,et al.Avian H5N1 influenza in cats[J].Science,2004,306(5694):241-245.
[6] Keawcharoen J,Oraveerakul K,Kuiken T,et al.Avian influenza H5N1in tigers and leopards[J].Emerg Infect Dis,2004,10 (12):2189-2191.
[7] Thanawongnuwech R,Amonsin A,Tantilertcharoen R,et al. Probable tiger-to-tiger transmission of avian influenza H5N1 [J].Emerg infect Dis,2005,11(5),699-701.
[8] 成 进,汪 萍,夏 俊,等.新疆主要野生鸟类的生态环境、迁徙路线及其对禽流感发生与流行的影响[J].动物医学进展,34 (2):108-113.
[9] Nguyen T,Rivailler P,Davis C T,et al.Evolution of highly pathogenic avian influenza(H5N1)virus populations in Vietnam between 2007and 2010[J].Virology,2012,432:405-416.
[10] Tung D H,Quyen D V,Nguyen T,et al.Molecular characterization of a H5N1highly pathogenic avian influenza virus clade 2.3.2.1bcirculating in Vietnam in 2011[J].Vet Microbiol,2013,165:341-348.
[11] 张应国,宋建领,胡媛媛,等.禽流感病毒RT-PCR及多重RTPCR检测技术的建立[J].中国兽医科技,2005,35(8):600-604.
[12] 张武林,张文东,赵焕云,等.云南边境禽流感H5N1亚型病毒遗传多样性分析[J].中华流行病学杂志,2012,33(3):323-327.
[13] Tumpey T M,Garcia-Sastre A,Taubenberger J K,et al. Pathogenicity of influenza viruses with genes from the 1918 pandemic virus:functional roles of alveolar macrophages and neutrophils inlimiting virus replication and mortality in mice [J].J Virol,2005,79(23):14933-14944.
[14] 陈化兰,于康震,田国斌,等.DNA免疫诱导鸡对禽流感病毒的免疫保护反应[J].中国农业科学,1998,31(5):63-681.
[15] 黄汉成,周荣琼.禽流感及其防制研究进展[J].四川畜牧兽医学院学报,2002,16(4):41-461.
[16] 郭胃峰,廖 明,辛朝安,等.禽流感病毒KM I/99(H9N2)HA和NA基因的序列分析[J].畜牧兽医学报,2002,33(5):486-4911.
[17] Matrosovich M,Zhou N,Kawaoka Y,et al.The surface glycoproteins of H5influenza viruses isolated from humans,chickens,and wild aquatic birds have distinguishable properties[J].J Virol,1999,73(2):1146-1155.
Evolution Analysis of Neuraminidase Genes of Avian Influenza H5N1 Subtype Viruses in the Outside Borders of Yunnan Province During 2009 to 2014
ZENG Wei1,2,3,LIU Qing-liang1,2,3,KONG Qiang1,2,3,ZHANG Wen-dong2,HU Yuan-yuan5,HU Ting-song3,ZHAO Huan-yun2,DUAN Bo-fang2,QIU Wei3,FAN Quan-shui3,ZHANG Ying-guo2,SONG Jian-ling4,ZHANG Fu-qiang3
(1.Yunnan Agriculture University,Kunming,Yunnan,650223,China;2.Centre for Animal Disease Control and Prevention,Kunming,
Y
unnan,650051,China;3.Centre for Disease Control and Prevention,Chengdu Military Region,Chengdu,Sichuan,610041,China;4.Yunnan Key Laboratory of Tropical and Subtropical Animal Virus Diseases,Kunming,Yunnan,650224,China;5.Yunnan Vocational and Technical College of Agriculture,Kunming,Yunnan,650031,China)
Abstract:To elucidate the molecular variation and evolution characteristics of neuraminidase(NA)genes of avian influenza H5N1subtype viruses in the outside borders of Yunnan province,swab samples were collected from foreign poultry and wild birds in the region and screened by H5/N1subtype-specific multiplex RT-PCR.The NA genes of H5N1viruse from the positive samples were amplified,purified,and cloned into pMD18-T vectors for sequencing.The alignment and phylogenetic analysis were performed with sequences of the known reference strains.60positive samples were found out form 1 500samples.21different of NA sequences were obtained from HA gene from the 60positive samples and can be divided into 4 distinct clades.The NA genes and Hemagglutinin(HA)genes of H5N1viruses from the outside borders of Yunnan province showed different relationship of genetic evolution.Yunnan border strain NA aa275loci did not change,so the mutant strains may have no resistance to neuraminidase inhibitors Oseltamivir(tamiflu)-antiviral drugs.NA subtype H5N1viruses from the outside borders of Yunnan province during 2009 to 2014had genetic divergence,and clade 4strains had becomed the dominant epidemic strains in the region.
Key words:Avian influenza virus;H5N1subtype;neuraminidase;gene
作者简介:曾 伟(1989-),男,四川内江人,硕士研究生,主要从事分子病毒学研究。*通讯作者
基金项目:云南省科技计划项目(2012CH002);国家公益性行业专项项目(201103008);军队科技计划项目(CWS12J075、13BJYZ37、A12005);云南省后备人才基金项目(2009CI061)
收稿日期:2014-12-08
中图分类号:S852.659.5
文献标识码:A
文章编号:1007-5038(2015)07-0013-06