鸭Toll样受体3基因克隆及序列分析
2015-02-27宋凯杰李传峰陈宗艳孟春春黄云秀李丹丹刘光清张淼涛西北农林科技大学动物医学院陕西杨凌71100中国农业科学院上海兽医研究所上海00413广西大学动物科技学院广西南宁530004
宋凯杰,李传峰,陈宗艳,孟春春,黄云秀,3,李丹丹,刘光清,张淼涛(1.西北农林科技大学动物医学院,陕西杨凌71100;.中国农业科学院上海兽医研究所,上海0041;3广西大学动物科技学院,广西南宁530004)
鸭Toll样受体3基因克隆及序列分析
宋凯杰1,2,李传峰2,陈宗艳2,孟春春2,黄云秀2,3,李丹丹1,2,刘光清2,张淼涛1*
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.中国农业科学院上海兽医研究所,上海200241;3广西大学动物科技学院,广西南宁530004)
摘 要:为研究鸭Toll样受体3(TLR3)的结构及功能,根据GenBank中已公布的番鸭TLR3 (JQ910167.1)基因设计引物,采用RT-PCR从北京鸭外周血单个核细胞中克隆出北京鸭TLR3,命名为duTLR3。利用生物信息学技术预测其结构及功能,研究表明,duTLR3基因开放阅读框为2 688bp,编码895个氨基酸,富含17.0%亮氨酸;该分子属于Ⅰ型跨膜受体,由胞外区(1-695aa)、跨膜区(696-718aa)和胞内区(719-895aa)3部分组成,N端含有一个信号肽序列,胞外富含18个亮氨酸重复序列(LRR),胞内含有Toll/IL-1R同源区结构域。核苷酸序列同源性分析显示,duTLR3与金定鸭TLR3亲缘关系最接近达到99.6%;与番鸭、鹅、原鸡、斑胸草雀的亲缘关系次之,并同属于禽类分支上;与番鸭、鹅、原鸡、斑胸草雀、人、猕猴、狒狒、小鼠、大鼠、猪、牛、羊、猫亲缘关系渐远;与草鱼和鲤鱼亲缘关系最远。北京鸭体内组织分布结果显示,duTLR3为组成性表达。本研究成功克隆了北京鸭TLR3基因,预测分析并证实了duTLR3具有典型的TLR家族结构特征,为后期探究TLR3如何识别病毒的RNA及引起下游信号级联反应奠定了基础。
关键词:北京鸭;TLR3;分子克隆;序列分析;结构预测
Toll样受体(Toll-like receptors,TLRs)是一类进化上保守的Ⅰ型跨膜受体,包括富含亮氨酸(leucine rich repeats,LRRs)的胞外区、跨膜区和胞内TIR区(Toll/interleukin-1receptor)[1]。作为先天性免疫在防御微生物感染的第一道防线,TLRs在检测病原相关分子模式(pathogen-associated molecular patterns,PAMPs)方面起重要作用,最终激活适应性免疫应答。目前,许多畜禽的TLRs基因已被克隆并研究,如牛、羊、鸡、鹅、草鱼等。番鸭TLR3表达于脾脏、法氏囊、肝、肾、脑、肌肉、心、肠和皮肤[2]。鸭Toll样受体3(Toll-like receptor 3,TLR3)主要识别病毒dsRNA和人工合成dsRNA类似物聚肌胞苷酸[Poly(I∶C)],通过结合TICAM-1(TIR-containing adapter molecule)分子,传导下游信号,从而激活NFκB和IFN-β启动子,促使细胞释放细胞因子如IFN-α、IFN-β和IL-6、IL-12等,激活机体的抗病毒应答。
近几年来,人、鼠Toll样受体研究取得了重大进展[3],相比哺乳动物,禽类Toll样受体研究较为缓慢,特别是鸭Toll样受体的相关研究甚少[4]。本研究首次从北京鸭外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)中克隆出TLR3,并命名为duTLR3,并运用生物信息学方法分析预测duTLR3的结构和功能,为深入研究TLR3与PAMPs作用机制奠定理论基础。
1 材料与方法
1.1材料
Trans5α感受态细胞、pEASY-Blunt5Zero载体为TransGen公司产品;北京鸭(樱桃谷肉鸭)购自江苏某鸭厂;Trizol试剂为Invitrogen公司产品;Ex Taq酶为TaKaRa公司产品;M-MLV反转录酶、T4连接酶为Promega公司产品;2×Pfu高保真酶为Tiangen公司产品;琼脂糖凝胶回收试剂盒为BioTake公司产品;鸭外周血淋巴细胞分离液为北京Solarbio Science﹠Technology公司产品。
1.2方法
1.2.1鸭PBMCs的分离 选取4周龄健康肉鸭,以食指和中指按住头的一侧,用酒精棉球消毒右侧颈静脉的部位,以拇指轻压颈根部以使静脉充血,右手持注射器刺入静脉取血3mL,加25g/L柠檬酸钠溶液0.3mL,小心加于3mL的细胞分离液之液面上,以2 000r/min离心(半径15cm水平转子)15min,此时离心管中由上至下细胞分为4层。第1层为血浆层,第2层为环状乳白色淋巴细胞,第3层为透明分离液层,第4层为红细胞层。收集第2层细胞于15mL离心管中,加入PBS溶液10mL,充分混匀后,2 000r/min室温离心20min。弃上清,沉淀再次重悬于10mL PBS溶液,2 000r/min室温离心20min,如此重复操作2次,弃上清,所得沉淀即为PBMCs。
1.2.2RNA提取及RT-PCR扩增 取分离的PBMCs,根据Promega公司Trizol试剂使用说明,提取细胞总RNA,值-20℃保存。根据GenBank中登录的TLR3序列(JQ910167.1),应用Primer 5.0进行引物设计,由上海生工生物工程技术服务有限公司合成引物(表1)。以Oligo dT和随机引物进行反转录,获得cDNA。以cDNA为模板进行PCR扩增,TLR3-P1F和TLR3-P1R为引物,反应条件为P1:94℃3min;94℃30s,50℃30s,72℃90s,35个循环;72℃10min。TLR3-P2F和TLR3-P2 R为引物,P2:94℃3min;94℃30s,55℃30s,72 ℃80s,35个循环;72℃10min。融合PCR以P1、P2的PCR产物为模板进行PCR扩增,反应条件为:94℃3min;94℃30s,52℃30s,72℃3min,35个循环;72℃10min。PCR反应结束后,10g/L琼脂糖凝胶电泳检测扩增产物。

表1 RT-PCR引物Table 1 Primers used in RT-PCR
1.2.3目的基因的克隆和测序 按照凝胶试剂回收试剂盒说明书回收目的片段,与pEASY-Blunt 5 Zero载体连接,转化至TransGen5α感受态细胞中,涂布平板,37℃过夜培养。挑取单个菌落,于含氨苄青霉素抗性的培养基(LB)中37℃过夜,提取质粒,经PCR初步鉴定出阳性克隆后,交由上海美吉生物公司测序。
1.2.4duTLR3序列的分析及结构预测 将基因测序结果与GenBank中登录的相关序列进行Blast,用DNA Star分析基因序列同源性后利用MEGA 6.0分析其遗传演化关系,同时应用SMART软件预测其结构域,采用TMHMM Server v 2.0分析其跨膜区,用SignalP 4.1Server软件分析其信号肽。
1.2.5duTLR3在北京鸭体内的组织表达谱 采集2周龄健康北京鸭的肝、心、脾、肺、肾、食道、气管、腺胃、肌胃、胰腺、十二指肠、空肠、盲肠、法氏囊、胸腺、哈氏腺、脑、皮肤、肌肉以及骨髓等组织及脏器,液氮条件下研磨后,Trizol法提取组织总RNA,反转录为cDNA,反转录体系为:RNA(1μg),反转录酶M-MLV 1μL,5×Reaction buffer 5μL,核酶抑制剂RRI 1μL,dNTP mix(10mmol/L)1μL,随机引物2μL,补足无核酶水至25μL体系。涡旋混合后37℃水浴条件下,反应1h,85℃、15min灭活反转录酶。以上述各组织的cDNA为模板,进行PCR反应,体系为:cDNA 2μL,TLR3保守区引物对idTLR3F/R(10μM)各1μL,2×Ex Taq Mix 10μL,ddH2O 6μL,共20μL,反应条件为:94℃3min;94℃30s,55℃30s,72℃30s,35个循环;72℃5min。同时设立内参对照,内参引物对β-actin F/R,反应条件和体系同上。PCR反应结束后,10g/L琼脂糖凝胶电泳检测扩增产物,并回收目的片段,送测序公司鉴定。
2 结果
2.1PBMCs总RNA提取结果
RNA电泳结果显示为3条带(图1),证明RNA提取较完整。
图1 外周血单个核细胞总RNA电泳Fig.1 Electrophoresis of total RNA in PBMC
2.2DuTLR3不同基因片段RT-PCR扩增结果
由于duTLR3基因较长,采用RT-PCR一次性扩增全长基因难度较大,所以分两段扩增。PCR产物电泳结果与预期大小相一致(图2)。

图2 duTLR3不同基因片段PCR扩增结果Fig.2 PCR amplification of different fragments of duTLR3
2.3duTLR3基因克隆初步鉴定结果
将OverLap PCR产物连接至pEASY-Blunt 5 Zero载体,菌液PCR鉴定。得到的外源片段大小与OverLap PCR扩增所得到的目的片段大小一致(图3),证明目的基因已经成功克隆至pEASYBlunt T5Zero载体中。
2.4duTLR3基因测序结果分析
得到的测序结果与GenBank中登录的TLR3相关序列进行Blast比较,与绿头鸭(KC292270.1)的TLR3同源性最高(99.6%),确定其为TLR3。其开放阅读框(ORF)为2688bp,编码895个氨基酸。
2.5duTLR3基本理化性质分析
扩增得到的duTLR3基因编码区全长为2 688bp(GenBank登录号:KM434239),并通过http://web.expasy.org/protparam在线软件对其进行基本理化性质分析。结果显示,duTLR3编码895个氨基酸,分子质量为102.28ku,理论等电点为8.2。氨基酸组成中,正电荷残基为85个,负电荷残基为80个,整个蛋白带正电荷。蛋白不稳定系数为42.42,提示该蛋白可能为不稳定蛋白。
图3 pEASY-T5-duTLR3重组质粒菌液PCR鉴定Fig.3 PCR identification of pEASY-T5-duTLR3recombinant plasmid
2.6duTLR3基因编码产物的亲水性、疏水性、柔韧性及抗原性预测
用DNA Star软件子程序Prostean对duTLR3基因编码产物的亲、疏水性,柔韧性及抗原性进行预测,由图4可知,duTLR3基因亲水性残基所占比例大于疏水性残基,因此推测其编码蛋白整体表现为亲水性,柔韧性区域分布相对均匀。抗原表位区域较大,两段相对较为密集,中间次之;与柔韧性区域出现较多重叠区,这些区域易于变性,便于抗原、抗体自由结合,可能是抗原位点的结合区。
2.7duTLR3蛋白二级结构、跨膜区、结构域及信号肽预测

图4 北京鸭TLR3基因亲水性、柔韧性及抗原性的预测结果Fig.4 Prediction of hydrophilicity,flexibility,surface probability and antigenicity of TLR3protein in Peking duck
用在线软件SSPro 4.0(http://download.igb. uci.edu/sspro4.html)预测蛋白的二级结构,发现无规则卷曲占62.5%,α螺旋占21.0%,β折叠占16.5%(图5);SMART软件(http://smart.emblheidelberg.de/)预测其结构域,发现含有18个LRR,1个LRRNT、1个LRRCT、1个TIR区,1个跨膜区,1个信号肽区(图6);应用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析其跨膜区,由胞外区(1-695aa)、跨膜区(696-718aa)和胞内区(719-896aa)3部分组成(图7)。用SignalP 4.1Server软件(http://www.cbs. dtu.dk/services/SignalP/)预测其信号肽,结果发现信号肽位于N端1-26氨基酸(图8)。因此,鸭的TLR3蛋白为跨膜蛋白,这与目前已知TLR家族的所共成员一致。
2.8duTLR3基因及其编码氨基酸同源性分析
运用DNA Star软件分别与人、猕猴、狒狒、小鼠、大鼠、猪、牛、羊、鸡、鹅、番鸭、斑胸草雀、猫、草鱼、鲤鱼基因序列进行同源性分析,结果显示duTLR3与其他鸭的序列同源性达98%~99.6%,与鹅的同源性达96.8%,与鸡的同源性达89.5%,与斑胸草雀的同源性为87.6%,与牛、羊、猪、人、猕猴、狒狒、小鼠、大鼠、猫的同源性分别为66.4%、67.0%、67.1%、67.6%、66.9%、67.4%、64.3%、64.1%、67.4%,与草鱼和鲤鱼的同源性最低,为54.8%、54.3%同样对其推导的氨基酸序列进行同源性分析,结果显示鸭物种相比较,同源性很高,其中与绿头鸭的同源性高达99.6%,只在239、462、685、709aa共4处存在突变;与番鸭和鹅的同源性次之,为97.1%、92.1%;与鸡的同源性为86.4%;与斑胸草雀的同源性为83.2%;与人、猕猴、狒狒、小鼠、大鼠、猪、牛、羊、猫同源性分别为62.3%、61.5%、62.4%、60.0%、54.8%、53.5%、61.7%、77.4%、62.3%;与草鱼和鲤鱼的氨基酸同源性最低为48.5%、47.4%(表2)。

图5 北京鸭TLR3蛋白分子二级结构预测Fig.5 Prediction of secondary structure of TLR3protein in Peking duck

图6 北京鸭TLR3蛋白分子结构域预测Fig.6 Prediction of molecular structural domain of TLR3protein in Peking duck
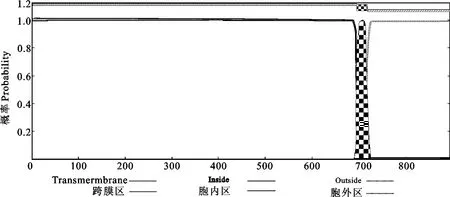
图7 北京鸭TLR3蛋白跨膜区预测Fig.7 Prediction of transmembrane helices of TLR3protein in Peking duck
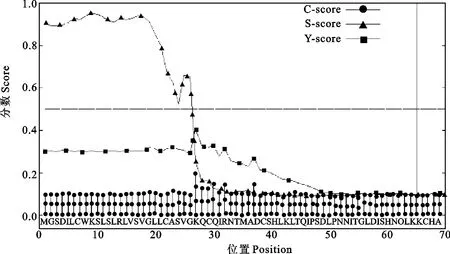
图8 北京鸭TLR3蛋白信号肽位置预测Fig.8 Prediction of signal peptide cleavage sites in amino acid sequences fromPeking duck TLR3protein
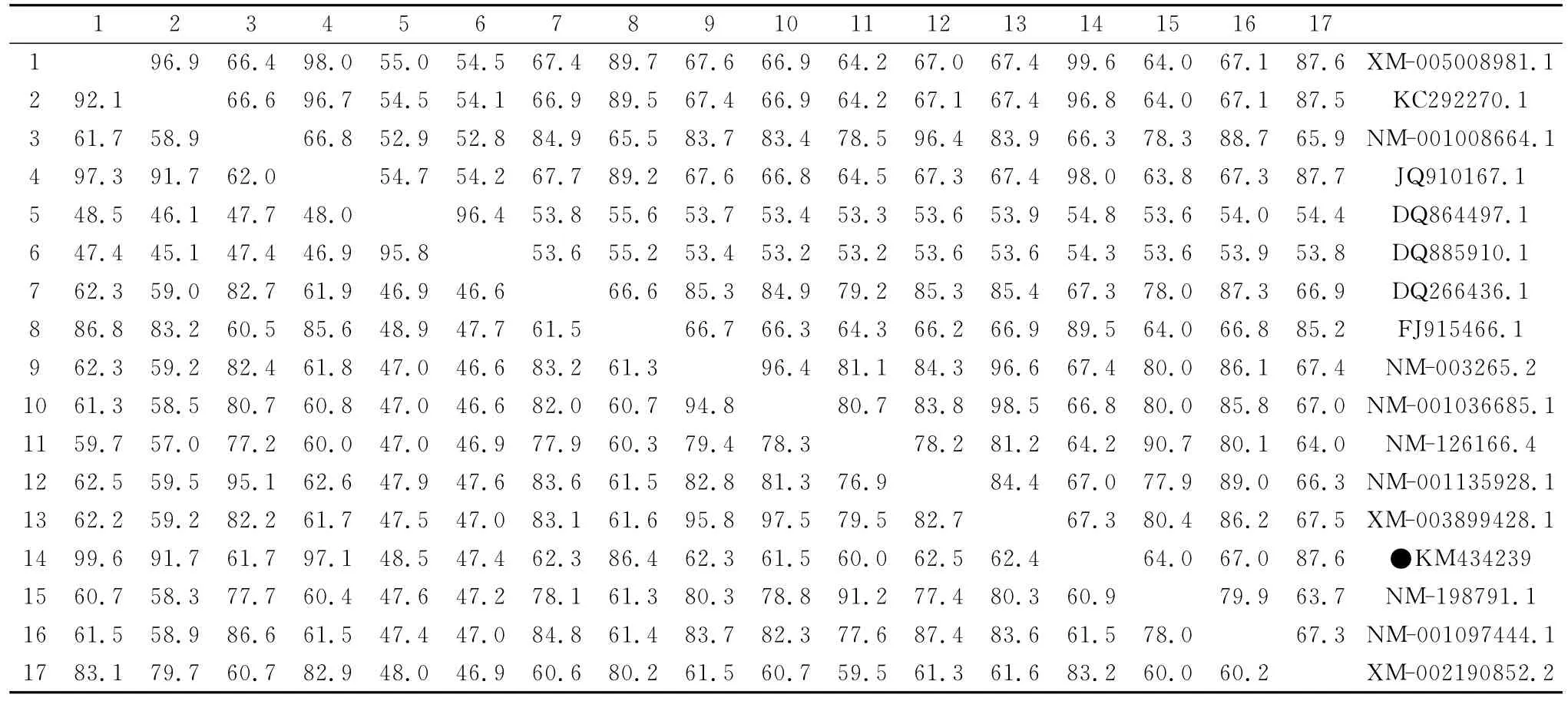
表2 鸭与其他物种TLR3基因(右上)和氨基酸序列(左下)同源比对Table 2 Homology comparison of TLR3nucleotide sequences(up right)and amino acid sequences(down left)in duck and other vertebrates
2.9duTLR3基因遗传进化树的构建
应用MEGA 6.0软件Neighbor-Joining法重复1 000次,将获得的17条TLR3基因序列构建Bootstrap验证的系统遗传进化树,其基因遗传进化树结果显示,北京鸭与番鸭、绿头鸭的亲缘关系最近,并与鸡、鹅、斑胸草雀处于禽类节支,人、猕猴、狒狒、小鼠、大鼠、猪、牛、羊、猫等哺乳动物构成一个分支,草鱼和鲤鱼形成一个遗传距离较远的鱼类分支(图9)。
2.10duTLR3在北京鸭体内组织分布
结果见图10。取各组织的PCR产物,以β-actin为内参对照,核酸电泳检测发现,duTLR3组成性表达,广泛分布各个组织脏器,其中在胸腺、哈氏腺、骨髓、脑、皮肤、肌肉等高丰度度表达;在肝、心、脾、肺、肾、食道和气管适度表达;在腺胃、肌胃、胰腺、十二指肠、空肠、盲肠和法氏囊低丰度表达(图10)。
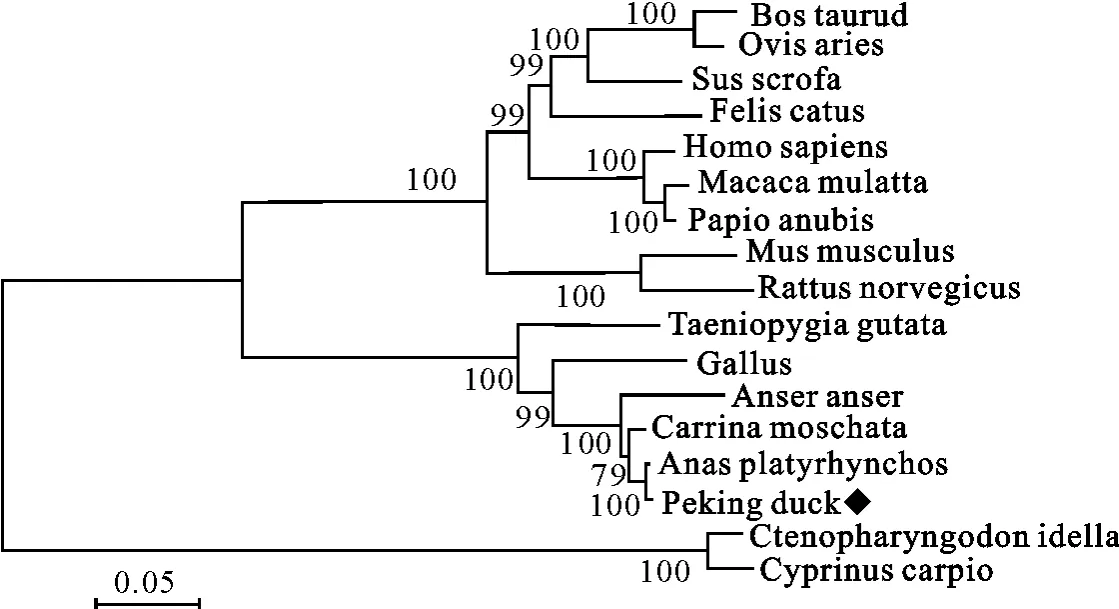
图9 鸭TLR3(KM434239)与其他物种间的基因序列遗传进化树Fig.9 Phylogentic trees between Peking duck and different species based on nucleotide sequences of TLR3(KM434239)

图10 北京鸭duTLR3组织分布图Fig.10 Tissue distribution of duTLR3in Peking duck
3 讨论
TLRs是天然免疫识别受体家族一员,能够识别PAMPs,引起抗微生物免疫应答。TLRs通过识别脂多糖(LPS)、脂肽、鞭毛蛋白、dsRNA或CpG DNA基序等PAMPs在激发宿主免疫应答中发挥重要作用[5]。TLRs表达于特定的细胞区室,TLR1、TLR2、TLR4、TLR5、TLR6和TLR11(仅小鼠)表达于细胞表面,而TLR3、TLR7、TLR8和TLR9表达于细胞内囊泡中,如内体膜和内质网膜[6]。TLR3识别dsRNA,受体活化后激活NF-kB启动子和引起Ⅰ型干扰素的产生。
目前,对人、鼠的TLRs研究较深入,家禽的TLRs分子结构及功能研究较少,对鸡的Toll样受体功能研究发现,chTLR表达量与一些体病原感染有关[7-9]。比较而言,鸭的TLRs研究还未引起关注。近年来一些家禽的TLRs逐渐被克隆,鸡TLR3、鹅TLR3及鸭TLR2、鸭TLR4的克隆相继有文献报道[10-13],但是对鸭的TLR3功能研究很少。鸭科(Anatidae)总共有44属(Anas),其中北京鸭位列于鸭属(Anas)的绿头鸭(Anas platyrhynchos)家族,而番鸭位列于栖鸭属(Cairina)的疣鼻栖鸭(Cairina moschata)家族,番鸭的TLR3已经被克隆出来,且健康番鸭攻禽流感病毒H5N1亚型后,脑组织TLR3的表达量显著提高[2]。
本研究首次从北京鸭外周血单个核细胞中成功克隆出TLR3,大小为2 688bp,含一个完整的开放阅读框(ORF),共编码895氨基酸。鸭组织表达谱分析表明,duTLR3组成性表达,广泛分布与机体的各个组织器官。利用生物信息学相关软件对所得序列进行了分析,发现北京鸭、金定鸭和番鸭等鸭物种内,核苷酸序列与氨基酸序列高度保守,推导氨基酸序列与金定鸭序列同源性99.6%,仅有4个氨基酸差异,主要位于胞外区和跨膜区,胞内区严格保守,与番鸭氨基酸序列同源性为97.1%,有26个氨基酸突变,其中25个突变处于胞外区,1个突变位于TLR区,这可能与胞内区起信号转导功能而胞外区负责识别PAMPs有关。进化树分析表明TLR3随物种差异不同处于不同分支上,且哺乳动物、禽类、鱼类3个分支明显,说明TLR3具有较大的种属特异性,而且同物种内TLR3也有一定差异,这提示TLR3在病原识别、信号转导及引起机体免疫应答中具有生物多样性,TLRs的多态性可能对宿主抗病原的应答有深远影响,且与对疾病的抗性和易感性相关[14-15],因此亟待深入开展对鸭TLR3结构与功能的研究。本研究对于揭示dsRNA病毒的感染机理、病毒跨物种传播机制及疾病防控等方面有重要理论价值。
参考文献:
[1] Moresco E M Y,LaVine D,Beutler B.Toll-like receptors[J]. Cur Biol,2011,21(13):488-493.
[2] Jiao P R,Wei L M,Cheng Y Q,et al.Molecular cloning,characterization,and expression analysis of the Muscovy duck Toll-like receptor 3(MdTLR3)gene[J].Poult Sci,2012,91 (10):2475-2481.
[3] 王德成,佘 敏,佘锐萍,等.Toll样受体研究进展[J].动物医学进展,2008,29(2):56-60.
[4] Chen S,Cheng A,Wang M.Innate sensing of viruses by pattern recognition receptors in birds[J].Vet Res,2013(44):82.
[5] Werling D,Jann O C,Offord V,et al.Variation matters:TLR structure and species-specific pathogen recognition[J]. Trends Immunol,2009,30(3):124-130.
[6] Kim Y M,Brinkmann M M,Paquet M E,et al.UNC93B1delivers nucleotide-sensing Toll-like receptors to endolysosomes J.Nature20084527184234-238.
[7] 周作勇,陈 狄,邹丽娟,等.鸡Toll样受体及其与病原微生物感染关系研究进展[J].中国预防兽医学报,2011,33(3):249-252.
[8] 郑衍生,何怡宁,谢智文,等.鸡传染性支气管炎病毒诱导的天然免疫应答研究进展[J].动物医学进展,2013,34(12):152-155.
[9] 甘珊珊,何秀苗,韦 平.鸡Toll样受体研究进展[J].动物医学进展,2010,31(9):76-80.
[10] 李国勤,马永升,贾红敏,等.鸭TLR2基因的克隆、序列分析及其结构预测[J].中国畜牧杂志,2011(19):17-21.
[11] 甘珊珊,何秀苗,韦 平.鸡Toll样受体3基因全长的扩增及生物信息学分析[J].中国兽医科学,2011,41(6):614-619.
[12] 刘少丰,雍艳红,巨向红,等.马岗鹅TLR3基因选择性剪切体的克隆及生物信息学分析[J].中国草食动物科学,2013,33 (3):5-10.
[13] 黄正洋,陈 阳,李欣钰,等.鸭TLR4基因可变剪接体的克隆、鉴定及组织表达分析[J].畜牧兽医学报,2013,44(5):697-702.
[14] Chen Z,Ma G,Qian Q,et al.Toll-like receptor 8polymorphism and coronary artery disease[J].Mol Biol Rep,2009,36 (7):1897-1901.
[15] Zhang Y B,He F L,Fang M,et al.Increased expression of Toll-like receptors 4and 9in human lung cancer[J].Mol Biol Rep,2009,36(6):1475-1481.
Cloning and Sequence Analysis of TLR3 Gene in Peking Duck
SONG Kai-jie1,2,LI Chuan-feng2,CHEN Zong-yan2,MENG Chun-chun2,HUANG Yun-xiu2,3,LI Dan-dan1,2,LIU Guang-qing2,ZHANG Miao-tao1
(1.College of Veterinary Medcine,Northwest A&F University,Yangling,Shaanxi,712100,China;2.Shanghai Veterinary
Research Institute,Chinaese Academy of Argricular Science,Shanghai,200241,China;3.College of Animal Sciences and Technology,Guangxi University,Nanning,Guangxi,530004,China)
Abstract:To research the structure and function of TLR3in Peking duck,according to the published Cairina moschata TLR3gene sequence in the GenBank(JQ910167.1),the primers were designed.Peking duck TLR3(named duTLR3)gene was cloned from peripheral blood mononuclear cell of duck by using RT-PCR,and the structure and function were predicted by utilizing bioinformatics technology.The results of sequence analysis showed that the length of cloned TLR3cDNA is 2688bp,including a complete open reading frame(ORF),it encodes a peptide of 895amino acids,which is rich of 17.0%leucine.Toll-like receptor 3(duTLR3)is typeⅠtransmembrane receptor,consisting of an extracellular domain(1-695aa),a transmembrane domain(696-718aa)and an intracellular domain(719-895aa).Furthermore there is a signal peptide in its N terminal besides its extracellular region with 18 leucine rich repeats(LRR)while its intracellular region has a Toll/interleukin-1receptor(TIR)domain.Nucleotide sequence homology analysis showed that Peking duck has higher homology with Anas latyrhynchos(XM-005008981.1)up to 99.6%,the homology of nucleotide sequence of duTLR3with those of Cairina moschata,Anser anser,Gallus,Taeniopygia guttata,is much higher than that of Homo sapiens.Macaca mulatta,Papio Anubis,Mus musculus,Rattus norvegicus,Sus scrofa,Bos taurus,Ovis aries,Felis catus,Ctenopharyngodon idella and Cyprinus carpio being the lower homology than duTLR3.duTLR3is constitutively expressed in all tissues of Peking duck.The results showed that duTLR3gene was cloned successfully and was predicted with characteristics of typical structure of TLR family.It laied a solid foundation on researching about how TLR3recognizes virus and activates downstream signaling cascades.
Key words:TLR3of Peking duck;molecular Cloning;sequence analysis;structure prediction
作者简介:宋凯杰(1987-),男,河北邢台人,硕士研究生,主要从事动物病毒分子生物学研究。*通讯作者
基金项目:公益性农业科研专项项目(201003012);上海市科委创新计划项目(13391901602)
收稿日期:2014-12-18
中图分类号:Q78;S858.32
文献标识码:A
文章编号:1007-5038(2015)07-0022-07
