新型钌多吡啶配合物诱导肝癌细胞凋亡的机制研究
2015-02-26梁金凤李伟镇李晓玲
梁金凤,李伟镇,李晓玲
(1.广东省第一荣军医院药剂科,广东广州 510260,2.暨南大学生命科学技术学院,广东广州 510632)
新型钌多吡啶配合物诱导肝癌细胞凋亡的机制研究
梁金凤1,李伟镇1,李晓玲2
(1.广东省第一荣军医院药剂科,广东广州 510260,2.暨南大学生命科学技术学院,广东广州 510632)
中国图书分类号:R-332;R329.25;R341;R735.702.2;R735.705;R979.1
摘要:目的 探讨钌多吡啶配合物的体内外抗肝癌活性及其作用机制。方法 MTT法筛选出高效低毒的钌配合物2b;流式细胞术分析其对细胞周期的影响;Western blot法检测p53和p21蛋白的表达水平;荷瘤裸鼠实验评价该配合物的体内抗肿瘤活性。结果 钌多吡啶配合物对多种人肝癌细胞株的生长有抑制作用,其中配合物2b对肝癌细胞Hep 3B的作用最明显,IC50为12.1 μmol·L-1。2b可以有效地诱导Hep 3B细胞凋亡,使细胞内出现了DNA断裂,染色质固缩及subG1凋亡峰的出现。同时,2b能够激活caspase-9和caspase-3,促使p53蛋白磷酸化,提高p53总蛋白和p21蛋白的表达水平。体内实验表明,配合物2b对裸鼠肿瘤的生长有明显的抑制作用。结论 钌多吡啶配合物在体内外模型中均具有良好的抗肝癌活性,通过诱导肿瘤细胞凋亡而抑制其增殖。
关键词:钌;抗肿瘤;肝癌;细胞凋亡;信号转导通路;caspas-es
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.044.html
肝癌是一种常见的消化系统恶性肿瘤,恶性程度极高,初期临床症状并不明显,80%的病例发现时已属中晚期,且由于多数合并肝硬化,伴有肝功能异常,无法接受根治性手术,化疗是其主要的治疗手段[1-2]。铂类药物是临床上应用最广的抗癌药物之一,但其在治疗过程中会产生明显的毒副作用及耐药性。近年来,在非铂类金属药物中,金属钌配合物受到广泛的关注,其高效、低毒、易被肿瘤组织吸收的特点,被认为是国际上最有前途的抗癌药物之一[3-4]。因此,将钌配合物开发成为一种潜在的新
型抗癌药物具有重要意义。
目前,大量的研究集中于钌多吡啶配合物,该类配合物大多数具有强烈的电子吸收光谱和荧光发射光谱,有灵敏可调性,可用于分子开关。本团队在前期工作中合成了一系列苯并咪唑吡啶类金属钌配合物(Fig 1),发现该类配合物,在肿瘤细胞与正常细胞之间具有良好的选择性,具有良好的抗肿瘤活性,通过激活线粒体凋亡信号通路和活性氧(ROS)介导的p53信号通路而高效地诱导乳腺癌细胞凋亡,但是,其体内抗肿瘤活性也有待进一步评价[5-6]。而这些凋亡信号通路和肝癌细胞凋亡密切相关,细胞凋亡对肝癌的发生起负调控作用,肝癌细胞可以通过药物诱导的细胞凋亡而被清除。抑癌基因p53是肿瘤治疗的靶点,它在诱导肝癌细胞凋亡的过程中扮演着重要的角色。目前关于该类配合物对肝癌的作用及分子机制尚未有报道,这也是值得深入探讨的科学问题。因此,本文选择多种肝癌肿瘤细胞株和L02人正常肝脏细胞株,采用MTT法对配合物的体外抗肿瘤活性进行筛选。结果表明,该类配合物能不同程度的抑制不同肝癌细胞的增殖,而对L02人肝脏细胞无明显毒性。通过流式细胞术分析、Western blot、荷瘤裸鼠模型等对其抗肿瘤活性进行综合评价,初步探讨该配合物的抗肿瘤作用机制,为高效、低毒的新型抗肝癌药物开发提供依据。
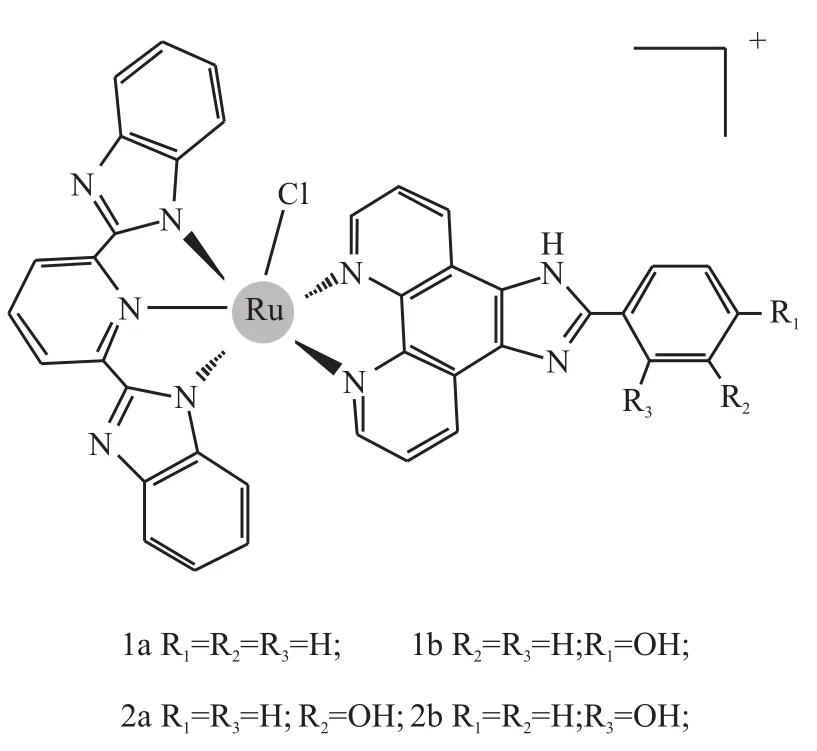
Fig 1 Chemical structure of Ru complexes used in this study
1 材料
1.1试剂与仪器 四氮唑蓝(MTT)、DAPI、TUNEL、DMSO、DMEM和RPMI 1640培养基等均购自Sigma-Aldrich公司。抗体均为Cell Signaling Technology产品。BCA蛋白定量试剂盒,酶活性检测试剂盒为碧云天公司。细胞培养耗材为捷倍斯公司。ELX800型酶标仪(美国Bio-Tek公司);流式细胞仪(Beckman Coulter,美国);净化工作台(苏州安泰),二氧化碳培养箱(Thermo,美国),荧光显微镜及成像系统(Nikon,Eclipse E600,日本),Western blot电泳仪(Bio-Rad,美国)。
1.2细胞 本实验选择的几种人肝癌细胞Hep 3B、Huh 7、HepG2、SMMC7721及肝脏正常细胞L02均购自ATCC公司。
1.3实验动物 本实验正常体质量为16~18 g BALB/C裸小鼠,为4~6周龄。由暨南大学实验动物中心提供。在无特殊病原条件下饲养。
2 方法
2.1化合物的制备 本研究所使用的钌配合物参考前期方法合成[5],并用质谱及核磁共振(NMR)进行验证。
2.2细胞培养 将受试样品用含有胎牛血清的RPMI1640和DMEM配成一定浓度的原液,再依次稀释到需要的浓度。培养基(DMEM和RPMI等)添加小牛血清(10%),青霉素(1×105U·L-1)和链霉素(5×104U·L-1)。培养条件:37℃,5%CO2。根据细胞生长状况每2~3 d换培养液1次,当细胞生长状态稳定,呈对数生长期时,用于实验。
2.3体内实验 以裸鼠荷瘤模型来评价药物体内的抗肿瘤效果。106个Hep 3B人肝癌细胞细胞(重悬于PBS)注射于裸鼠腋下,待1周成瘤后,开始给药。剂量设置为:高剂量组:5 mg·kg-12b;低剂量组:2.5 mg·kg-12b;正常对照组:PBS。每组10只小鼠,给药方式为尾静脉给药,连续给药16 d。停药后,记录裸鼠体重的变化,测量肿瘤体积的变化,处死裸鼠后,称取肿瘤质量。肿瘤体积=L×W2/2。L为肿瘤最长轴,W为肿瘤宽度。
2.4MTT法测定细胞存活率实验 取对数生长期的细胞,接种于96孔培养板,每孔100 μL,细胞浓度为2×107·L-1,培养24 h后,再分别加入不同浓度2b 100 μL,置37℃,5%CO2培养特定72 h。加入MTT(5 g·L-1),20 μL/孔,5 h后离心弃上清液,加入二甲基亚枫(DMSO)100 μL/孔,振荡15 min左右,待细胞内紫色结晶溶解后,置于酶标仪测定OD值,波长为570 nm。计算细胞存活率,同时作图并求得半数抑制浓度(IC50)。
参考文献2.5流式细胞分析 Hep 3B细胞用不同浓度的2b处理72 h后,[7]的方法操作,离心收集细胞,用PBS清洗两次,加入70%乙醇,-20℃放置固定过夜,之后进行细胞碘化丙啶(PI)染色。利用Beckman流式细胞分析仪测定DNA含量。细胞周期分布利用软件MultiCycle(Phoenix Flow Systems,
San Diego,CA)。用DNA柱状图表示细胞在G0/G1、S和G2/M各相的分布比例。通过测得的sub-G1峰表示凋亡细胞亚二倍体DNA含量。每个样品分析10 000颗细胞。
2.6TUNEL-DAPI双染检测 在载玻片上培养的细胞经药物处理后,3.7%的甲醛固定10 min,再加入含有0.1%的Triton X-100的PBS。然后加入10 μmol·L-1的TUNEL染液,避光37℃孵育1 h,加入10 μmol·L-1的DAPI染色15 min,PBS洗涤,荧光显微镜拍照。
2.7Caspase活性检测 将适量的细胞裂解液加入细胞,在冰上裂解1 h,离心后收集上清液,用BCA法测定蛋白含量。将细胞裂解液加入96孔板中,再加入caspase底物、半胱氨酸蛋白酶-3 (caspase-3)、半胱氨酸蛋白酶-8(caspase-8)和半胱氨酸蛋白酶-9(caspase-9),然后在37℃下孵育1 h。利用荧光酶标仪测定caspase活性,激发波长和发射波长分别为380 nm和440 nm。
2.8Western blot检测蛋白表达 细胞经药物处理后,加入适量的细胞裂解液,在冰上裂解1 h,提取细胞总蛋白,用BCA法测定蛋白含量,取100 μg总蛋白,以12%SDS-PAGE凝胶电泳分离后,转到PVDF膜上,封闭奶粉在室温下封闭1 h,TBST洗膜3次,加入单克隆抗体在4℃下孵育过夜。TBST洗膜3次,以HRP连接的二抗室温孵育1 h,利用ECL显示反应蛋白产物,曝光,显影,定影。β-actin作为蛋白加样内参照。
3 结果
3.1抗肿瘤活性的研究 首先,使用MTT法检测所合成的苯并咪唑吡啶钌配合物对Hep 3B、Huh 7、及SMMC7721等3种人肝癌细胞的增殖抑制活性,同时研究其对L02人正常肝脏细胞的细胞毒性。如Tab 1所示,苯并咪唑吡啶钌配合物均能不同程度的抑制不同人肝癌细胞的增殖,特别是配合物2b,对Hep 3B表现出良好的特异性,其IC50值12.1 μmol·L-1明显的低于其他肿瘤细胞。同时,该配合物对L02正常细胞无明显的毒性,IC50值大于200 μmol·L-1,提示该类配合物在肿瘤细胞与正常细胞之间具有良好的选择性。
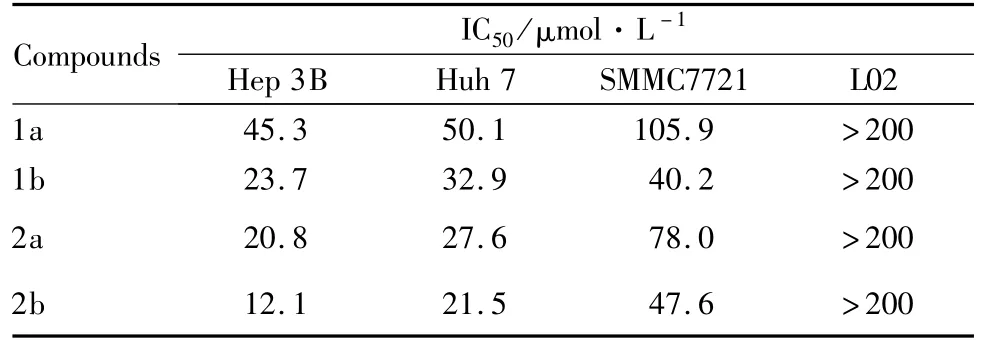
Tab 1 Cytotoxic effects of Ru complexes on human cancer and normal cell lines
3.2钌配合物诱导Hep 3B肿瘤细胞凋亡 在MTT筛选中发现Hep 3B细胞对2b最为敏感,于是选用该细胞作为模型研究所合成钌配合物的抗肝癌作用机制。首先,使用流式细胞仪对2b作用后细胞周期的改变进行分析,检测凋亡特有的凋亡峰(Sub-G1phase),并计算凋亡百分数(AP:%)。结果如Fig 2所示,2b能明显地诱导Hep 3B细胞凋亡,表现为Sub-G1峰的升高,且呈剂量依赖关系。当2b的浓度增加到20 μmol·L-1时,细胞凋亡率从1.6%(对照组)提高到62.4%。同时,我们观察到2b的处理对G0/G1、S及G2/M其细胞百分比没有明显的改变。这些结果说明2b通过诱导细胞凋亡而抑制肝癌细胞生长的。
3.3钌配合物诱导Hep 3B肿瘤细胞染色质和DNA断裂 Hep 3B细胞经不同浓度2b处理后进行固定及TUNEL-DAPI双染。结果如Fig 3所示,2b处理导致细胞呈现核浓缩(蓝色),染色加深,同时观察到DNA的断裂(绿色),且随着2b浓度增加而加剧。本结果进一步证明细胞凋亡是2b抑制肿瘤细胞生长的主要机制。
3.4钌配合物诱导Hep 3B细胞内caspase活化为了阐明2b诱导凋亡的机制,我们检测了细胞凋亡过程中的关键酶caspase-3、caspase-8和caspase-9的活性,结果如Fig 4所示。我们可以看出2b作用后的Hep 3B细胞中,caspase-3和caspase-9的活性均有剂量依赖性的提高,而caspase-8不被激活。当2b浓度为20 μmol·L-1时,caspase-9活性上升为原来的1.8倍,这表明2b是通过激活外源性的信号通路而诱导Hep 3B细胞凋亡的。
3.5钌配合物诱导p53磷酸化和p21升高 为了进一步探讨2b诱导肿瘤细胞凋亡的信号通路,我们检测了细胞中p53和p21蛋白质的表达水平。Western blot检测结果显示(Fig 5),用2b作用Hep 3B细胞24 h后,细胞中p53蛋白磷酸化,总的p53蛋白和p21蛋白质的表达水平明显升高。
3.6钌配合物抑制裸鼠肿瘤的生长 对于为进一步评价2b在体内的抑制肿瘤生长效果,我们进行荷瘤裸鼠实验。2b经过20 d的隔天给药,裸鼠肿瘤的生长明显受到抑制,2b能够降低肿瘤的重量(Fig 6A,B),减少肿瘤的体积(Fig 6C,D)。这些结果表明,2b可在体内有效地抑制裸鼠的肿瘤生长。

Fig 2 Cell apoptosis induced by 2b

Fig 3 Representative photomicrographs of DNA fragmentation and nuclear condensation induced by 2b
4 讨论
细胞凋亡是维持机体细胞群增殖与死亡的重要方式,这种方式一旦失调就会导致机体疾病,甚至肿瘤的发生、肿瘤细胞凋亡是一个关键的调节机制[8]。细胞凋亡会出现许多形态学方面的变化,如质膜的改变、胞质和细胞核的固缩、核内DNA裂解。本研究通过MTT比色法观察,苯并咪唑吡啶钌配合物均能抑制不同人肝癌细胞的增殖,特别是配合物2b对Hep 3B的特异性最好,其IC50值为12.1 μmol·L-1。通过TUNEL-DAPI双染实验,在荧光
显微镜下观察到,2b诱导Hep 3B细胞出现了细胞核浓缩,DNA断裂等凋亡特征。凋亡的主要生化改变是DNA在凋亡内切酶的作用下,切断成片段状,部分DNA流失,细胞内的DNA总量减少。凋亡细胞的DNA总含量减少,它在流式细胞仪检测中出现特殊的Sub-G1凋亡峰。流式细胞仪检测结果表明,2b诱导Hep 3B细胞出现了Sub-G1峰,且Sub-G1峰的累积呈浓度依赖性。
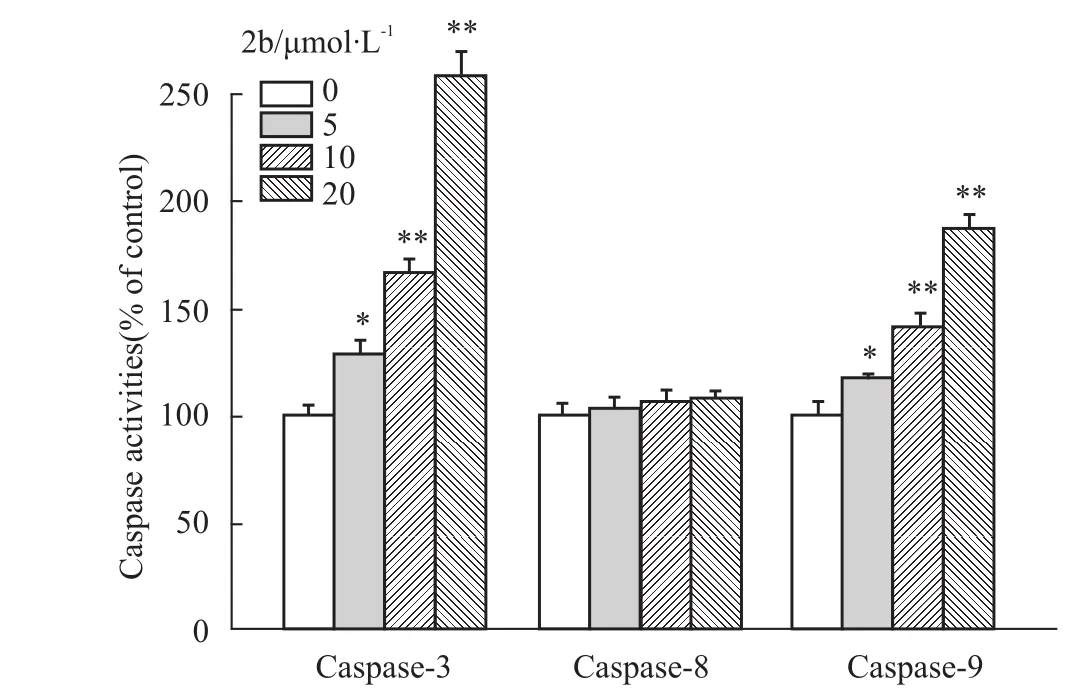
Fig 4 Caspase activities of Hep 3B cells induced by 2b

Fig 5 Western blot analysis for the expression levels of p-p53,p53 and p21 in Hep 3B cells induced by 2b

Fig 6 2b inhibits tumor weight(A/B)and volume tumor(C/D)of Hep 3B cells in nude mice
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中,caspase-3是细胞凋亡信号传导中的关键性效应酶,它正常以酶原(32 ku)的形式存在于胞质中,在凋亡的早期阶段,它被激活,活化的caspase-3裂解为12 ku和17 ku的亚单位,最终导致细胞凋亡[9]。细胞凋亡包括内源性线粒体途径和外源性死亡受体途径,caspase-8是外源性凋亡途径的执行分子,caspase-9是内源性凋亡途径的执行者[10]。本研究发现,caspase-3和caspase-9的活性被2b激活,而caspase-8的活性不被激活,提示2b诱导Hep 3B细胞凋亡是通过激活内源性凋亡途径实现的。
抑癌蛋白p53的表达减少与多种肿瘤的发生相关,包括肝癌。p53能通过内源性和外源性凋亡通路直接或间接地诱导细胞凋亡,从而抑制肿瘤[11]。一般认为,p53的促凋亡功能与线粒体释放凋亡因子有关。p53介导的凋亡是由DNA断裂激活的,其活性可通过特定氨基酸残基的磷酸化、乙酰化等来调节[12]。p53蛋白可通过调节p21与Bax在细胞周期阻滞及诱导细胞凋亡中发挥重要作用[13]。本实验中,我们发现2b诱导Hep 3B细胞中p53磷酸化,且提高p53总蛋白表达量,同时,p21的蛋白表达量也明显地增加了。
钌配合物2b的体内抗肝癌活性,在荷瘤裸鼠实验中得到进一步的证明,2b能够减少肿瘤的体积和降低肿瘤的质量。综上所述,本实验室设计合成的苯并咪唑吡啶钌配合物具有良好的抗肝癌活性,它通过诱导肿瘤细胞凋亡而抑制其增殖,因此,具有潜在的应用开发前景,可作为候选化学药物进行深入的临床前抗肿瘤研究。然而该配合物的作用靶标和深入的药理作用机制,有待于进一步研究。
(致谢:本实验在暨南大学靶向药物研究室完成,感谢实验室的老师对本实验的帮助与指导。)
[1] 陈绍俊,黄海欣,李桂生.原发性肝癌的内科治疗现状[J].中国肿瘤,2013,22(2):115-9.
[1] Chen S J,Huang H X,Li G S.Present status of medical treatment for hepatocellular carcinoma[J].Bull Chin Cancer,2013,22 (2):115-9.
[2] Yang X,Chen L,Liu Y,et al.Ruthenium methylimidazole com-plexes induces apoptosis in lung cancer A549 cells through intrin-sic mitochon-drial pathway[J].Biochimie,2012,94(2):345-53.
[3] Bergamo A,Sava G.Ruthenium complexes can target determi-nants of tumour malignancy[J].Dalton Trans,2007,7(13):1267-72.
[4] Sava G,Bergamo A,Zorzet S,et al.Influence of chemical stabili-ty on the activity of the antimetastasis ruthenium compound NAMI-A[J].Eur J Cancer,2002,38(3):427-35.
[5] Zhao Z,Luo Z,Wu Q,et al.Mixed-ligand ruthenium polypyridyl complexes as apoptosis inducers in cancer cells,the cellular trans-location and the important role of ROS-mediated signaling[J].Dalton Trans,2014,43(45):17017-28.
[6] Li L,Cao W,Zheng W,et al.Ruthenium complexes containing 2,6-bis(benzimidazolyl)pyridine derivatives induce cancer cell apop-tosis by triggering DNA damage-mediated p53 phosphorylation[J].Dalton Trans,2012,41(41),12766-72.
[7] 张秀娟,侯 ?,白雪莹,季宇彬.杨梅素作用于人肝癌HepG-2细胞凋亡信号转导途径的研究[J].中国药理学通报,2014,30 (1):71-6.
[7] Zhang X J,Hou J,Bai X Y,Ji Y B.Studies on myricetin indu-cing human hepatoma HepG-2 cells apoptosis through signal trans-duction pathway[J].Chin Pharmacol Bull,2014,30(1):71-6.
[8] Scheit K,Bauer G.Direct and indirect inactivation of tumor cell protective catalase by salicylic acid and anthocyanidins reactivates intercellular ROS signaling and allows for synergistic effects[J].Carcinogenesis,2015,36(3):400-11.
[9] Juraver-Geslin H A,Durand B C.Early development of the neural plate:New roles for apoptosis and for one of its main effector Caspase-3[J].Genesis,2015,53(2):203-24.
[10]Orrenius S,Gogvadze V,Zhivotovsky B.Mitochondrial oxidative stress:implications for cell death[J].Annu Rev Pharmacol Toxi-col,2007,47:143-83.
[11]Turner N,Moretti E,Siclari O,et al.Targeting triple negative breast cancer:is p53 the answer[J].Cancer Treat Rev,2013,39 (5):541-50.
[12]Chen T,Wong Y S.Selenocystine induces apoptosis of human melanoma A-375 cells by activating ROS-mediated mitochondrial pathway and p53 phosphorylation[J].Cell Mol Life Sci,2008,65 (17):2763-75.
[13]Vernet-Tomás M,Baos N,Sabadell D,et al.p53 expression in breast cancer predicts tumors with low probability of non-sentinel nodes infiltration[J].J Obstet Gynaecol Res,2015 Feb 6.doi:10.1111/jog.12670.
Apoptosis in hepatocellular carcinoma induced by novel ruthenium polypyridyl complexes
LIANG Jin-feng1,LI Wei-zhen1,LI Xiao-ling2
(1.Dept of Pharmacy,No.1 Hospital for Disabled Soldiers in Guangdong Province,Guangzhou 510260,China,2.College of Life Science and Technology,Jinan University,Guangzhou 510632,China)
Abstract:Aim To evaluate the antitumor activity of ruthenium polypyridyl complexes and the underlying mechanism.Methods The right complexes 2b were filtered with highest activity and lowest toxicity by MTT assay.The change of cell cycle was detected by flow cytometry.The expression of p53 and p21 was detected by Western blot.The in vivo antitumor activity of 2b was evaluated by the assay of tumor bearing nude mice.Results 2b potentially inhibited proliferation of a variety of hepatoma cell lines,among which Hep 3B cell was the most significant(IC50was 12.1 μmol· L-1).The apoptosis of Hep 3B cell was induced by 2b,as evidenced by DNA fragmentation,chromatin condensation and appearance of subG1peak.The ac-tivities of caspase-9 and caspase-3 were activated by 2b.The phosphorylation of p53 was induced by 2b.The expression of p53 and p21 was also up-regulated by 2b.The growth of tumor of nude mice was signifi-cantly inhibited by 2b in vivo experiment.Conclusion 2b has good in vitro and vivo antitumor activities,and it can inhibite growth of Hep 3B cells by inducing apoptosis.
Key words:ruthenium;anticancer;hepatocellular carcinoma;cell apoptosis;signaling pathways;caspas-es
作者简介:梁金凤(1979-),女,主管药师,研究方向:药学,E-mail:84824091@qq.com;李晓玲(1980-),女,博士,副教授,研究方向:抗肿瘤药物,通讯作者,E-mail:tlxlli@jnu.edu.cn
基金项目:国家自然科学基金资助项目(No 21201082)
收稿日期:2015-06-21,修回日期:2015-07-27
文献标志码:A
文章编号:1001-1978(2015)11-1592-06
doi:10.3969/j.issn.1001-1978.2015.11.022
