N-乙酰基半胱氨酸对Aβ25-35活化calpain活性的影响及可能机制
2015-02-26黄天文林智颖陈晓春
黄天文,林智颖,陈晓春
(1.福建医科大学附属协和医院神经内科,2.福建省老年医学研究所,福建福州 350001)
N-乙酰基半胱氨酸对Aβ25-35活化calpain活性的影响及可能机制
黄天文1,2,林智颖2,陈晓春1,2
(1.福建医科大学附属协和医院神经内科,2.福建省老年医学研究所,福建福州 350001)
中国图书分类号:R322.8;R329.2;R341;R745.702.2;R977.4
摘要:目的 探讨N-乙酰基半胱氨酸(N-acetyl-L-cysteine,NAC)对β淀粉样蛋白毒性片段25-35(Aβ25-35)活化cal-pain活性的影响及可能机制。方法 运用Aβ25-35来诱导皮质神经元的损伤,实验分为空白对照组、Aβ25-35组、NAC与Aβ25-35共同作用组,采用荧光酶标法检测calpain活性、氧自由基(H2O2)和线粒体膜电位;用化学发光法测定神经元内ATP水平。结果 Aβ25-35(20 μmol·L-1)作用12 h可明显升高calpain活性;与Aβ25-35处理组相比,NAC(10 mmol· L-1)预先作用24 h,然后再与Aβ25-35共同作用12 h,可明显降低calpain活性;与空白对照组相比,Aβ25-35处理组中的H2O2明显升高、线粒体膜电位和ATP水平明显下降;而与Aβ25-35处理组相比,NAC预处理组中的H2O2水平下降、线粒体膜电位和ATP水平升高,这些差异皆有统计学意义。结论 这些研究结果提示,NAC可能通过线粒体的保护作用来降低Aβ25-35诱导的异常活化的calpain活性。
关键词:N-乙酰基半胱氨酸;Aβ25-35;calpain;H2O2;线粒体膜电位;ATP
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.014.html
线粒体介导的氧化应激反应是阿尔茨海默病(Alzheimer’s disease,AD)重要的病理损害,因此减轻线粒体的氧化应激反应具有神经保护功效[1-2]。虽然AD的发病机制目前仍然不是很清楚,但是Aβ的瀑布学说仍为大部分学者所接受。其中Aβ片段25-35(Aβ25-35)是Aβ毒性的核心片段[3-4]。因此,运用毒性片段Aβ25-35来干预神经元可模拟AD样的病理生化改变[3],这为AD的研究提供了可靠的细胞模型。
N-乙酰基半胱氨酸(N-acetyl-L-cysteine,NAC)
是常见的抗氧化剂。我们前期研究发现,Aβ25-35可增加Cdk5活性,从而增加tau蛋白的过度磷酸化[5];而NAC可减轻Cdk5活性和tau蛋白磷酸化。所以,在我们实验室的前期研究基础上,本实验继续运用毒性片段Aβ25-35(20 μmol·L-1)来诱导原代培养皮质神经元损害,然后探讨NAC(10 mmol· L-1)对Cdk5上游信号calpain活性的影响。另外,线粒体功能受损可导致细胞内钙离子浓度升高[6],进而激活calpain活性,所以我们测定与线粒体功能密切相关的指标,如H2O2、线粒体膜电位和ATP。
1 材料与方法
1.1材料
1.1.1试剂 Aβ片段25-35、NAC均购自美国Sigma公司;胎牛血清购自中国杭州江滨生物技术有限公司;胰酶、DMEM-F12培养基、左旋多聚赖氨酸、10×Hanks平衡盐溶液、N2添加剂均购自美国Gibco公司。基础培养基:DMEM-F12、青霉素G (0.1 IU·L-1)、NaHCO3(2 g·L-1)、HEPES(1.19 g·L-1)和链霉素(0.1 IU·L-1)。无血清培养基:基础培养基+N2添加剂。完全培养基:基础培养基+N2添加剂(DMEM-F12∶N2=1∶1)+10%胎牛血清。H2O2测定试剂盒购自美国Molecular Probes公司;N-succinyl-leu-tyr-7-amido-4-methylcoumarin购自美国Sigma公司;线粒体膜电位检测试剂盒(JC-1)购自Cell Technology公司;ATP测定试剂盒来自美国Roche公司。
1.1.2仪器 二氧化碳细胞培养箱(美国Forma Scientific公司);荧光酶标仪购自美国Bio-Tek公司;倒置显微镜(日本Olympus,CK40型);化学发光检测仪(美国Berthold公司)。
1.1.3动物 SD孕鼠[孕(18±2)d]清洁级,购自上海西普尔必凯实验动物有限公司。
1.2方法
参考文献1.2.1胎鼠皮质神经元培养 (详见[7]):孕鼠麻醉后取出胎鼠,然后剔除脑膜及分离皮质组织,再进行消化、分离皮质神经细胞,最后计数、接种培养板上。前3 d使用完全培养基培养,然后换成无血清培养基,继续培养3 d,这样体外共培养6 d后进行相关实验研究。 1.2.4荧光酶标仪测定calpain活性 (详见[5])神经元经各种处理后,用calpain裂解液AS [20 mmol·L-1Tris缓冲液pH 7.4,140 mmol·L-1氯化钠,0.1%Nonidet-40(乙基苯基聚乙二醇)和蛋白酶抑制剂Cocktail SetⅢ]裂解;收集裂解液后,在4℃下以10 000×g速度离心10 min;取上清液、进行蛋白定量;取20 μg蛋白置于96孔板中,同时加入calpain的作用底物130 μmol·L-1的N-succinyl-leu-tyr-7-amido-4-methylcoumarin,在30℃下避光孵育2 h。然后置于荧光酶标仪中(激发波360 nm;发射波480 nm)测定荧光数值。最后,把所得到的荧光值与空白对照组比较。 1.2.5荧光酶标仪测定H2O2[1]和H2O2试剂说明书,用荧光方法测定细胞内产生的H2O2量。接种在96孔板的皮层神经元,经各种条件处理后,细胞暴露于含有50 μmol·L-1的Amplex Red reagent和0.1 kU·L-1辣根过氧化物酶(horse-radish peroxydase,HRP)作用60 min,选择激发波540 nm和发射波590 nm,用多功能荧光酶标仪测定荧光强度。同时设置空白对照组。 1.2.7ATP水平测定[1]和ATP试剂盒说明书,用Roche公司的ATP Bioluminescenee Assay Kit HSII检测细胞内ATP的含量。各组细胞用0.25%胰酶消化后收集,用ATP试剂盒中的溶解缓冲液(dilution buffer)将各组细胞数量调至107· L-1,之后加入ATP试剂盒中的细胞裂解试剂(cell lysis reagent)于15℃~25℃条件下作用5 min,最后加入等体积的荧光(素)酶试剂(luciferase reagent),用化学发光检测仪检测化学发光的强度,比较不同组细胞内ATP水平。
1.2.2凝聚态Aβ25-35的制备[8]用超纯水溶解Aβ25-35,配成1 mmol·L-1;然后储存于-20℃。在Aβ25-35使用前,将Aβ25-35融化并且置于37℃环境,总共孵育4 h。这样使得单体的Aβ25-35凝聚成凝聚态状态。
1.2.3实验设计分组 ①空白对照组:未给予干预处理。②Aβ25-35组:20 μmol·L-1的Aβ25-35作用12 h。③NAC预处理组:先给予10 mmol·L-1的NAC作用24 h,然后给予20 μmol·L-1的Aβ25-35共同作用12 h。
1.2.6线粒体膜电位测定 使用线粒体膜电位检测试剂盒(JC-1)来检测线粒体的膜电位。根据试剂盒说明书及参考文献[1],简要步骤如下:神经元经不同处理后,经胰酶消化后、洗涤。取相同数目的神经元,加入JC-1溶液,于37℃孵育15 min;然后洗涤多余的JC-1试剂,加入等体积的分析液,最后使用荧光酶标仪检测。所得的荧光强度比值反映线粒体内、外膜电位差:红色荧光强度(exλ550nm,emλ600nm)/绿色荧光强度(exλ485nm,emλ535nm)。
1.2.8统计学方法 实验结果以图、数据表示。采
用SPSS 10.0软件进行单因素方差分析进行组间比较分析,所得的值以±s(standard error of the mean)表示。
推荐理由:这是一本引自美国的经典服装类版权图书,艺术与技术交相辉映。本书从立体裁剪基本原理入手,详细讲解了基本款式、系列款式、变化款式的立体裁剪技法及应用,以期为广大爱好服装艺术的读者在原创作品和专业技术上提供指导和启发。
2 结果
2.1皮层神经元的培养 胎鼠皮层神经元培养了6 d后,拟进行相关实验。如Fig 1所示,光镜下培养了6 d的皮层神经元,神经元胞体立体感明显,突起广泛接触,形成神经网络。
Fig 1 Morphology of cortical neurons for 6 d under inverted microscope(×400)
2.2NAC对calpain活性的影响 本实验用Aβ25-35作用皮层神经元12 h,然后测定神经元内calpain活性。结果如Fig 2所示,与空白对照组相比较,神经元在Aβ25-35作用12 h后,calpain活性明显升高,这说明Aβ25-35可诱导神经元内calpain活性升高。为了研究NAC对神经元内calpain活性的影响,我们先给予10 mmol·L-1的NAC作用于皮层神经元24 h,然后与20 μmol·L-1的Aβ25-35共同作用12 h,最后测定神经元内calpain活性。结果显示,与Aβ25-35组相比较,NAC预先孵育组的神经元内calpain活性明显下降,且NAC预先孵育组的cal-pain活性与空白对照组中calpain活性水平接近。这提示了NAC可减轻Aβ25-35升高calpain活性的作用。
2.3NAC减轻Aβ25-35诱导的H2O2升高 H2O2是氧自由基的重要组成部分,我们运用荧光法测定细胞内的H2O2水平。如Fig 3所示,与空白对照组相比较,20 μmol·L-1的Aβ25-35作用12 h后,神经元的H2O2荧光值水平明显升高;10 mmol·L-1的NAC预先孵育24 h,再与20 μmol·L-1Aβ25-35作用12 h,细胞内的H2O2明显下降。
2.4NAC对神经元线粒体膜电位的影响 线粒体膜内外的电位差是线粒体维持自身功能的需要。当这种电位差下降,提示线粒体功能的下降。所以,测定线粒体膜电位是反映线粒体功能的一个重要指标。如Fig 4所示,神经元经Aβ25-35作用12 h后,线粒体膜电位就明显下降,这提示线粒体功能下降;另外,先经NAC预先孵育24 h后,再与Aβ25-35共同作用12 h后,相对于Aβ25-35组,线粒体膜电位则明显升高,提示线粒体功能有所改善。
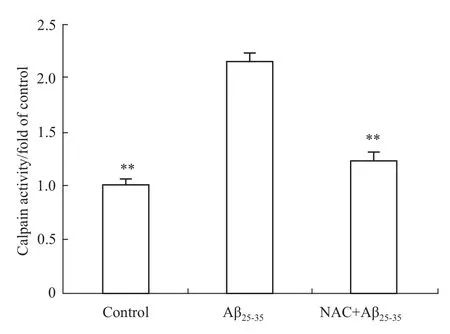
Fig 2 NAC attenuated increase of calpain activity induced by Aβ25-35(±s,n=3)

Fig 3 NAC decreased H2O2level in primary cortical neurons treated with Aβ25-35(±s,n=3)
2.5NAC对神经元ATP水平的影响 ATP是线粒体产生的,因此ATP的水平也反映线粒体的功能状态。由Fig 5可见,与空白对照组相比较,Aβ25-35作用后ATP的水平明显下降。这也提示Aβ25-35可
抑制线粒体功能。然而,与Aβ25-35组相比较,NAC预先孵育后,再与Aβ25-35共同作用组中,ATP水平有一定程度的升高。这说明NAC具有保护线粒体功能的作用。
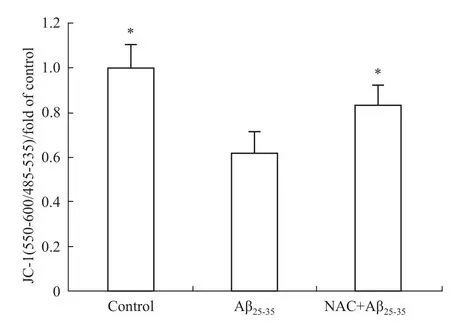
Fig 4 NAC attenuated decreasing of neuronal mitochondrial membrane potential induced by Aβ25-35(±s,n=3)
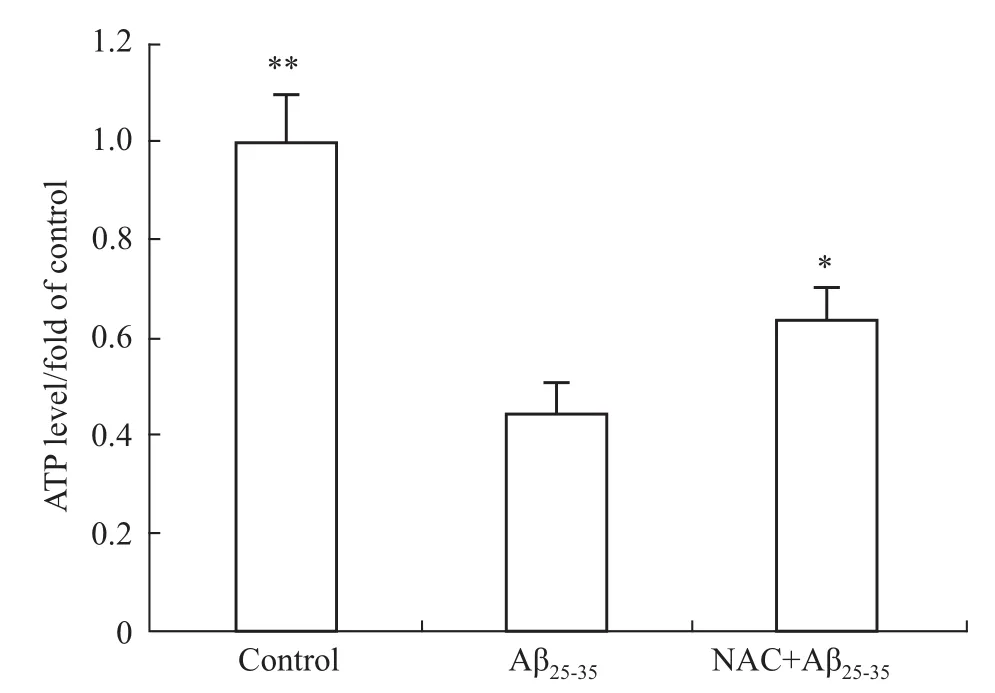
Fig 5 NAC increased ATP level(±s,n=3)
3 讨论
根据前期的研究基础,我们仍然继续使用20 μmol·L-1的Aβ25-35作用于皮层神经元12 h[8],然后测定calpain活性。同样根据我们的前期研究,我们选择预先用10 mmol·L-1的NAC孵育24 h,然后与20 μmol·L-1的Aβ25-35共同作用12 h的方式来探讨NAC的可能作用。
我们使用荧光法测定calpain活性,研究发现NAC可降低Aβ25-35诱导的细胞内calpain活性的水平。那么,NAC是通过什么途径来降低calpain的活性?大量研究证明,无论是AD患者或是Aβ的毒性损害,神经元内的线粒体皆有不同程度受损,并且有大量的氧自由基的堆积、线粒体膜电位下降和细胞内ATP水平明显下降。这些细胞内的改变和线粒体损害是一致的。
正常细胞质内的钙离子浓度远远低于细胞外或细胞内的内质网。但是,维持这种钙离子的浓度差是需要ATP参与的。当线粒体功能受损,ATP生成受阻。当产生的ATP不足以维持钙离子浓度差的时候,细胞质内的钙离子浓度就会不断升高。升高的钙离子浓度反过来激活钙依赖的蛋白激酶(如calpain)[11-12],从而使得细胞损害进一步加剧,最终导致细胞的死亡。另外,线粒体与内质网能进行相互影响,线粒体功能异常可影响到内质网功能,加剧细胞钙离子浓度的紊乱[12]。所以,保护线粒体功能,能够维持细胞质内的钙离子浓度,维持细胞稳态,抑制钙依赖的蛋白激酶calpain活性升高,保护神经元。
因此,为了能比较全面检测线粒体的功能,我们测定了细胞内的H2O2水平和线粒体膜电位及神经元内的ATP水平。结果提示,Aβ25-35作用12 h,线粒体膜电位和细胞内的ATP水平明显下降,而细胞内的H2O2明显升高;而NAC预先孵育后的神经元内线粒体膜电位和ATP水平是有所升高的,H2O2则明显下降。这些结果提示NAC可保护线粒体,提高细胞内的ATP水平。
综上所述,Aβ25-35可损害细胞内线粒体的功能、降低ATP水平、激活calpain活性;而NAC可改善线粒体功能、增加ATP的水平、减轻异常激活的calpain的活性。这些研究可为抗氧化剂治疗AD提供有价值的实验基础。
[1] Huang T,Fang F,Chen L,et al.Ginsenoside Rg1 attenuates oli-gomeric Aβ(1-42)-induced mitochondrial dysfunction[J].Curr Alzheimer Res,2012,9(3):388-95.
[2] Takuma K,Yao J,Huang J,et al.ABAD enhances Abeta-in-duced cell stress via mitochondrial dysfunction[J].FASEB J,2005,19(6):597-8.
[3] Yankner B A,Dawes L R,Fisher S,et al.Neurotoxicity of a frag-ment of the amyloid precursor associated with Alzheimer′s disease [J].Science,1989,245(4916):417-20.
[4] Wirths O,Multhaup G,Bayer T A.A modified beta-amyloid hy-pothesis:intraneuronal accumulation of the beta-amyloid peptide-the first step of a fatal cascade[J].J Neurochem,2004,91(3):513-20.
[5] Chen X,Huang T,Zhang J,et al.Involvement of calpain and p25 of CDK5 pathway in ginsenoside Rb1′s attenuation of beta-am-yloid peptide 25-35-induced tau hyperphosphorylation in cortical neurons[J].Brain Res,2008,1200:99-106.
[6] Hedskog L,Pinho C M,Filadi R,et al.Modulation of the endo-plasmic reticulum-mitochondria interface in Alzheimer′s disease and related models[J].Proc Natl Acad Sci USA,2013,110 (19):7916-21.
[7] Chen X C,Chen L M,Zhu Y G,et al.Involvement of CDK4,pRB,and E2F1 in ginsenoside Rg1 protecting rat cortical neurons from beta-amyloid-induced apoptosis[J].Acta Pharmacol Sin,2003,24(12):1259-64.
[8] 黄天文,陈晓春,张 静,等.p25/cdk5可能参与人参皂苷Rb1减轻Aβ25-35诱导的tau蛋白过度磷酸化[J].中国药理学通报,2006,22(6):688-93.
[8] Huang T W,Chen X C,Zhang J,et al.Involvement of p25/cdk5 in ginsenoside Rb1 attenuating β-amyloid peptide 25-35-induced tau hyperphosporylation[J].Chin Pharmacol Bull,2006,22 (6):688-93.
[9] Friedland-Leuner K,Stockburger C,Denzer I,et al.Mitochondri-al dysfunction:cause and consequence of Alzheimer′s disease[J].Prog Mol Biol Transl Sci,2014,127:183-210.
[10]黄天文,何饶丽,周 梦,等.人参皂苷Rg1对寡聚肽Aβ1-42增加JNK活性及诱导凋亡的影响[J].中国药理学通报,2015,31(1):60-3.
[10]Huang T W,He R L,Zhou M,et al.Effect of Ginsenoside Rg1 on JNK and oligomeric Aβ1-42-induced apoptosis[J].Chin Pharmacol Bull,2015,31(1):60-3.
[11]McBrayer M,Nixon R A.Lysosome and calcium dysregulation in Alzheimer′s disease:partners in crime[J].Biochem Soc Trans,2013,41(6):1495-502.
[12]Volgyi K,Juhász G,Kovacs Z,et al.Dysfunction of endoplasmic reticulum(ER)and mitochondria(MT)in Alzheimer′s disease:the role of the ER-MT cross-talk[J].Curr Alzheimer Res,2015,12(7):655-72.
Possible effect of N-acetyl-L-cysteine on Aβ25-35-induced increase of calpain activity
HUANG Tian-wen1,2,LIN Zhi-ying2,CHEN Xiao-chun1,2
(1.Dept of Neurology,2.Fujian Institute of Geriatrics,Fujian Medical University Union Hospital,Fuzhou 350001,China)
Abstract:Aim To explore the effect of N-acetyl-L-cysteine(NAC)on β amyloid peptide 25-35 (Aβ25-35)-induced the increase of calpain activity and its possible mechanism.Methods The activity of cal-pain was induced by 20 μmol·L-1Aβ25-35in primary cortical neuron.Neurons were incubated in the absent or present Aβ25-35,or pre-incubated NAC(10 mmol ·L-1),then co-incubated with Aβ25-35.The meas-urement of calpain activity,H2O2level and mitochon-drial membrane potential was performed on a micro-plate fluorometer.The ATP level was detected using a luciferin/luciferase based ATP assay kit.Results In Aβ25-35treated group,the activity of calpain and H2O2was obviously higher than that in control group.How- ever,in neurons pre-incubated in NAC and then co-in-cubated in Aβ25-35,the calpain activity and H2O2level were significantly decreased compared with that in Aβ25-35group.Upon Aβ25-35exposure for 12 h,corti-cal neurons showed a significant decrease in mitochon-drial membrane potential and ATP level when com-pared to the control group.Pre-treatment with NAC showed an increase in mitochondrial membrane poten-tial and ATP level as compared to neurons treated with Aβ25-35alone for 12h.Conclusion This result sug-gests that NAC can attenuate calpain activity induced by Aβ25-35through protecting mitochondria.
Key words:N-acetyl-L-cysteine;Aβ25-35;calpain;H2O2;mitochondrial membrane potential;ATP
作者简介:黄天文(1978-),男,博士,副主任医师,研究方向:卒中和痴呆临床与基础,E-mail:huangtianwen2002@126.com;林智颖(1972-),男,博士,副教授,硕士生导师,研究方向:老年性痴呆基础和临床,通讯作者,E-mail:lzy8426@126.com
基金项目:国家自然科学基金资助项目(No 81100812);福建省自然科学基金资助项目(No 2013J01311);福建省医学创新课题(No 2012-CX-15)
收稿日期:2015-08-23,修回日期:2015-09-27
文献标志码:A
文章编号:1001-1978(2015)11-1505-05
doi:10.3969/j.issn.1001-1978.2015.11.007