基于氯离子传导的新型二次电池
2015-02-25赵相玉沈晓冬
赵相玉,沈晓冬
(南京工业大学材料科学与工程学院,江苏 南京 210009)
基于氯离子传导的新型二次电池
赵相玉,沈晓冬
(南京工业大学材料科学与工程学院,江苏 南京 210009)
摘要:二次电池的研究热点主要集中在基于阳离子传输的电化学体系上,如Li+、Na+、Mg2+等电池。氯离子电池是作者提出的一种基于阴离子传导的新型二次电池。正极材料为过渡族或部分主族的金属氯化物或金属氯氧化物,负极为碱金属、碱土金属或稀土金属,电解液为可传输氯离子的复合离子液体。其电极体系的理论能量密度高于当前锂离子电池体系,可达2 500 Wh/l;而且该体系可不用Li,以具有丰富储量的元素(如Mg,Ca,稀土等)作为负极材料。大多数过渡族的金属氯化物为路易斯酸,能够不同程度地和含有氯离子的路易斯碱发生反应,生成可溶于电解液中的络合离子。抑制金属氯化物的脱溶和开发新型高稳定性电极材料是实现氯离子电池应用的关键点之一。介绍了氯离子电池的概念、基本原理,阐述了金属氯(氧)化物/金属和多电子金属氯氧化物/镁电极体系。
关键词:二次电池;氯离子电池;金属氯化物;金属氯氧化物;电化学性能
1前言
二次电池作为电化学储能体系,在启动电源、便携式电子产品、电动工具以及新能源汽车等领域有着重要影响;并将为我国大力发展的风能、太阳能等可再生、间歇性能源的高效利用和存储提供强有力的支持。目前,二次电池的研究热点主要集中在基于阳离子传输的电化学体系上,如Li+、Na+、Mg2+等电池[1-7]。具有高能量密度、高倍率性能和环保的Li+电池在二次电源领域中发挥着越来越重要的作用。近来,因Na资源丰富,与锂离子具有类似嵌入化学特性的Na+电池得到了很多研究。Mg2+电池近年也是研究热点之一,同样是由于电极材料Mg的储量大。此外,Mg可直接用作Mg2+电池的负极材料[8-9],且具有高的体积能量密度。不断增长的新能源需求对二次电池在高能量密度、丰富的材料资源等方面提出了更高的要求。
金属氯化物/金属体系在发生氯离子的电化学转换时可带来大的自由能变化,从而产生较高的电动势。作者从阴离子传输方面提出了氯离子电池概念[10]。部分金属氯化物/金属体系的理论能量密度见图1。该体系的能量密度可达2 500 Wh/l,高于当前的Li+电池体系。并且氯离子电池体系可采用资源丰富的电极材料,其负极材料理论上可选择多种金属材料或相应的金属氯化物。因此,氯离子电池的研究具有重要意义。

图1 氯离子电池及锂离子电池的部分电化学对的能量密度Fig.1 Energy densities of some electrochemical couples in chloride ion batteries and lithium ion batteries
2氯离子电池基本原理
氯离子电池可在常温下运行,包含金属氯化物/金属电极体系以及能够传导氯离子的离子液体电解质,如图2所示。正极为过渡族或部分主族的金属氯化物,负极为碱金属(如Li,Na)、碱土金属(如Mg,Ca)或稀土金属(如La,Ce)。图2中的电池体系为充满态。也可制备金属/金属氯化物电极体系,即放电态的电池体系。电池体系的电化学反应如下:
正极:McCln↔Mc+nCl-
(1)
负极:Ma+mCl-↔MaClm
(2)
全电池:mMcCln+nMa↔mMc+nMaClm
(3)
Mc为正极的金属元素,Ma为负极的金属元素,m或n为氯离子的个数。

图2 氯离子电池金属氯化物/金属电极体系示意图Fig.2 Schematic illustration of the metal chloride/metal electrode system for chloride ion battery
具有高氯离子传导能力的电解液的开发也是氯离子电池研究的关键点之一。PbCl2,SnCl2和LaOCl等无机化合物仅在高温条件下有快速的氯离子传导能力[11-12]。立方CsSnCl3在100 ℃的氯离子电导可达1 mS·cm-1,但其电化学稳定性尚不清楚[11,13]。另外,含有氯离子液体和聚合物复合形成的聚合物电解质也具有阴离子传导能力[14-16],如聚二丙烯基二甲基氯化铵/四甲基氯化铵在25 ℃时的离子电导为0.22 mS·cm-1[15]。考虑到氯离子电池金属氯化物正极在发生相转变时会产生较大的体积变化,容易导致固态电解质机械破坏,从而中断电极的传质过程。采用液态电解质可实现电极和电解质之间更好的接触。阴离子为氯离子的咪唑、吡咯烷、哌啶、季胺盐等非质子离子液体具有高安全性、高氯离子传导能力和宽的电化学窗口,可作为氯离子电池电解液的氯源[17-20]。但大多数该类离子液体在常温下是固体,具有类似阳离子,而阴离子为BF4-,PF6-或 [N(CF3SO2)2]-的离子液体可用作相应的溶剂。
作者先期以CoCl2/Li,VCl3/Li,BiCl3/Li 等电极体系为研究对象,咪唑类复合离子液体为电解液,研究并证明了氯离子电池的基本原理[10]。如CoCl2正极的首次放电容量为80 mAh·g-1(理论容量的19.3%);而弱路易斯酸的BiCl3的首次放电容量达176.6 mAh·g-1(理论容量的69%),见图3。充放电和循环伏安的研究结果证明了该电极体系中可逆的电化学氧化还原反应。微结构表征证明了正极材料在放电过程中失去氯,而负极材料相应的获得了氯。XPS的研究结果更加直观地表明了基于氯离子传输的转换反应。
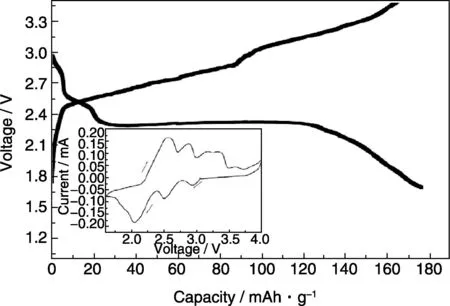
图3 BiCl3/Li电极体系在298 K时的充放电曲线及循环伏安图Fig.3 Charge-discharge and CV curves of the BiCl3/Li electrode system at 298 K
3金属氯氧化物/金属体系
大多数过渡族的金属氯化物为路易斯酸,能够不同程度地和含有氯离子的路易斯碱发生反应,生成可溶于电解液中的络合离子,反应式如下:
CoCl2+ 2Cl-→ CoCl42-
(4)
从而导致CoCl2的首次放电容量仅为理论容量的19.3%[10]。对此,作者提出了采用在很多有机溶剂中能够稳定存在、本身即可稳定存在于以离子液体为电解液的氯离子电池体系中的金属氯氧化物作为新型正极材料[21],以解决金属氯化物明显的脱溶问题以及开发新型稳定的电极材料。
含有氯元素的金属氯氧化物(如BiOCl、FeOCl、TiOCl、VOCl、VOCl2、SnOCl2等)中的金属阳离子被强路易斯碱的氧离子牢牢绑定[22-27];这类含氯的化合物具有层状结构(见图4),层间靠范德华力结合。以BiOCl为例,其层结构中的子段为Cl-Bi-O-Bi-Cl排列[28]。在氮气保护气氛下加热,BiOCl易于失去氯而转变为BiO[29]。金属氯氧化物/金属电极体系在发生氯离子电化学转换时可带来大的自由能变化,即产生高的电动势。如VOCl2/Li的电动势为2.78 V,理论能量密度为984.2 Wh·g-1,由图1可见,金属氯氧化物/金属体系从理论上能够作为氯离子电池电极体系的选择。所构建的新体系的电池反应如下:
mMcOCln+nMa↔mMcO+nMaClm
(5)
Mc为正极的金属元素,Ma为负极的金属元素,m或n为氯离子的个数。

图4 FeOCl结构示意图Fig.4 Schematic illustration of FeOCl structure
作者先期以BiOCl/Li和FeOCl/Li电极体系为研究对象,哌啶或季铵盐的复合离子液体为电解液,研究了金属氯氧化物作为氯离子电池正极材料的结构特性和电化学性能[21]。鉴于金属氯氧化物本身的化学稳定性,其电化学循环稳定性明显优于金属氯化物;如FeOCl电极的首次放电容量可达理论放电容量的65%,经前几次的容量衰减后,放电容量在30次内能够保持稳定,见图5。但所得容量仅为理论容量的24%,而且电极体系的充放电极化也较强。这可能是由于金属氯氧化物电极导电性较差和充放电过程中较大的体积变化导致的。和金属氯化物相比,金属氯氧化物在充放电过程中的体积变化小很多,但数值仍不低,如FeO 和FeOCl 之间的体积膨胀为141.7%。因此,获得具有高反应活性以及较大体积变化条件下的高电子、离子传输性的金属氯氧化物正极材料是实现正极高电化学性能的关键。

图5 FeOCl/Li电极体系的充放电曲线 Fig.5 Charge and discharge curves of the FeOCl/Lielectrode system
氯离子电池的一个重要优点是可以采用不同种的金属作为负极材料(如Mg,Li,La等)。综合考虑电极的容量、材料的安全性和元素储量,如Mg的理论体积容量为3 832 mAh·cm-3,显著高于Li(2 062 mAh·cm-3)和Na(1 136 mAh ·cm-3);Mg和Li,Na相比,具有更高的安全性,而且可发生多电子反应;加之Mg的高储量和我国丰富的高品位Mg资源,开发Mg系负极材料具有重要意义。
作者以BiOCl/Mg和FeOCl/Mg为研究对象,证明了采用Mg作为氯离子电池负极材料的可行性,见图6[30]。通过机械球磨和氢化物裂解法制备了Mg/C复合材料。针对Mg负极的研究表明,充放电测试、XRD和XPS等结果证明了在充放电过程中氯离子在Mg负极一侧的传输。此外,FeOCl的放电容量较以Li为负极时的放电容量有所下降,极化增大,循环稳定性较以Li为负极时的低很多。Mg负极在电池放电时,获得Cl并形成导电性差的MgCl2;在随后的充电过程中,MgCl2失去Cl转变为Mg。此外,在此相变过程中,会发生197.5%的体积膨胀或66.3%的体积收缩,显著高于Li与LiCl之间56.5%的体积膨胀或24.8%的体积收缩。因此,可以得出,获得具有高反应活性以及高体积变化条件下的高电子传输性的Mg负极材料是实现Mg负极高电化学性能的关键点之一。

图6 金属氯氧化物/镁电极体系示意图Fig.6 Schematic illustration of the metal oxychloride/Mg electrode system
多电子体系的正极VOCl2具有更高的能量密度,作者以多电子体系VOCl-Mg/MgCl2为研究对象,制备了VOCl/C正极材料,以Mg/MgCl2/C作负极材料,相当于VOCl2/Mg的中间放电态。实验证明了多电子金属氯氧化物作为氯离子电池正极材料的可行性[31]。VOClx正极材料在此电极体系中的首次电化学反应式如下:
充电:2VOCl + MgCl2→ 2VOCl2+ Mg
(5)
放电:2VOCl2+ Mg → 2VOCl + MgCl2
(6)
2VOCl + Mg → 2VO + MgCl2
(7)
4结语
氯离子电池体系的高能量密度、安全、环保、低成本等特性符合当前二次电池发展的重要方向。目前,氯离子电池主要包括金属氯化物/金属和金属氯氧化物/金属电极体系。
金属氯化物/金属体系具有较高的理论能量密度,但金属氯化物正极在液态离子液体电解液中易脱溶,开发新型电解质(如聚合物电解质)可能会有效抑制脱溶问题。与金属氯化物相比,金属氯氧化物正极具有高的稳定性。此外,多电子的金属氯氧化物正极具有高的理论能量密度,但初步研究中,其放电性能与理论性能有很大差距。
Mg负极具有高的体积能量密度,但在充放电过程中会产生较大的体积变化,导致电池循环稳定性衰减严重。因此,提高Mg负极的机械稳定性和高电子、离子传输性,是有效实现以Mg为负极的氯离子电池高循环稳定性的关键。
参考文献References
[1]Lee J,Urban A,Li X,etal. Unlocking the Potential of Cation-Disordered Oxides for Rechargeable Lithium Batteries [J].Science,2014,343:519-522.
[2]Zheng G, Lee S W, Liang Z,etal. Interconnected Hollow Carbon Nanospheres for Stable Lithium Metal Anodes [J].NatureNanotechnology,2014,9:618-623.
[3]Liang X, Hart C, Pang Q,etal. A Highly Efficient Polysulfide Mediator for Lithium-Sulfur Batteries [J].NatureCommunications,2015,6:5 682.
[4]Yabuuchi N,Kubota K,Dahbi M,etal. Research Development on Sodium-Ion Batteries [J].ChemicalReviews,2014,114:11 636-11 682.
[5]Wen Y,He K,Zhu Y,etal. Expanded Graphite as Superior Anode for Sodium-Ion Batteries [J].NatureCommunications,2014, 5:4 033.
[6]Zhao Karger Z,Zhao X Y, Wang D,etal. Performance Improvement of Magnesium Sulfur Batteries with Modified Non-Nucleophilic Electrolytes [J].AdvancedEnergyMaterials,2015,(3)5.DOI:10.1002/aenm.201401155.
[7]Carter T J,Mohtadi R,Arthur T S,etal. Boron Clusters as Highly Stable Magnesium-Battery Electrolytes [J].AngewandtChemieInternationalEdition,2014,53:3 173-3 177.
[8]Matsui M. Study on Electrochemically Deposited Mg Metal [J].JournalofPowerSources,2011,196:7 048-7 055.
[9]Jäckle M,Groß A. Microscopic Properties of Lithium,Sodium, and Magnesium Battery Anode Materials Related to Possible Dendrite Growth [J].JournalofChemicalPhysics, 2014, 141:174 710.
[10]Zhao X Y,Ren S,Bruns M,etal. Chloride Ion Battery: A New Member in the Rechargeable Family [J].JournalofPowerSources,2014,245:706-711.
[11]Murin I V,Glumov O V,Mel’nikova N A. Solid Electrolytes with Predominant Chloride Conductivity [J].RussianJournalofElectrochemistry,2009,45:411-416.
[12]Imanaka N,Okamoto K,Adachi G. Water-Insoluble Lanthanum Oxychloride-Based Solid Electrolytes with Ultra-High Chloride Ion Conductivity [J].AngewandteChemie,2002,41(20):3 890-3 892.
[13]Yamada K,Kuranaga Y,Ueda K,etal. Phase Transition and Electric Conductivity ofASnCl3(A=Cs and CH3NH3) [J].BulletinoftheChemicalSocietyJapan,1998,71:127-134.
[14]Hardy L C,Shriver D F. Chloride Ion Conductivity in a Plasticized Quaternary Ammonium Polymer [J].Macromolecules, 1984,17:975-977.
[15]Huang P C, Reichert K H.Polymerization of Diallyldimethylammonium Chloride in Inverse Emulsion,II. Molecular Weight and Electrical Conductivity of the Polymer & Dagger[J].DieAngewandteMakromolekulareChemie,1989,165:1-7.
[16]Ogata N. Ion-Conducting Polymers [J].JournalofMacromolecularSciencePartC-PolymerReviews,2002,C42: 399-439.
[17]Ohno H.ElectrochemicalAspectsofIonicLiquids[M]. New Jersey:John Wiley & Sons,Inc.,2005.
[18]Plechkove N V,Seddon K R. Applications of Ionic Liquids in the Chemical Industry [J].ChemicalSocietyReview,2008,37:123-150.
[19]Simka W,Puszczyk D,Nawrat G. Electrodeposition of Metals from Non-Aqueous Solutions [J].ElectrochimicaActa,2009,54:5 307-5 319.
[20]Lane G H.Electrochemical Reduction Mechanisms and Stabilities of Some Cation Types Used in Ionic Liquids and Other Organic Salts [J].ElectrochimicaActa,2012,83:513-528.
[21]Zhao X Y,Zhao-Karger Z,Wang D,etal. Metal Oxychlorides as Cathode Materials for Chloride Ion Batteries [J].AngewandteChemie,2013,52:13 621-13 624
[22]Armelao L,Bottaro G,Maccato C,etal. Bismuth Oxychloride Nanoflakes:Interplay between Composition-Structure and Optical Properties [J].DaltonTransations,2012,41: 5 480-5 485.
[23]Lind M D. Refinement of the Crystal Structure of Iron Oxychloride [J].ActaCrystalB,1970,26:1 058-1 062.
[24]Shaz M,Smaalen S V,Palatinus L,etal. Spin-Peierls Transition in TiOCl [J].PhysicalReviewB,2005,71:100 405.
[25]Oppermannv H. Untersuchungen an Vanadinoxidchloriden und Vanadinchloriden. I. Gleichgewichte mit VOCl3,VO2Cl und VOCl2[J].ZeitschriftfürAnorganischeundAllgemeineChemie, 1967,351(3-4):113-126.
[26]Dehnicke K. Zinn(IV)-Oxidchlorid,SnOCl2[J].ZeitschriftfürAnorganischeundAllgemeineChemie,1961,308(1-6):72-78.
[27]Brown I D. What Factors Determine Cation Coordination Numbers[J].ActaCrystalB,1988,44:545-553.
[28]Peng H L,Chan C K,Meister S,etal. Shape Evolution of Layer-Structured Bismuth Oxychloride Nanostructures Via Low-Temperature Chemical vapor Transport [J].ChemistryofMaterials,2009,21:247-252.
[29]Song J M,Mao C J,Niu H L,etal. Hierarchical Structured Bismuth Oxychlorides: Self-Assembly from Nanoplates to Nanoflowers via a Solvothermal Route and their Photocatalytic Properties [J].CrystEngComm,2010,12:3 875-3 881.
[30]Zhao X Y,Li Q,Zhao-Karger Z,etal. Magnesium Anode for Chloride Ion Batteries [J].ACSAppliedMaterials&Interfaces,2014,6:10 997-11 000.
[31]Gao P,Zhao-Karger Z,Diemant T,etal.Vanadium Oxychloride/Magnesium Electrode Systems for Chloride Ion Batteries [J].ACSAppliedMaterials&Interfaces,2014,6:22 430-22 435.
(编辑王方)


特约撰稿人杨上峰
杨上峰:男,1975年生,教授,博士生导师。中国科学技术大学材料科学与工程系执行主任。中国科学院“百人计划”入选者并获结题评估“优秀”。2003年在香港科技大学获理学博士学位。2004年2月~2007年12月获得洪堡基金会的资助在德国莱布尼兹固体材料研究所工作,后担任Guest Scientist代理课题组组长。2007年12月加入中国科学技术大学材料科学与工程系和合肥微尺度物质科学国家实验室,任双聘教授,2014年10月起任材料科学与工程系执行主任。2008年入选中国科学院“百人计划”入选者,2009年5月获择优支持,2013年结题评估被评为"优秀"。长期从事碳纳米材料的研究,目前的主要研究方向是新型碳纳米材料的合成及在新型太阳能电池中的应用。迄今为止已在包括ChemRev,AngewChemIntEd,JAmChemSoc,PhysRevLett.等期刊上发表论文140余篇,论文被SCI他引2 100余次。获2010年度中国科学技术大学校友基金会“优秀青年教师奖”。2011年入选安徽省首批“百人计划”,获“安徽特聘专家”称号。

特约撰稿人赵相玉
赵相玉:男,1985年生,博士,副研究员。
2005年7月攻读材料学硕博连读研究生。主要从事和储氢材料与二次电池相关的制备、结构和性能研究工作,在其基础理论和应用研究两方面具有较好的经验积累。2010年6月获南京工业大学工学博士学位,且博士学位论文《A2B型钛基储氢合金的制备与电化学性能研究》荣获“2010年江苏省优秀博士论文”。2010年7月留校任教。2011年10月获德国卡尔斯鲁厄理工大学(KIT)的“Guest Scientist Fellowship”资助,以访问学者身份于2012.1~2013.12在KIT北校区(隶属德国亥姆霍兹联合会)的纳米技术研究所(INT)工作。担任全国材料新技术发展研究会理事、国际期刊FrontiersinEnergyStorage评审编辑、JournalofNanomaterials专刊编辑、中国化学会会员和美国电化学会会员。已在国内外期刊发表论文53篇(SCI收录41篇),其中以第一作者在AngewandteChemieInternationalEdition、Energy&EnvironmentalScience等上发表论文23篇(累积影响因子98.4,他引308次)。申请中国发明专利6项(授权4项)和欧洲专利(公开)、美国专利(公开)各1项。
Novel Secondary Battery Based on Chloride Ion Transfer
ZHAO Xiangyu,SHEN Xiaodong
(College of Materials Science and Engineering,Nanjing Tech University,Nanjing 210009,China)
Abstract:Hot topics in the field of secondary batteries are focused on the electrochemical systems based on cation transfer,such as LIB,NIB and MB. Chloride ion battery (CIB) proposed by the author is a kind of novel battery based on chloride ion transfer. The corresponding cathode materials are metal chlorides with the metals listed in transition group or part of main group;the anode materials are alkali metals,alkaline-earth metals or rare-earth metals;the electrolyte is the ionic liquid composite allowing chloride ion transfer. CIB shows theoretical energy densities which are above those of the current lithium ion battery and up to 2 500 Wh/l. The use of Li as anode is unnecessary and various abundant materials such as Mg,Ca or rare-earth metals could be used as anode. Most transition-metal chlorides are Lewis acids,which can react with a Lewis base that contains chloride ions,resulting in the formation of soluble complex ions. A key challenge to achieve application of CIB is to suppress this dissolution and develop new electrode materials with high stability. Herein,we report the concept and the principles of CIB. Metal chloride/metal,metal oxychloride/metal and multi-electron metal oxychloride/magnesium electrode systems are elaborated.
Key words:secondary battery;chloride ion battery;metal chloride;metal oxychloride;electrochemical performance
中图分类号:TQ152
文献标识码:A
文章编号:1674-3962 (2015)11-0847-05
青年园地
收稿日期:2015-07-15
基金项目:国家自然科学基金资助项目(U1407106);江苏高校优势学科建设工程资助项目
第一作者:赵相玉,男,1985年生,副研究员,Email:
xiangyu.zhao@njtech.edu.cn
DOI:10.7502/j.issn.1674-3962.2015.11.07
