右美托咪定在皮层脑电图监测下癫疒间病灶切除术中的应用
2015-02-23吴辉辉
沈 洁,吴辉辉
右美托咪定在皮层脑电图监测下癫疒间病灶切除术中的应用
沈 洁1*,吴辉辉2
目的 探讨应用右美托咪定(Dexmedetomidine,DEX)作为麻醉辅助用药对术中皮层脑电图监测下行癫疒间病灶切除术中的全凭静脉麻醉的可行性与优越性。方法 因顽固性癫疒间择期开颅行病灶切除术患者40例,随机分为DEX组(D组)和生理盐水对照组(NS组),每组20例。D组麻醉诱导前输注负荷量DEX 0.4 μg/kg,之后持续泵注0.25 μg/(kg·h)直至病灶切除,硬脑膜缝合结束;NS组给予等量生理盐水。两组患者均采用舒芬太尼、得普利麻(丙泊酚注射液)、罗库溴胺全麻诱导,丙泊酚靶控输注2.0~2.5 μg/mL、瑞芬太尼3~6 μg/(kg·h)、顺苯磺阿曲库胺单次静脉注射维持麻醉。切开硬脑膜时停止瑞芬太尼输注,行ECOG监测前,将丙泊酚靶浓度设为1.6 μg/mL,ECOG监测完成后各药物恢复之前维持剂量。记录插管、切皮、拔管等各时间点的血压和心率;记录患者丙泊酚和瑞芬太尼的用量、苏醒时间、拔管时间、围术期不良反应例数;记录术中减浅麻醉至ECOG定位明确所需时间以及ECOG监测过程中爆发抑制发生例数,选择基线稳定、无干扰的10 s描记图为统计对象,计算各脑电波形的频率和波幅。结果 D组心率较入室基础值明显降低(P<0.05),收缩压、舒张压、心率变化幅度较NS组减少(P<0.05);D组术中丙泊酚和瑞芬太尼的用量少于NS组(P<0.05),两组患者苏醒时间和拔管时间比较差异无统计学意义(P>0.05),D组拔管剧烈呛咳和躁动发生例数较NS组明显减少(P<0.05);术中ECOG监测显示,两组患者棘波频率和波幅比较差异无统计学意义,D组背景波频率和波幅较NS组略有下降,但差异无统计学意义(P>0.05)。两组患者的爆发抑制发生例数比较差异无统计学意义(P>0.05),NS组的调整时间较D组明显延长(P<0.05)。结论 两组的麻醉方法应用于癫疒间外科手术对术中皮层脑电图监测影响均较小,患者可顺利完成手术,但右美托咪定复合丙泊酚、瑞芬太尼全凭静脉麻醉可在较短时间内完成脑神经功能的监测,确定癫疒间病灶,并且维持麻醉诱导插管和拔管时血液动力学的稳定,减少全麻药的用量,降低全麻恢复期寒战、躁动等不良反应,为临床癫疒间患者手术麻醉提供了更为平稳的麻醉方式。
右美托咪定;癫疒间;皮层脑电图;全凭静脉麻醉
0 引言
癫疒间是一种常见的神经系统疾病,我国癫疒间的患病率约为5‰,其中约20%~30%的患者为药物不能控制的顽固性癫疒间[1]。手术是治疗难治性癫疒间的重要手段,其成功与否关键在于术中癫疒间病灶监测定位是否准确。近年来随着功能神经外科技术的发展,术中皮层脑电图(Electrocorticogram,ECOG)监测下癫疒间病灶切除术越来越多地用于顽固性癫疒间手术,术后患者的病情得到完全控制或症状显著改善[2-3]。由于现有的全麻药物在癫疒间手术麻醉中对皮层脑电图会产生不同程度的影响[4-6],给术中行 ECOG 监测确定致疒间灶的部位和范围带来了困难,直接影响了手术治疗的效果,同时也极大地限制了这种治疗方法在临床上的广泛开展。所以,如何为此类手术提供满意的麻醉方案,在选择合适的麻醉药物保证患者适宜麻醉深度的同时,既不抑制病理性棘波,又不诱发非病理性的棘波样异常波,使术中皮层脑电图的监测较快而又准确定位到病灶,对围术期的麻醉管理提出了新的要求,也成为麻醉医生急需解决的课题。
右美托咪定(Dexmedetomidine,DEX)是一种高选择性的α2受体激动剂,其通过兴奋脑干蓝斑核(Locus Coeruleus,LC)内的α2肾上腺受体,产生剂量依赖性的镇静、催眠和抗焦虑作用,是可以广泛应用的神经外科麻醉辅助药。DEX的镇静效果类似于自然睡眠,对功能神经外科手术中的电生理学监测影响较小[7]。这个独特的性质使其成为术中需要监测脑电图的神经功能性手术具有良好应用前景的一种镇静药。本研究观察DEX复合全凭静脉和单纯的全凭静脉麻醉在术中皮层脑电图监测下癫疒间病灶切除术中的效果,探讨右美托咪定应用于癫疒间外科手术麻醉的可行性与优越性。
1 资料与方法
1.1 一般资料 选择2012年4月至2013年4月在我院神经外科住院,因顽固性癫疒间择期开颅行病灶切除术患者40例,男23例,女17例,年龄18~55岁,体重45~75kg,ASAⅠ~Ⅱ级。术前经脑电图、MRI确诊,因长期、系统服用抗癫疒间药物均不能有效控制癫疒间发作入院。病变部位涉及颞、额、顶枕等多个不同位置的脑功能区。术前检查心肺功能正常,无肝肾功能损害和其他严重的并发症。40例患者随机分为2组:右美托咪定组(D组)、生理盐水对照组(NS组),每组20例。该研究已通过我院伦理委员会的审批。
1.2 麻醉方法 术前所有患者均不使用镇静药物,且避免诱发大发作的各种因素,如恐慌、焦虑、激动、失眠或劳累等,抗癫疒间药物可服用至手术当日。入室后连接监护仪常规监测血压、心电图、脉搏血氧。局麻下桡动脉穿刺,监测直接动脉血压。D组麻醉诱导前输注负荷量DEX 0.4 μg/kg(输注时间10 min),之后持续泵注0.25 μg/(kg·h)直至病灶切除硬脑膜缝合结束;NS组予等量生理盐水。两组患者均采用舒芬太尼0.3 μg/kg、得普利麻(丙泊酚注射液) TCI血药浓度4.5 μg/mL、罗库溴胺0.8 mg/kg全麻诱导,可视喉镜行气管插管,连接麻醉机机械通气,维持PETCO228~32 mmHg。丙泊酚靶控输注2.0~2.5 μg/mL,瑞芬太尼3~6 μg/(kg·h)静脉输注,顺苯磺阿曲库胺0.02~0.05 mg/kg单次静脉注射维持麻醉。切开硬脑膜时停止瑞芬太尼输注,行ECOG监测前,将丙泊酚靶浓度设为1.6 μg/mL,ECOG监测完成后各药物恢复之前维持剂量。手术结束后,停止所有药物,待患者自主呼吸恢复,静注新斯的明、阿托品拮抗肌松残余作用,吞咽呛咳反射恢复、吸空气 SpO2维持98%以上拔除气管导管,生命体征平稳送入麻醉恢复室。
1.3 观察指标
1.3.1 记录各组患者麻醉前(T0)、插管前(即负荷量输注完毕,T1)、插管即刻(T2)、切皮前(T3)、切皮(T4)、拔管前(T5)、拔管(T6)各时间点的血压、心率和脉搏血氧饱和度。
1.3.2 记录丙泊酚和瑞芬太尼的用量、苏醒时间(缝皮完毕停药至患者苏醒)、拔管时间(停药至拔出气管导管时间)及围术期不良反应(拔管剧烈呛咳、躁动、恶心呕吐、呼吸抑制、术中知晓)的发生例数。
1.3.3 ECOG监测 术中开始进行ECOG监测时选择基线稳定、无干扰的10 s描记图,由专业的脑电生理专家计算各脑电波形的频率和波幅;记录术中调节丙泊酚靶浓度至ECOG出现明确棘波所需时间(调整时间)以及监测过程中爆发抑制发生例数。
2 结果
2.1 患者一般资料比较 两组患者性别、年龄、体重、ASA分级、病灶部位及手术时间比较差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料及手术时间比较(例)
2.2 两组血流动力学比较 两组患者入室后麻醉前收缩压(SBP)、舒张压(DBP)和心率(HR)的基础值比较差异无统计学意义(P>0.05),D组患者输注完毕负荷剂量右美托咪定10 min后,心率较入室基础值明显降低,差异有统计学意义(P<0.05),见表2。
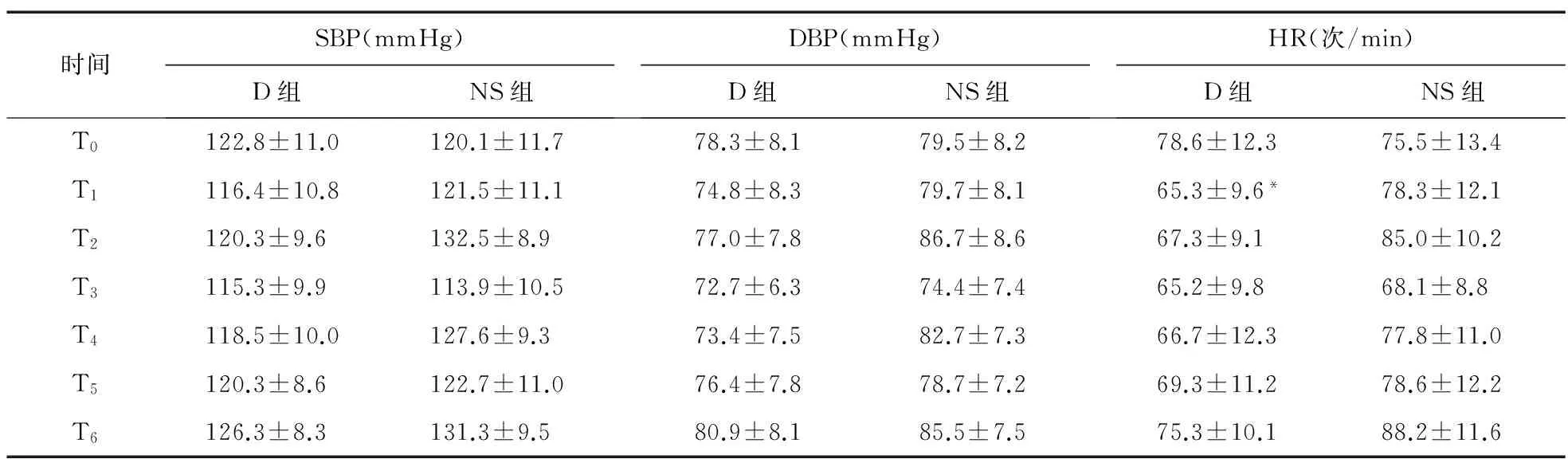
表2 两组各时间点血压、心率比较(n=20)
注:*与T0比较,P<0.05
2.3 两组患者丙泊酚和瑞芬太尼用量、苏醒时间、拔管时间及围术期不良反应比较 D组全麻药丙泊酚、瑞芬太尼的用量少于NS组,两组比较差异有统计学意义(P<0.05),见表3。两组患者苏醒、拔管时间比较差异无统计学意义(P>0.05),见表4。D组拔管剧烈呛咳和躁动发生例数少于NS组,差异有统计学意义(P<0.05),两组均未发生术中知晓,见表5。

表3 两组丙泊酚、瑞芬太尼用量比较
注:#与NS组比较,P<0.05

表4 两组患者苏醒、拔管时间比较(min)

表5 两组围术期不良反应比较(例)
注:#与NS组比较,P<0.05
2.4 两组神经电生理学资料分析及药物调整时间比较 术前NREM睡眠时相EEG监测两组患者棘波、背景波的频率和波幅大小,两组比较差异均无统计学意义(P>0.05)。术中ECOG监测:两组患者棘波频率、波幅比较差异无统计学意义(P>0.05);D组背景波频率、波幅较NS组略有下降,但差异无统计学意义(P>0.05);两组患者的爆发抑制发生例数比较差异无统计学意义(D组:2例,NS组:1例,P>0.05);对照组的调整时间比右美组明显延长(P<0.05)。见表6。
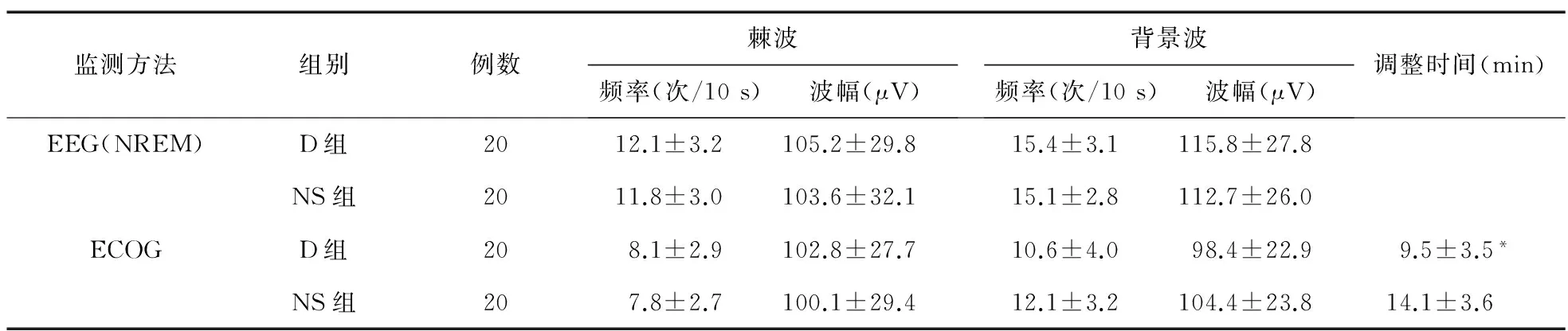
表6 两组神经电生理学资料比较
注:*与NS组比较,P<0.05
3 讨论
随着功能神经外科技术的发展,术中ECOG监测下癫疒间病灶切除术越来越多地用于治疗顽固性癫疒间,其中,理想的麻醉管理要求同时满足功能神经外科手术电生理监测和麻醉本身的多重要求。而临床上常用的吸入麻醉药和镇静镇痛药均无法满足上述要求,因此,目前国内外功能神经外科麻醉多采用全凭静脉麻醉或清醒开颅手术。但癫疒间患者不适合清醒开颅,而全凭静脉麻醉在术中时常由于用药量的个体差异或药量较大影响术中脑电图监测。最近,研究者对右美托咪定在功能神经外科的独特应用进行研究,已经有一些关于DEX应用于功能神经外科的临床病例报道,但数量不多,并且其镇静的最佳剂量仍不明确。有报道,癫疒间患者术前非麻醉状态下EEG监测过程中应用DEX,对癫疒间棘波的频率和波幅不会产生影响[8-10]。Bekker等[11]首次报道DEX用于开颅左颞肿瘤切除术期间语言区定位,顺利完成语言定位及肿瘤切除过程,血流动力学稳定。Ard等[12]首次报道将DEX用于儿童开颅术中唤醒,成功地进行了皮质语言区的定位和癫疒间病灶的切除。Souter 等[13]成功将DEX用于6例癫疒间患者的麻醉,术中顺利进行皮层脑电图的记录和神经电生理的监测,患者接受持续输注右美托咪定0.2~0.7 μg/(kg·h)复合局部麻醉,结果镇静满意。因此,右美托咪定可以用于需要进行精确病灶定位的癫疒间患者。本研究采用右美托咪定复合低于常规剂量的瑞芬太尼和丙泊酚静脉麻醉,观察对术中脑电图、患者循环和苏醒期的影响,探讨合适的右美托咪定用量及其合理性。
右美托咪定作用的主要部位不在大脑皮质,不涉及其他全麻药作用的部位,因此产生一种类似于自然睡眠的镇静状态,后者可以被刺激或语言所唤醒,不干扰大脑正常电脉冲活动,不会影响功能神经外科手术中的电生理学监测[14-15]。
有研究显示,右美托咪定用于术前对体表脑电图没有明显影响[16]。本研究应用负荷量DEX后持续泵注维持量,同时复合丙泊酚、瑞芬太尼,而丙泊酚和瑞芬太尼的用量可以减少,不影响术中脑电图监测。有研究表明,应用右美托咪定后,可减少丙泊酚的诱导和维持量,使其半数有效浓度降低40%[17]。虽然本研究术中没有进行麻醉深度监测(开颅手术),但术后没有发生术中知晓病例。本研究采用右美托咪定的负荷剂量为0.4 μg/kg,之后持续泵注0.25 μg/(kg·h),同时复合丙泊酚和瑞芬太尼,对照组用等量生理盐水,结果显示,DEX组在麻醉诱导插管和拔管时的血液动力学变化比对照组平稳,且防止了苏醒期剧烈反应、躁动的发生,而两组苏醒时间和拔管时间比较差异无统计学意义,这与DEX的抗交感神经作用及较好的镇静作用有关。而由于手术进行神经定位找到病灶切除后取出停止输注右美托咪定,到手术结束基本为100 min,DEX的消除半衰期为120 min,这时进行苏醒既有一定的镇静作用,防止了苏醒期躁动等不良反应,同时由于应用右美托咪定减少了术中全麻药得普利麻和瑞芬太尼的用量,而右美托咪定应用的是临床常用量的较小剂量,在手术结束时已接近其半衰期,使得苏醒时间和拔管时间与对照组比较无明显延长;两组虽然都顺利完成了术中皮层脑电图的神经定位,但从调整药物浓度到不影响术中皮层脑电图监测的时间看,DEX组的调整时间较对照组明显缩短,且没有影响皮层脑电图的神经定位。这可能与DEX产生的镇静状态类似于非快速动眼睡眠时相,背景波快波受到一定程度的抑制,慢波活性增强,更有利于棘波的辨别有关[18]。而对照组术中只应用丙泊酚和瑞芬太尼,为了维持一定的麻醉深度,采用常规剂量的低值,即使这样,在皮层脑电图的神经定位初期总有一些干预波,逐渐减少麻醉药浓度,直到不影响术中皮层脑电图监测时,维持一定时间至找到病灶为止,因此对照组的调整时间较DEX组长,也说明传统的静脉麻醉药对皮层脑电图的监测有一定影响。也有学者在对不合作癫疒间患儿的EEG监测过程中应用DEX作为镇静药物,得出了同样的结论[16]。
同时,本研究比较了两组麻醉诱导插管和拔管时的血压、心率的变化,结果显示,DEX组血压和心率波动明显小于对照组,这是由于DEX具有抗交感作用,可维持血液动力学稳定,其作为全身麻醉的辅助用药,可减少全麻用药量,减少插管、拔管时的应激反应,同时降低全麻恢复期寒战、谵妄等不良反应的发生率。另外,DEX的镇痛作用不是剂量依赖性的,在0.5 μg/kg时可达到明显的封顶效应,目前认为其负荷剂量1 μg/kg后维持0.2~0.7 μg/(kg·h),可达到深度镇静(Ramsay镇静评分>3或2[19])。因此,本研究采用DEX负荷剂量0.4 μg/kg,维持泵注0.25 μg/(kg·h)。另有研究发现,颞叶癫疒间患者病灶切除术中吸入浓度为2.5%的七氟醚,同时静脉输注DEX使血药浓度在0.48~1.6 ng/mL时,ECOG背景波受到明显抑制,但是并未影响棘波的活性[20]。本研究结果表明,癫疒间病灶切除术全凭静脉麻醉过程中应用DEX,ECOG监测提示背景波有轻微抑制,但是并不影响棘波的活性。术中发生爆发抑制的患者在麻醉减浅足够充分的时间后都能够成功定位癫疒间病灶,同时患者并没有意识及返醒。
总之,右美托咪定复合低于常规剂量的丙泊酚和瑞芬太尼进行癫疒间病灶切除术对术中皮层脑电图棘波监测影响较小,通过调整丙泊酚和瑞芬太尼的用量可以在较短时间内完成脑神经功能的监测,确定癫疒间病灶,并且保持麻醉诱导插管和拔管时血液动力学的稳定,减少了全麻药用量,减少全麻恢复期寒战、谵妄等不良反应,为临床癫疒间患者手术麻醉提供了较好的麻醉方式,但有关右美托咪定联合应用不同麻醉药的有效性和安全性及对皮层脑电图影响的剂量效应需要进一步探讨。
[1] 李云林,栾国明.功能区难治性癫痛的外科治疗进展[J].现代神经疾病杂志,2002,2(4):237-239.
[2] 蔡立新,李勇杰.术中皮层脑电图监测在癫疒间外科中的应用[J].立体定向和功能性神经外科杂志,2007,20(5):306-309.
[3] Wasterlain CG,Stohr T,Matagne A.The acute and chronic effects of the novel anticonvulsant lacosamide in an experimental model of status epilepticus[J].Epilepsy Res,2011,94:10-17.
[4] 田肇隆,许亚超,王天龙.癫疒间外科手术麻醉进展[J].中国现代神经疾病杂志,2010,10(4):426-429.
[5] Gumus H,Bayram AK,Poyrazoglu HG,et al.Comparison of effects of different dexmedetomidine and chloral hydrate doses used in sedation on electroencephalography in pediatric patients[J].J Child Neurol,2014,8(2):1-6.
[6] Aksu R,Kumandas S,Akin A,et al.The comparison of the effects of dexmedetomidine and midazolam sedation on electroencephalography in pediatric patients with febrile convulsion[J].Paediatr Anaesth,2011,21(4):373-378.
[7] Chaitanya G,Arivazhagan A,Sinha S,et al.Dexmedetomidine anesthesia enhances spike generation during intra-operative electrocorticography:A promising adjunct for epilepsy surgery[J].Epilepsy Research,2015,109:65-71.
[8] 许挺,李民.右美托咪定在功能神经外科手术麻醉中的应用[J].中国新药杂志,2010,19(13):1128-1130.
[9] Chaitanya G,Arivazhagan A,Sinha S,et al.Hemodynamic effects of dexmedetomidine during intra-operative electrocorticography for epilepsy surgery[J].Neurosci Rural Pract,2014,5(Suppl 1):S17-S21.
[10]Chrysostomou C,Schulman SR,Herrera Castellanos M,et al.A phase II/III,multicenter,safety,efficacy,and pharmacokinetic study of dexmedetomidine in preterm and term neonates[J].Pediatr,2014,164(2):276-282.
[11]Bekker A,Kaufman B,Samir H,et al.The use of dexmedetomidine infusion for awake Craniotomy[J].Anesth Analg,2001,92:1251-1253.
[12]Ard J,Doyle W,Bekker A.Awake craniotomy with dexmedetomidine in pediatric patients[J].J Neurosurg Anesthesiol,2003,15:263-266.
[13]Souter MJ,Rozet I,Ojemonn JG,et al.Dexmedetomidine sedation during awake craniotomy for seizure resection:effects on electrocorgraphy[J].J Neurosurg Anesthesiol,2007,19:38-44.
[14]张清,陈永强.右美托咪定的临床应用进展[J].医学综述,2011,3(17):434-437.
[15]李志鹏,柳垂亮.右美托咪定的临床应用进展[J].实用医学杂志,2013,29(19):3254-3256.
[16]Mason KP,O′Mahony E,Zurakowski D,et al.Effects of dexmedetomidine sedation on the EEG in children[J].Paediatr Anaesth,2009,19(12):1175-1183.
[17]Chiu KM,Lin TY,Lu CW,et al.Inhibitory effect of glutamate release from rat cerebrocortical nerve terminals by alpha2-adrenoceptor agonist dexmedetomidine[J].Eur J Pharmaco,2011,670:137-147.
[18]Talke P,Stapelfeldt C,Garcia P.Dexmedetomidine does not reduce epileptiform discharges in adults with epilepsy[J].Neurosurg Anesthesiol,2007,19(3):195-199.
[19]Rozet I.Anesthesia for functional neurosurgery:the role of dexmedetomidine[J].Curr Opin Anaesthesiol,2008,21(5):537-543.
[20]Oda Y,Toriyama S,Tanaka K,et al.The effect of dexmedetomidine on electrocorticography in patients with temporal lobe epilepsy under sevoflurane anesthesia[J].Anesth Analg,2007,105(5):1272-1277.
Application of dexmedetomidine in the anesthetic management of epilepsy resection under electrocorticography monitor
SHEN Jie1*,WU Hui-hui2
(1.Department of Anesthesiology,Shengjing Hospital of China Medical University,Shenyang 110004,China;2.Departmnet of Anesthesiology,The Sixth People′s Hospital of Shanghai,Shanghai 310000,China)
Objective To observe the practicability and superiority of the clinical application of dexmedetomidine (DEX) in total intravenous anesthesia during epilepsy resection under electrocorticography monitor.Methods Forty obstinate epilepsy patients expected for operation(ASA Ⅰ~Ⅱ) were randomly divided into 2 groups with 20 cases in each group.In group D,a loading dose of 0.4 μg/kg was given,followed by 0.25 μg/(kg·h)DEX maintained until the incision of epilepsy foci.In group NS,0.9% normal saline was given as control.In both groups,anesthesia was induced with sufentanyl,propofol and rocuronium,and it was maintained with TCI of propofol 2.0~2.5 μg/mL,remifentanil 3~6 μg/(kg·h)and cisatracurium.When the dura mater was cut,remifentanil was stopped.Before the electrocorticogram (ECOG)was monitored,the targeted concentration of propofol was set at 1.6 μg/mL until the location of epilepsy foci.The SBP,DBP and HR were continuously recorded at the time points of intubation,skin incision and extubation.The dosages of propofol and remifentanil,awake time,time of extubation and adverse reaction were recorded.The time of location of epilepsy loci and number of burst suppression were also recorded.The 10 s scanning maps without interference were chosen to calculate the frequency and amplitude of spine by electrophysiology expert.Results HR in group D was lower than the basic line (P<0.05) and changes in SBP,DBP and HR in group D were less than those of group NS (P<0.05).The dosages of propofol and remifentanil in group D were lower than those of group NS (P<0.05).There was no significant difference in the awake time and extubation time between the two groups (P>0.05).The number of cases with severe cough,agitation in group D was lower than that of group NS (P<0.05).There was no significant difference in the frequency and amplitude of spine and the number of burst suppression between the two groups (P>0.05).The adjusting time in group NS was longer than that of group D (P<0.05).Conclusion The anesthetic methods of the two groups can offer clinical anesthesia for epilepsy operation under electrocorticography monitor.The time of location of epilepsy loci of patients anesthetized with dexmedetomidine combined with propofol and remifentanil was shorter than those of patients anesthetized with conventional anesthesia,and the dosages of propofol and remifentanil decreased significantly with more stable perioperative hemodynamics and lower incidence of cough shivery and agitation.It can offer a better manner for clinical anesthesia of epilepsy operation under electrocorticography monitor.
Dexmedetomidine;Epilepsy;Electrocorticography;Total intravenous anesthesia
2014-11-12
1.中国医科大学附属盛京医院麻醉科,沈阳 110004;2.上海市第六人民医院麻醉科,上海 310000
辽宁省科学技术项目(2013225049)
10.14053/j.cnki.ppcr.201508010
*通信作者
