外泌体减轻β淀粉样蛋白治疗阿尔茨海默病模型鼠的初步研究
2015-02-23吴焕成梁海乾孙洪涛
吴焕成,梁海乾,孙洪涛
·论著·
外泌体减轻β淀粉样蛋白治疗阿尔茨海默病模型鼠的初步研究
吴焕成1,2,梁海乾1,孙洪涛1
目的 研究N2a细胞分泌的外泌体对阿尔茨海默病(AD)模型小鼠β淀粉样蛋白(Aβ)浓度及斑块聚集的抑制作用,以期为临床治疗AD提供一种新的途径。方法 将多步离心提取的外泌体持续注入表达β淀粉样前体蛋白(APP)的小鼠脑内,一段时间后检测Aβ浓度、Aβ老年斑块的形成以及APP小鼠的突触活性。结果 经过持续外泌体注射的APP小鼠,Aβ浓度显著降低(P<0.05),Aβ斑块的形成也显著降低(P<0.05),而突触灵活性显著提高(P<0.05)。结论 N2a细胞分泌的外泌体对APP小鼠Aβ的表达有显著抑制作用。
外泌体;β淀粉样蛋白;阿尔茨海默氏病
0 引言
阿尔茨海默病(Alzheimer′s disease,AD)是一种以记忆力降低、认知功能障碍、丧失生活自理能力和社会活动能力为特征的老年性疾病[1]。主要由于β淀粉样蛋白(β-amyloid,Aβ)在脑中积聚形成老年斑块而导致[2]。任何导致Aβ生成增加或Aβ清除减少的的因素均会导致Aβ在脑中代谢障碍从而导致AD[3]。外泌体(Exosome)是由多种细胞分泌的直径40~100 nm的膜性囊泡,神经细胞液可分泌这种囊泡[4]。外泌体具有抗原提呈、细胞间物质转运等作用。有研究报道,外泌体与β淀粉样前体蛋白(β-amyloid precursor protein,APP)的代谢等有关[5]。同时,有研究证实,在细胞水平上,外泌体能够与Aβ结合并促进Aβ纤维化的形成[6]。本实验在已有研究的基础上,对外泌体能否在动物模型上发挥治疗性作用进行验证,从而指导临床实践。
1 材料与方法
1.1 细胞与外泌体 神经细胞N2a细胞在10%胎牛血清中培养,培养一段时间后收集细胞上清提取外泌体。外泌体的提取参照文献[7]方法,即在提取外泌体的前1 d,换细胞培养基为无血清培养基,以去除血清中外泌体对细胞外泌体的影响。然后离心无血清培养基。具体为3 000 g 10 min、4 000 g 10 min、10 000 g 30 min、100 000 g 1 h离心,弃上清,并用PBS重悬离心沉淀。
1.2 实验动物 C57BL/6小鼠30只,雄性,10~12周龄,体重100~150 g,购自中国科学院天津实验动物中心,由天津中医药大学实验动物中心饲养。在实验前饲养动物1周,使动物适应实验室环境。随后按照文献中提供的方法制备表达APP蛋白的转基因杂合小鼠作为实验动物。
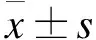
2 评价指标
2.1 外泌体的鉴定 用TBS溶液重悬外泌体,并使外泌体与覆盖有胶棉的网格结合,应用2%磷钨酸对外泌体进行染色,并在HD-2000电镜下进行外泌体鉴定。外泌体直径集中在100 nm左右。TBS重悬外泌体,浓度保持在100 μg/mL,动态光散射检测外泌体直径大小。Western blot鉴定经过多步离心提取的外泌体,用在外泌体上表达的蛋白Alix、Flot-1、GM1等作为marker蛋白进行鉴定。
2.2 外泌体治疗APP小鼠Aβ浓度的测定 用微型泵对13个月龄大小的APP小鼠海马(区域、侧脑室持续注射外泌体(2.67×1012/mL PBS悬浮液,0.25 μL/h)14 d,对照组注射相同体积的PBS。14 d后,处死小鼠,取小鼠脑组织冰冻保存。用ELISA双抗体夹心法检测同侧脑室、对侧脑室、海马区Aβ的浓度,同时借鉴Mucke等[8]的方法,经过突触抗体D35E4孵育后,用FV10i显微镜检测突触灵活性。以确定两种不同部位外泌体注射的疗效,从而为后续治疗注射部位的选择提供依据。
2.3 外泌体治疗APP小鼠Aβ老年斑块的测定 对13个月龄大小的APP小鼠海马区持续注射外泌体14 d,用硫黄素THs对APP小鼠脑组织进行染色,电镜观察硫黄素斑块的大小、数量即代表Aβ老年斑块的大小及数量。
3 结果
3.1 外泌体鉴定 对通过多步离心法提取的N2a细胞的外泌体进行鉴定。外泌体直径主要集中在40~100 nm(图1A、1B),外泌体上表达蛋白Alix、Flot等蛋白,但不表达Aβ蛋白(图1C)。
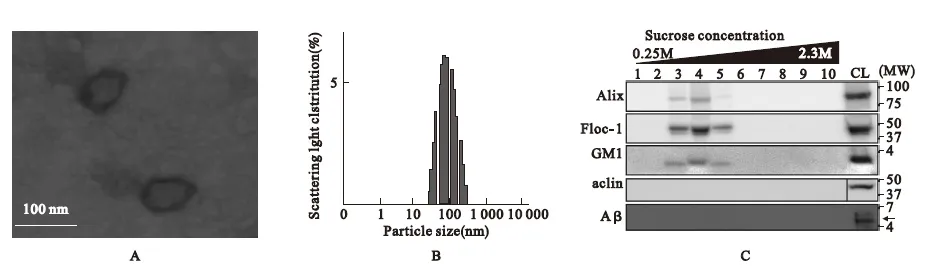
图1 外泌体鉴定结果
3.2 三种不同亚型Aβ浓度及突触灵活性测定 分别对APP小鼠的一侧脑室及海马区注射N2a细胞来源的外泌体。一侧脑室注射PBS,一侧脑室注射外泌体。结果显示,注射外泌体的组织中三种不同亚型Aβ浓度显著低于注射PBS的组织。见表1。一侧海马区注射PBS,一侧海马区注射外泌体。结果显示,注射PBS的小鼠,同侧、对侧海马区的Aβ含量基本没有差异,而注射外泌体的小鼠,其同侧海马区Aβ浓度比对侧海马区显著减少。同时,测得突触灵活性(面积比)同侧比对侧显著提高。见表2。

表1 侧脑室注射外泌体后Aβ含量测定(pmol/g)
注:与PBS组比较,*P<0.05,**P<0.01
3.3 Aβ老年斑块含量测定 上述结果表明,海马区注射外泌体的效果要优于侧脑室注射,因此,本实验选择APP小鼠于海马区持续注射外泌体,随后选取组织进行硫黄素(THs)染色实验,测得外泌体能够显著抑制Aβ老年斑的聚集形成。见表3。由表3可见,随着外泌体的浓度增高,其抑制作用增强。

表2 海马区注射外泌体后Aβ含量及突触灵活性测定(pmol/g)
注:与PBS组比较,*P<0.05,**P<0.01

表3 海马区注射不同剂量外泌体的APP小鼠Aβ斑块聚集情况
注:与PBS组比较,*P<0.05,**P<0.01
4 讨论
AD是以进行性认知障碍及记忆减退为主要特征的神经退行性病变,其病理损害是不可逆的[9],目前关于AD的发病机制主要有“胆碱能学说”及“β淀粉样变性学说”。目前普遍认同的AD的主要发病机制是具有神经毒性的Aβ在大脑实质沉积,启动级联病理反应,从而导致广泛的神经元丢失,形成神经纤维结节(NFT),破坏神经元的正常功能而导致记忆及认知功能障碍,出现痴呆症状。Aβ沉积形成的Aβ老年斑块是导致AD的主要病理学特征。APP为Aβ的前体蛋白,可穿过神经细胞膜,对于神经元的生长、存活和受伤后的修复非常重要[10]。APP可以被α、β、γ三种分泌酶水解。APP由770个氨基酸残基组成,如果在687位点由α-分泌酶水解,再由γ-分泌酶在711/713位点水解,则不会产生淀粉样肽Aβ;若先在671位点由β-分泌酶水解,再由γ-分泌酶在711/713位点水解,则会产生Aβ40、Aβ42、Aβ38三种肽的亚型。Aβ40是Aβ的主要形式,而Aβ42是主要致病形式[11-12]。外泌体是多种细胞分泌的具有细胞间信息传递、抗原提呈、药物运输等作用的囊性结构,具有脂质双分子层结构,是由多囊泡体与细胞膜融合后向细胞外分泌的囊泡[13],广泛存在于体液中,且能够被多种活细胞分泌,如血细胞、神经细胞、肠上皮细胞、肿瘤细胞、T淋巴细胞、B淋巴细胞[14]。外泌体能够反映其来源细胞的功能。
有研究证实,在体外细胞水平上,Aβ可以和加入细胞中的N2a神经细胞来源的外泌体结合,从而抑制Aβ的表达,N2a细胞来源的外泌体富集一种鞘脂糖(Glycosphingolipids,GSLs),介导其与Aβ的结合,从而降低Aβ的含量。因此,笔者通过多步离心提取神经细胞N2a细胞的外泌体,连续注入APP小鼠脑内,发现该外泌体具有降低脑组织中Aβ浓度、抑制Aβ老年斑块聚集及增强突触灵活性的作用。但是关于GSLs富集的外泌体清除Aβ的机制尚不清楚。关于GSLs与AD的发病尚存在争议。有文献报道,GSLs代谢障碍属于溶酶体代谢障碍的一种,GSLs在脑中积聚过多可能会导致AD的发生[15]。因此,关于外泌体治疗AD的策略还需进一步研究。
细胞水平的研究证实,N2a细胞来源的外泌体能够促进Aβ的纤维化。而本研究发现,对APP小鼠持续注射N2a细胞来源的外泌体能够减轻Aβ老年斑的形成。提示外泌体结合Aβ之后能在脑内被迅速清除,可能是外泌体能够阻止Aβ纤维化的形成,也可能是Aβ纤维化形成之后与外泌体结合,被脑组织中的小胶质细胞清除。小胶质细胞能够吞噬脑组织中需要被清除、代谢的废物,从而保持其代谢平衡。有研究证实,大部分外泌体能够被小胶质细胞吞噬清除[16]。但是Aβ被清除的具体机制尚不清楚。在以后的研究中,可以侧重于Aβ治疗AD的各个环节的机制,为真正应用于临床提供依据。
[1] 史宝和,李玉锋,李成洋,等.石杉碱甲治疗轻中度阿尔茨海默病的临床研究[J].实用药物与临床,2013,16(1):37-38.
[2] 王燕,杜瑶,杜芳腾,等.β-淀粉样蛋白清除障碍与阿尔茨海默病[J].中国老年学杂志,2014,34(9):2582-2585.
[3] Mawuenyega KG,Sigurdson W,Ovod V,et al.Decreased clearance of CNS beta-amyloid in Alzheimer′s disease[J].Science,2010,330(6012):1774.
[4] 刘艳华,王小中.外泌体在疾病诊疗中的研究进展[J].实验与检验医学,2014,32(3):267-271.
[5] Rajendran L,Honsho M,Zahn TR,et al.Alzheimer′s diseaseβ-amyloid peptides are released in association with exosomes[J].PNAS,2006,103(30):11172-11177.
[6] Yuyama K,Sun H,Mitsutake S,et al.Sphingolipid modulated exosome secretion promotes clearance of amyloid-by microglia[J].J Biol Chem,2012,287(14):10977-10989.
[7] Théry C,Amigorena S,Raposo G,et al.Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J].Curr Protoc Cell Biol,2006,Chapter 3:Unit 3.22.
[8] Mucke L,Masliah E,Yu GQ,et al.High-level neuronal expression of 1-42 in wild-type human amyloid protein precursor transgenic mice: synaptotoxicity without plaque formation[J].Neurosci,2000,20(11):4050-4058.
[9] 司君增,魏丽萍,吴孟海,等.丁苯酞软胶囊联合盐酸多奈哌齐治疗轻度认知功能障碍的效果观察[J].实用药物与临床,2014,17(9):1144-1146.
[10]Priller C,Bauer T,Mitteregger G,et al.Synapse formation and function is modulated by the amyloid precursor protein[J].J Neurosci,2006,26(27):7212-7221.
[11]王华成,罗金刚,刘学军,等.阿尔茨海默病血清A1342检测方法的建立及其临床意义[J].中华检验医学杂志,2012,35(1):42-46.
[12]韩丽珠,王文静,褚忠海,等.轻度认知障碍患者脑脊液中β淀粉样蛋白42及磷酸化Tau蛋白的水平检测及意义[J].实用医学杂志,2014,30(19):3079-3081.
[13]卢婉,杨人强,王伶,等.外泌体的研究进展[J].生命的化学,2013,33(4):438-442.
[14]Van Vollenhoven RF,Fleischmann R,Cohen S,et al.Tofacitinib oradalimumab versus placebo in rheumatoid arthritis[J].N Engl J Med,2012,367(6):508-519.
[15]Wynn D,Kaufinan M,Montalban X,et al.Daclizumab in active relapsing multiple sclerosis (CHOICE study): a phase 2,randomised,double-blind,placebo-controlled,add-on trial with interferon beta[J].Lancet Neurol,2011,9(4):381-390.
[16]Fitzner D,Schnaars M,Van Rossum D,et al.Selective transfer of exosomes from oligodendrocytes to microglia by macropinocytosis[J].Cell Sci,2011,124(3):447-458.
Preliminary study on the exosome treatment for Alzheimer′s disease model rat by reducing β-amyloid
WU Huan-cheng1,2,LIANG Hai-qian1,SUN Hong-tao1
(1.Brain Hospital Affiliated Hospital of the Armed Police Logistics College,Tianjin 300162,China;2.Graduate School of Medical University of Tianjin,Tianjin 300070,China)
Objective To study the effect of exosomes secreted by N2a cells on the concentration of β-amyloid and the accumulation of plaque in Alzheimer′s mice.Methods The multi-step centrifugal extracted exosomes was continuously injected into the brain of AD mice,and the concentration of Aβ,formation of Aβ plaques and synaptic activity in APP mice were detected. Results After continuous injection of exosomes in AD mice,the concentration of Aβ and the formation of Aβ plaques were significantly lower (P<0.05) than those of control group,while the flexibility of synapse in AD mice significantly increased (P<0.05) than that of control group. Conclusion Exosomes secreted by N2a cells could significantly inhibitethe expression of Aβ in AD mice.
Exosome;β-amyloid;Alzheimer′s disease
2014-12-04
1.武警后勤学院附属医院脑科医院,天津 300162;2.天津医科大学研究生院,天津 300070
10.14053/j.cnki.ppcr.201508002
