蛇床子素对脂多糖诱导的小鼠急性肺损伤的保护作用及机制研究
2015-02-23曾兴建
杨 欣,曾兴建,付 娟
蛇床子素对脂多糖诱导的小鼠急性肺损伤的保护作用及机制研究
杨 欣,曾兴建,付 娟*
目的 探讨蛇床子素(Osthole,Ost)对脂多糖(Lipopolysaccharide,LPS)诱导的急性肺损伤的作用及其机制。方法 45只雄性C57小鼠随机分为3组:正常对照组(对照组),LPS组,Ost+LPS组(Ost组),每组15只。各组小鼠于腹腔注射LPS或生理盐水(50 mg/kg)6 h后,测定PaO2、PaCO2、pH,IL-6、IL-1β、TNF-α表达,JAK2、STAT3、p-JAK2和p-STAT3蛋白表达量,观察肺组织病理变化和湿干比(W/D)。结果 与LPS组比较,Ost组PaCO2、W/D,IL-6、IL-1β和TNF-α表达,p-JAK2和p-STAT3蛋白表达量和肺组织病理改变均明显降低,但PaO2和pH增高,而JAK2和STAT3表达无明显变化。结论 Ost预处理可通过抑制JAK2/STAT3信号通路激活而减轻LPS诱导的急性肺损伤。
蛇床子素;脂多糖;急性肺损伤;炎症;JAK2/STAT3
0 引言
急性肺损伤(Acute lung injury,ALI)及其发展到严重阶段的急性呼吸窘迫综合征是由严重创伤、烧伤、感染等肺内外疾病诱发的以肺细胞弥漫性损伤为主要表现的全身性炎症反应,是临床上常见的急性危重症,严重威胁人类健康[1-2]。蛇床子素(Ost)是一类从伞行植物中分离出来的天然豆香化合物,研究发现其具有广泛的药理生物学治疗作用,如抗炎、抗肿瘤、抗过敏等[3-5]。而炎症是急性肺损伤重要发病机制之一[1,6]。本实验利用脂多糖构建小鼠急性肺损伤模型,探讨Ost对急性肺损伤的作用及其机制。
1 材料与方法
1.1 实验试剂 蛇床子素(纯度98%,西安易乐),LPS(Sigma:美国),3%戊巴比妥钠(谷歌生物,武汉),JAK2(CST,美国),p-JAK2(CST,美国),p-STAT3(CST,美国),STAT3(CST,美国),β-actin(abcom,美国)。TRIzol reagent(Invitrogen,美国),逆转录试剂盒(GeneCopoeia,美国),SYBR green(Takara,日本),IL-6、IL-1β和TNF-α RT-PCR引物(擎科生物技术有限公司,序列见表1),IL-6、IL-1β和TNF-α ELISA试剂盒购自于eBscience,HE试剂由三峡大学医学院病理实验室配制。紫外分光光度计(Thermo fisher)、逆转录仪(Eppendorf),RT-PCR仪(BIO-RAD IQ5)、显微镜(Olympus BX51)及成像系统(HITMAS-30)由三峡大学医学院病理科实验室临床病理组提供。
1.2 实验动物及分组 45只雄性健康C57小鼠,体重20~25 g,SPF级,购自北京华富康实验动物中心,质量合格证号:410703012,饲养于三峡大学医学院实验动物中心,许可证号:HYXK(鄂)20130257,设施使用证明号:013451。适应性喂养1周后,状态良好,小鼠随机分为正常对照组(对照组)、脂多糖组(LPS组)和Ost+脂多糖组(Ost组),每组15只。Ost组于LPS注射前连续给予Ost(40 mg/kg)4 d灌胃,LPS组给予LPS(50 mg/kg)腹腔注射,对照组腹腔注射生理盐水,剂量参考文献[7]。
1.3 标本收集和血气与湿干比检测 各组小鼠在LPS或生理盐水注射后6 h,在3%戊巴比妥钠局麻下行腹主动脉取血,取1 mL做血气分析,其余室温下3 000 r/min离心10 min后取上清液。开胸取左肺,用PBS冲洗2次,滤纸吸干表面血水后称定湿重,然后将其置80 ℃烘烤约48 h至恒重后称定干重,计算肺湿重/干重比(W/D)。W/D代表肺含水量,评定肺水肿。右肺1/3放入中性甲醛溶液,其余2/3肺组织冻于-80 ℃冰箱。
1.4 肺脏病理检测 置于中性甲醛溶液的右肺固定24 h后,70%乙醇脱水、修块、石蜡包埋、切片、HE染色,光镜下观察并评分[7]。0分(没有损伤);1分(轻度损伤):间质水肿和局限性坏死;2分(中度损伤):广泛的肺脏细胞肿胀和坏死;3分(严重损伤):有血管浓缩和肺脏萎缩和坏死;4分(极严重损伤):弥漫性血管浓缩,出血和肺脏坏死。
1.5 Western blot分析 提取肺组织蛋白,采用BCA法进行定量,取60 μg样品进行SDS-PAGE分析,电泳结束后立即电转移至硝酸纤维素膜,5%脱脂奶粉室温封闭3 h,加入目标一抗JAK2(1∶2 000)、p-JAK2(1∶1 000)、STAT3(1∶1 000)、p-STAT3(1∶500)、β-actin(1∶3 000)单抗4 ℃孵育过夜,TBST洗膜3次,每次5 min,加入相应HRP标记的二抗室温孵育1 h,滴加ECL发光,暗室显影,扫描胶片,进行灰度分析。
1.6 Western印迹检测 取肺组织于精微天平称重,按照每50 mg组织中加入1 mL RIPA裂解液(以1∶50加入50×cocktail),冰上匀浆,裂解30 min后,4 ℃ 12 000 r/min离心30 min后取上清,BCA法测定蛋白浓度。以含50 μg蛋白质的上样量,经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳(5%浓缩胶,10%分离胶,恒压80~100 V)后转膜(PVDF膜,恒流300 mA),然后洗膜,以5%脱脂奶粉(TBST配制)封闭1 h、JAK2(1∶2 000)、p-JAK2(1∶1 000)、STAT3(1∶1 000)、p-STAT3(1∶500)、β-actin(1∶3 000)单抗孵育过夜,再次振洗后加入羊抗兔IgG-HRP(二抗)37 ℃孵育1 h。洗膜后加ECL试剂,Kodak化学发光仪曝光显示目的蛋白,并拍照。以Quantity one对条带进行定量分析,以目的条带和β-actin条带积分灰度值比值作为结果。
1.7 实时定量PCR(RT-PCR)检测IL-6、TNF-α和IL-1β 称取100 μg肺组织,于液氮中研磨成粉末状提取总RNA,紫外分光光度计测量浓度,逆转录以及扩增反应按试剂盒说明书进行。以管家基因β-actin作为内参对照基因,用得到的各样本的Ct值按公式2-ΔΔCT计算相对表达量。结果见表1。
表1 实时定量PCR检测的引物序列
1.8 ELISA检测血清IL-6、TNF-α和IL-1β表达水平 按照ELISA试剂盒说明书操作步骤检测收集的血清上清液中IL-6、TNF-α和IL-1β表达水平。
2 结果
2.1 Ost预处理对肺组织结构的影响 LPS刺激6 h后,与对照组比较,LPS组小鼠肺部有大量炎性细胞浸润(中性粒细胞和巨噬细胞),肺组织间隙可见大量红细胞渗出及肺泡壁增厚,弥漫性毛细血管扩张、充血伴灶性肺泡内出血,血管周围出现富含蛋白的水肿液形成水肿套。Ost组与LPS组比较,炎症细胞浸润、红细胞渗出及肺泡壁增厚、毛细血管充血扩张、充血及水肿明显减少。显示Ost预处理可以明显减少LPS对肺脏组织结构的损伤。见图1。
图1 对内毒素诱发的急性肺损伤病理结构影响(HE染色,200×)
2.2 Ost对急性肺损伤小鼠肺湿重/干重比(W/D)的影响 LPS刺激6 h后,LPS组与对照组比较,肺W/D值明显增加(P<0.01),提示急性肺水肿明显加重;与LPS组比较,Ost组W/D明显降低(P<0.05),提示Ost预处理能有效地减轻LPS引起的小鼠急性肺水肿。见图2。

图2 Ost对LPS诱导的急性肺损伤小鼠肺W/D的影响
2.3 Ost对LPS诱导的ALI小鼠血气的影响 与对照组比较,LPS组PaCO2明显增加,PaO2和pH值明显降低,差异有统计学意义(P<0.01);Ost组PaCO2明显低于LPS组,而PaO2、pH值明显高于LPS组。结果显示Ost预处理可以明显降低LPS诱发的血气改变。见图3。

图3 Ost对LPS诱发的ALI小鼠的血气改变的影响
2.4 Ost预处理对JAK2/STAT3信号通路的影响 WB检测显示,LPS组与对照组比较,p-JAK2和p-STAT3蛋白表达水平明显增高(P<0.01),但JAK2和STAT3表达水平差异无统计学意义。Ost组与LPS组比较,p-JAK2和p-STAT3蛋白表达水平明显降低(P<0.05),但JAK2和STAT3表达差异无统计学意义(P>0.05),显示Ost预处理可以抑制LPS诱发的JAK2/STAT3信号通路激活,见图4、图5。
图4 WB检测Ost预处理对JAK2蛋白表达的影响
图5 WB检测Ost预处理对STAT3蛋白表达的影响
2.5 Ost预处理对促炎症细胞因子TNF-α、IL-6和IL-1β表达的影响 RT-PCR检测显示,LPS组与对照组比较,TNF-α、IL-6和IL-1β表达水平明显提高,但Ost预处理后,Ost组与对照组比较,TNF-α、IL-6和IL-1β表达水平明显降低。显示Ost预处理可以减少LPS诱发的促炎症细胞因子的表达。见图6。
2.6 Ost预处理对促炎症细胞因子分泌的影响 ELISA检测显示,LPS组与对照组比较,TNF-α、IL-6和IL-1β分泌水平明显增加,Ost组与急性肺损伤组比较,TNF-α、IL-6和IL-1β分泌水平明显降低。显示Ost预处理可以抑制LPS诱发的促炎症细胞因子的分泌。见图7。

图6 RT-PCR检测Ost预处理对促炎症细胞因子TNF-α、IL-6和IL-1β表达的影响
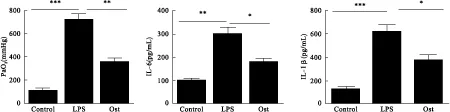
图7 ELISA检测Ost预处理对促炎症细胞因子分泌的影响
3 讨论
急性肺损伤及其继发的急性呼吸窘迫综合征是一种失控的级联式炎症反应,肺血管内皮细胞和上皮细胞弥漫性广泛损伤,进而引起肺功能严重受损,甚至多器官功能损害,诱发多器官功能衰竭,严重影响健康[1-2]。其治疗方法有限且不良反应较多[1-2],因此迫切需要寻找相关的治疗药物。
Ost又名欧芹酚甲醚,为伞形科一年生草本植物蛇床的果实。最近研究发现,Ost具有广泛的药理作用,如抗炎、抗凋亡、抗肿瘤的功效[3-6]。而炎症是急性肺损伤重要的发病机制[3-5]。
本实验利用LPS诱导小鼠急性肺损伤,急性肺损伤的小鼠组可见大量炎性细胞浸润(中性粒细胞和巨噬细胞),肺组织间隙可见大量红细胞渗出及肺泡壁增厚,弥漫性毛细血管扩张、充血伴灶性肺泡内出血,血管周围出现富含蛋白的水肿液形成水肿套,PaCO2、W/D明显升高,PaO2、pH明显降低,促炎症细胞因子IL-6、IL-1β和TNF-α表达明显增加。而Ost组炎症细胞浸润,红细胞渗出及肺泡壁增厚,毛细血管充血扩张,PaCO2明显降低,而PaO2、pH明显升高,W/D明显升高,促炎症细胞因子IL-6、IL-1β和TNF-α表达明显减少,显示Ost预处理可通过抑制促炎症因子信号通路的激活而减轻急性肺损伤。
JAK2/STAT3信号通路是经典的信号通路,在炎症调节过程中起重要作用[8-9]。实验证实,急性肺损伤能够激活JAK2/STAT3信号通路,Ost预处理可以抑制JAK2/STAT3激活,因此推测Ost可通过抑制JAK2/STAT3信号通路而减轻促炎症反应,进而减轻急性肺损伤。但在急性肺损伤中,除抑制JAK2/STAT3信号通路外,Ost是否还可作用于其他信号通路有待进一步研究。
本研究表明,Ost预处理可以减轻LPS引起的急性肺损伤,为临床预防治疗急性肺损伤提供了新的新思路。
[1] Chen H,Bai C,Wang X.The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine[J].Expert Rev Respir Med,2010,4(6):773-783.
[2] Tuinman PR,Dixon B,Levi M,et al.Nebulized anticoagulants for acute lung injury - a systematic review of preclinical and clinical investigations[J].Crit Care,2012,16(2):R70.
[3] Ko FN,Wu TS,Liou MJ,et al.Vasorelaxation of rat thoracic aorta caused by osthole isolated from Angelica pubescens[J].Eur J Pharmacol,1992,219:29-34.
[4] Huang RL,Chen CC,Huang YL,et al.Osthole increases glycosylation of hepatitis B surface antigen and suppresses the secretion of hepatitis B virus in vitro[J].Hepatology,1996,24:508-515.
[5] Liu JH,Zschocke S,Reininger E,et al.Inhibitory effects of Angelica pubescensf.biserrata on 5-lipoxygenase and cyclooxygenase[J].Planta Med,1998,64:525-529.
[6] Shapiro H,Kagan I,Shalita-Chesner M,et al.Inhaled aerosolized insulin: a “topical” anti-inflammatory treatment for acute lung injury and respiratory distress syndrome[J].Inflammation,2010,33(5):315-319.
[7] Shi Y,Zhang B,Chen XJ,et al.Osthole protects lipopolysaccharide-induced acute lung injury in mice by preventing down-regulation of angiotensin-converting enzyme 2[J].Eur J Pharm Sci,2013,48(4-5):819-824.
[8] Zhang ZH,Yu LJ,Hui XC,et al.Hydroxy-safflor yellow A attenuates Aβ-induced inflammation by modulating the JAK2/STAT3/NF-κB pathway[J].Brain Res,2014,14(3):72-80.
[9] Si YN,Bao HG,Xu L,et al.Dexmedetomidine protects against ischemia/reperfusion injury in rat kidney[J].Eur Rev Med Pharmacol Sci,2014,18(13):1843-1851.
Protective effect of osthole on LPS-induced acute lung injury in mice and its mechanism
YANG Xin,ZENG Xing-jian,FU Juan*
(Yichang Second People′s Hospital,Hubei 443000)
Objective To investigate the protective effect of osthole (Ost) on LPS-induced acute lung injury in mice and its mechanism.Methods 45 male C57 mice were randomly divided into three groups:control group (control),LPS group(LPS),andosthole+LPS group (Ost).PaO2,PaCO2and pH,the expression of pro-inflammatory cytokines IL-6,IL-1β and TNF-α in lung tissue and serum,the protein level of JAK2,STAT3,p-JAK2 and p-STAT3 in lung tissue,the pathological change and Wet/Dry after 6 h of LPS or saline injection of the mice were examined.Results Compared with LPS group,PaCO2and Wet/Dry,the expression of pro-inflammatory cytokines IL-6,IL-1β and TNF-α in lung tissue and serum,the protein level of JAK2,STAT3,p-JAK2 and p-STAT3 in lung tissue and the pathological changes in lung tissues significantly decreased,and PaCO2,pH and Wet/Dry increased.Moreover,the protein expression level of JAK2 and STAT3 had no significant difference.Conclusion Ost pretreatment can protect mice against LPS-induced acute liver injury by suppressing JAK2/STAT3 signal pathway.
Osthole;LPS;Acute lung injury;Inflammation;JAK2/STAT3
2015-01-21
宜昌市第二人民医院,湖北 宜昌 443000
宜昌市科学基金(A11301-38)
10.14053/j.cnki.ppcr.201508004
*通信作者
