榄香烯乳联合化疗对小鼠Lewis肺癌的抑瘤作用
2015-02-23党晓敏孙忠民
党晓敏,孙忠民,杨 岚,尚 东,胡 浩
(西安交通大学医学院:1. 第一附属医院呼吸科;2. 药理学系,陕西西安 710061)
◇中医药研究◇
榄香烯乳联合化疗对小鼠Lewis肺癌的抑瘤作用
党晓敏1,孙忠民1,杨 岚1,尚 东1,胡 浩2
(西安交通大学医学院:1. 第一附属医院呼吸科;2. 药理学系,陕西西安 710061)
目的 观察榄香烯乳联合化疗对小鼠Lewis肺癌的抑瘤作用,探讨其抑瘤作用机制。方法 32只C57BL小鼠右腋下接种Lewis肺癌细胞成瘤,随机分为4组:肺癌模型组、化疗组(足叶乙甙3 mg/kg+顺铂3 mg/kg,6 mg/kg)、榄香烯乳组(100 mg/kg)、榄香烯乳+化疗组(106 mg/kg),每组8只。连续给药7 d后,观察脾脏及胸腺指数变化,测定抑瘤率及抑制转移率,并进行组织病理学检测以及透明质酸酶(HAase)和组织金属蛋白酶抑制剂-1(TIMP-1)蛋白表达测定。结果 与单纯化疗组比较,榄香烯乳联合化疗组抑瘤率及抑制转移率明显升高,肺癌小鼠脾脏指数及胸腺指数显著增加,瘤组织细胞形态结构得到改善,TIMP-1蛋白阳性表达率降低明显。结论 榄香烯乳联合化疗对小鼠Lewis肺癌的抑瘤作用明显,其作用机制与增强细胞外基质及免疫调节有关。
Lewis肺癌;榄香烯乳;化疗;透明质酸酶;组织金属蛋白酶抑制剂-1
近年来,肺癌已成为发病率和死亡率增长最快的恶性肿瘤之一,临床上预后较差,严重威胁着人类健康[1]。肺癌的临床治疗仍以化疗为主,但化疗药物较大的毒副作用限制了其临床应用[2]。采用中西药结合能达到减毒增效的目的,近年在临床肿瘤的治疗方面越来越受到重视,尤其在改善症状、提高生存质量和延长生存期方面有其独特优势[3-4]。榄香烯是从姜科植物温莪术的挥发油中提取的抗癌有效成分,以β-榄香烯为主要活性成分,临床使用中经乳化处理得到榄香烯乳注射液[5]。榄香烯的抗癌生物学活性主要表现为降低肿瘤细胞有丝分裂能力、诱发肿瘤细胞凋亡、抑制肿瘤细胞的生长,其不良反应较轻[6]。目前,关于榄香烯乳联合化疗对肺癌治疗作用的研究报道较少。本研究主要探讨了榄香烯乳联合化疗(足叶乙甙+顺铂)对小鼠Lewis肺癌的抑瘤作用及其可能的作用机制,以期对肺癌的临床治疗提供新的思路。
1 材料与方法
1.1 实验动物 C57BL/6近交系小鼠,SPF级,雌雄各半,体质量16~20 g,由西安交通大学医学院实验动物中心提供,动物许可证号:SCXK(陕)2012-003。
1.2 药品和试剂 榄香烯乳,100 mg/20 mL,大连金港制药有限公司;足叶乙甙,100 mg/5 mL,江苏恒瑞医药股份有限公司;顺铂,10 mg/支,山东齐鲁制药厂;RPMI-1640培养液、胎牛血清,美国Invitrogen生命科技公司;青霉素、链霉素,上海生工生物有限公司;HAase和TIMP-1 免疫组化试剂盒,武汉博士德生物工程有限公司。
1.3 方法
1.3.1 模型的建立 参照文献[7]的方法,Lewis肺癌细胞(Lewis肺癌细胞株购自中国科学院上海药物研究所)复苏后RPMI-1640培养基加100 mL/L胎牛血清常规细胞培养传代。取对数生长期Lewis肺癌细胞悬液(2×106/mL)无菌环境下接种于2只C57BL小鼠右腋皮下。接种14 d后将2只C57BL荷瘤小鼠颈椎脱臼处死,无菌环境下取出瘤组织,按肿瘤质量(g)与生理盐水(mL)1∶3比例制备瘤组织匀浆液备用。另取C57BL小鼠32只,雌雄各半,体质量16~20 g,每只小鼠于右腋皮下接种瘤组织匀浆液,0.2 mL/只,建立Lewis肺癌C57BL小鼠模型。
1.3.2 分组及给药 32只C57BL小鼠右腋下处均成瘤。接种14 d后将上述Lewis肺癌C57BL小鼠随机分为4组,每组8只,即肺癌模型组、化疗组(6 mg/kg)、榄香烯乳组(100 mg/kg)、榄香烯乳+化疗组(106 mg/kg)。接种后第15天开始给药治疗,连续给药7 d。化疗组小鼠腹腔注射足叶乙甙及顺铂各3 mg/kg,榄香烯乳组小鼠腹腔注射榄香烯乳100 mg/kg,榄香烯乳+化疗组小鼠腹腔注射榄香烯乳100 mg/kg以及足叶乙甙、顺铂各3 mg/kg。
1.3.3 观察指标 给药7 d后,称重并处死所有动物。①主要脏器系数测定:完整取出小鼠脾脏及胸腺并称重,计算脏器指数;②抑瘤率测定:完整剥离瘤块并称重,并计算抑瘤率,抑瘤率=(肺癌模型组平均瘤重-实验组平均瘤重)×100%/肺癌模型组平均瘤重;③抑制转移率测定:取各组动物肺组织用100 g/L多聚甲醛固定,解剖显微镜下检查肺转移结节数,抑制转移率=(肺癌模型组平均转移数-实验组平均转移数)×100%/肺癌模型组平均转移数;④组织病理学检测:瘤块组织用100 g/L多聚甲醛溶液固定,石蜡包埋,4 μm连续切片,HE染色,光镜下观察瘤块组织的病理学变化;⑤免疫组化检测:瘤块组织常规石蜡包埋制成4 μm切片,脱蜡、水化后,30 mL/L双氧水灭活内源性过氧化酶,微波抗原修复,加入兔抗透明质酸酶(hyaluronidase, HAase)多克隆抗体及组织金属蛋白酶抑制剂-1(tissue inhibitor of matrix metalloproteinase 1, TIMP-1)多克隆抗体,4 ℃过夜,DAB显色,以棕黄色为阳性表达。PBS替代一抗做阴性对照。每张切片随机选取5个视野(×200),每个视野随机选取200个细胞,利用Q550CW图像分析系统进行灰度测定和图像分析。
2 结 果
2.1 榄香烯乳联合化疗对小鼠Lewis肺癌抑瘤作用的影响 与肺癌模型组比较,化疗组、榄香烯乳组以及榄香烯乳+化疗组瘤重均明显降低(P<0.01),尤以榄香烯乳+化疗组瘤重最小;与化疗组比较,单纯榄香烯乳组抑瘤率(32.41%)低于化疗组(50.15%)(P<0.01),而榄香烯乳+化疗组抑瘤率(59.30%)明显优于化疗组(P<0.01,表1)。
表1 榄香烯乳联合化疗对小鼠Lewis肺癌抑瘤率的影响

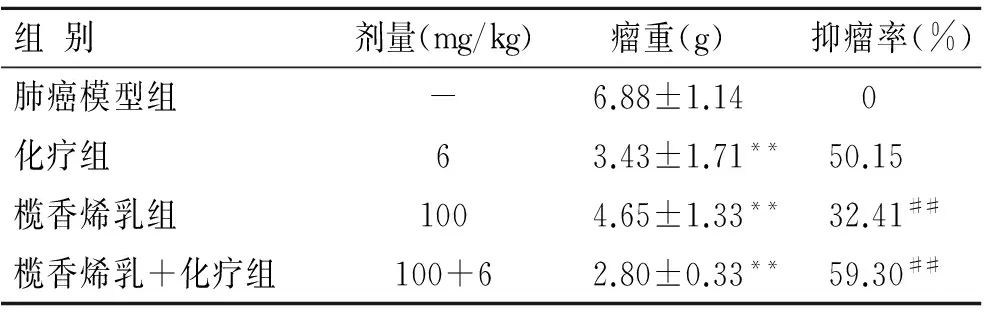
组别剂量(mg/kg)瘤重(g)抑瘤率(%)肺癌模型组-6.88±1.14 0化疗组63.43±1.71**50.15榄香烯乳组1004.65±1.33**32.41##榄香烯乳+化疗组100+62.80±0.33**59.30##
与肺癌模型组比较,**P<0.01;与化疗组比较,##P<0.01。
2.2 榄香烯乳联合化疗对小鼠Lewis肺癌转移抑制作用的影响 化疗组、榄香烯乳组以及榄香烯乳+化疗组肿瘤肺转移结节数明显少于肺癌模型组(P<0.01);与化疗组比较,单纯榄香烯乳组抑制转移率(43.86%)低于化疗组(56.14%)(P<0.01),而榄香烯乳+化疗组抑制转移率(65.89%)明显高于化疗组(P<0.01,表2)。
表2 榄香烯乳联合化疗对小鼠Lewis肺癌转移抑制率的影响

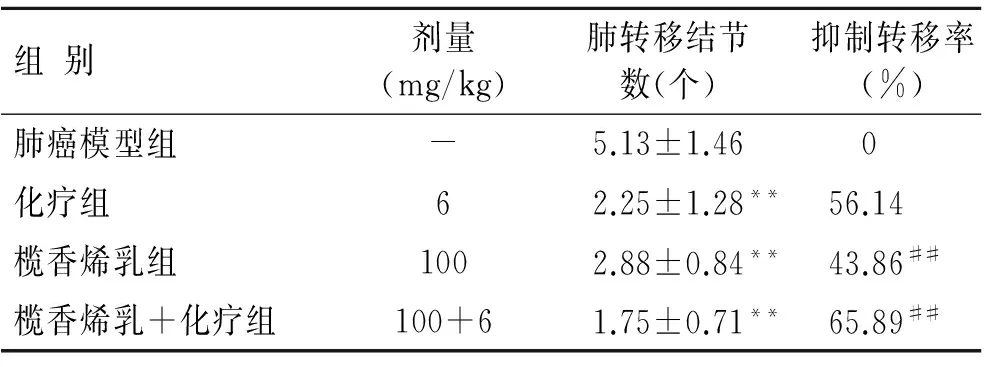
组别剂量(mg/kg)肺转移结节数(个)抑制转移率(%)肺癌模型组-5.13±1.46 0化疗组62.25±1.28**56.14榄香烯乳组1002.88±0.84**43.86##榄香烯乳+化疗组100+61.75±0.71**65.89##
与肺癌模型组比较,**P<0.01;与化疗组比较,##P<0.01。
2.3 榄香烯乳联合化疗对Lewis肺癌小鼠免疫器官的影响 治疗结束时所有C57BL小鼠均存活。与肺癌模型组比较,给药过程中榄香烯乳组以及榄香烯乳+化疗组动物一般状态较好,毛发光泽、进食正常,生存质量有所改善。与肺癌模型组比较,榄香烯乳组以及榄香烯乳+化疗组小鼠用药后体质量增加,尤其是榄香烯乳组体质量增加明显(P<0.05);与化疗比较,榄香烯乳组以及榄香烯乳+化疗组小鼠用药后体质量均显著增加(P<0.05,P<0.01)。与肺癌模型组比较,化疗组小鼠脾脏指数及胸腺指数均降低(P<0.01),榄香烯乳组小鼠脾脏指数及胸腺指数均升高(P均<0.05),榄香烯乳+化疗组小鼠脾脏指数升高(P<0.05);与化疗组比较,榄香烯乳组以及榄香烯乳+化疗组能显著增加肺癌小鼠脾脏指数及胸腺指数(P<0.05,P<0.01)(表3)。
表3 榄香烯乳联合化疗对Lewis肺癌小鼠免疫器官脏器指数的影响


组别剂量(mg/kg)给药前体质量(g)给药后体质量(g)脾脏指数(mg/g)胸腺指数(mg/g)肺癌模型组-18.2±1.016.2±1.52.60±0.331.79±0.70化疗组618.0±1.614.9±1.51.63±0.13**0.64±0.14**榄香烯乳组10018.1±1.518.7±2.7*##4.39±0.92**##2.51±0.46*##榄香烯乳+化疗组100±619.1±2.417.5±3.0#3.06±0.29**##2.14±0.55##
与肺癌模型组比较,*P<0.05,**P<0.01,与化疗组比较,#P<0.05,##P<0.01。
2.4 榄香烯乳联合化疗对小鼠Lewis肺癌组织病理学的影响 肉眼解剖观察显示,Lewis肺癌组织与周围组织边界较清晰,无包膜,切面呈灰白色。组织病理学检测结果显示,瘤细胞排列紊乱,大小不一,核大深染,核异形性明显,核分裂相多见,间质血管增生,瘤组织中可见灶状坏死。给药各组瘤组织细胞形态结构得到一定程度改善,瘤组织坏死区面积扩大,呈分隔状;瘤细胞出现不同程度的退变,细胞核固缩,分裂相减少,间质血管减少,肿瘤间质及边缘有大量淋巴细胞浸润,瘤组织边缘可见纤维性包裹(图1)。
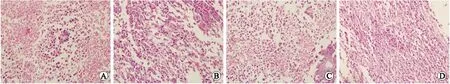
图1 榄香烯乳联合化疗对小鼠Lewis肺癌组织病理学的影响
Fig.1 Effects of elemene on histological changes of Lewis lung carcinoma in mice
A:肺癌模型组;B:化疗组;C:榄香烯乳组;D:榄香烯乳+化疗组。
2.5 榄香烯乳联合化疗对小鼠Lewis肺癌组织HAase及TIMP-1表达的影响 免疫组化结果表明, HAase及TIMP-1主要表达于肿瘤细胞的胞质及胞膜中,阳性染色为棕黄色。肺癌模型组肿瘤细胞HAase和TIMP-1蛋白阳性着色较强。与肺癌模型组(阳性表达率为43.0%)比较,化疗组、榄香烯乳组肿瘤细胞HAase蛋白阳性着色的细胞比例降低(阳性表达率分别为38.5%、40.4%),尤其是榄香烯乳+化疗组肿瘤细胞HAase蛋白阳性着色比例增加降低(阳性表达率为31.5%)(P<0.01)。与肺癌模型组(阳性表达率为55.6%)比较,化疗组及榄香烯乳+化疗组肿瘤细胞TIMP-1蛋白阳性着色的细胞比例显著降低(阳性表达率分别为45.2%、35.6%)(P<0.05,P<0.01);与化疗组比较,榄香烯乳+化疗组肿瘤细胞TIMP-1蛋白阳性着色的细胞比例明显降低(P<0.05,图2)。
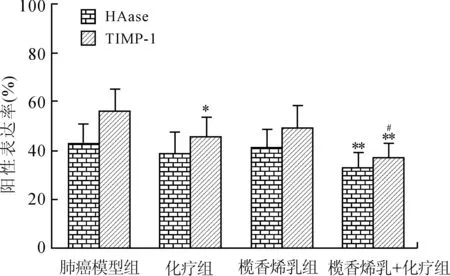
图2 榄香烯乳联合化疗对小鼠Lewis肺癌组织HAase及TIMP-1表达的影响
Fig.2 Effects of elemene on HAase and TIMP-1 protein expressions in Lewis lung carcinoma in mice
与肺癌模型组比较,*P<0.05,**P<0.01,与化疗组比较,#P<0.05(n=8)。
3 讨 论
肺癌是临床预后较差的恶性肿瘤之一,虽然治疗上仍以化疗占主导地位,但化疗药物较大的毒副作用限制了其临床应用。因此,寻找抗癌效果好而毒副作用小的药物是肿瘤研究领域中的重要方向[8]。近年来,中医药在防治肺癌方面的作用逐渐受到关注,其在缓解症状、延长生存期、提高治疗依从性、减毒增效和抗转移复发等方面显示出明显的优势。本实验通过复制小鼠Lewis肺癌模型,主要观察了榄香烯乳联合化疗对小鼠Lewis肺癌的抑瘤作用及其抑瘤作用机制。结果提示,榄香烯乳联合化疗对小鼠Lewis肺癌的抑瘤作用明显,其作用机制可能与增强细胞外基质及免疫调节有关。
化疗对小细胞肺癌的疗效无论早期或晚期均较肯定。同时,化疗也是治疗非小细胞肺癌的主要手段。足叶乙甙为细胞周期特异性抗肿瘤药物,作用于DNA拓扑异构酶Ⅱ,形成药物-酶- DNA稳定的可逆性复合物,阻碍DNA修复,是治疗小细胞肺癌的主要化疗药物[9]。顺铂属细胞周期非特异性抗肿瘤药物,主要作用部位在DNA的嘌呤和嘧啶碱基,可抑制癌细胞的DNA复制过程,并损伤其细胞膜结构。顺铂具有抗癌谱广、作用强、与多种抗肿瘤药物有协同作用、且无交叉耐药等特点,为治疗多种实体瘤的一线用药[10]。足叶乙甙与顺铂组成的EP方案是治疗小细胞肺癌的标准化疗方案,疗效确切,广泛应用于临床。本实验证实,足叶乙甙与顺铂联合治疗可显著抑制小鼠Lewis肺癌瘤组织生长(抑瘤率达50.15%),肿瘤肺转移结节数明显减少(抑制转移率为56.14%)。但临床资料显示,足叶乙甙存在比较严重的骨髓抑制、肠胃道反应和肝肾损伤等不良反应,而顺铂的肾毒性、耳毒性及胃肠道反应等也较为严重。因此,在一定程度上影响上述药物的临床使用。
香烯是从中药温莪术中提取的一种有效抗癌物质,属挥发性油类,脂溶性高,渗透性好,药代动力学研究表明静脉给药后以肺内药物浓度最高。榄香烯为非细胞毒性抗肿瘤药物,动物实验及临床资料显示其对多种肿瘤细胞具有显著的抑制作用[11-12]。其作用机制目前认为主要是对DNA、RNA及蛋白质合成起抑制作用,干扰肿瘤细胞的生长代谢,诱导肿瘤细胞加速凋亡。榄香烯对肿瘤细胞的生长有直接抑制作用,可阻滞肿瘤细胞从S期进入G2、M期,阻止细胞从G0、G1期进入S期,降低细胞分裂增殖能力。本研究结果证实,榄香烯乳联合化疗可明显抑制小鼠Lewis肺癌瘤组织生长(抑瘤率达32.41%)及转移复发(抑制转移率为43.86%)
近年来,采用中西药结合的方法在肿瘤的临床治疗方面越来越受到关注。中药毒副作用小,耐受性好,能够提高治疗依从性,同时与化疗药物配合达到减毒增效的作用[13]。本研究结果显示,榄香烯乳联合化疗(足叶乙甙+顺铂)治疗能明显抑制小鼠Lewis肺癌瘤组织生长及转移复发,抑瘤率(59.30%)和抑制转移率(65.89%)均优于单纯榄香烯乳组和化疗组,且联合用药后瘤组织细胞形态结构得到较好改善。单纯化疗可致肺癌小鼠脾脏、胸腺出现萎缩,联合用药能显著增加肺癌小鼠脾脏指数及胸腺指数,提示榄香烯乳进入机体后能保护机体免疫器官,减轻化疗药物对免疫器官造成的损害,增强机体的自身免疫功能,从而发挥其减毒增效的抗肿瘤作用。
透明质酸(hyaluronic acid, HA)是一种酸性黏多糖,是细胞外基质(ECM)的重要组成部分,可在HAase的作用下降解。研究显示,HA和HAase参与肿瘤细胞的增殖、分化、粘附、迁移及血管形成等重要过程,在一些恶性肿瘤组织发现HA和HAase表达增强[14]。TIMPs是基质金属蛋白酶(MMPs)的特异性抑制剂,在肿瘤侵袭转移中起关键性作用。TIMP-1可高表达于正常肺癌组织,并与肿瘤浸润、转移以及远期生存密切相关[15]。本研究进一步检测了小鼠Lewis肺癌瘤组织HAase和TIMP-1的蛋白表达,结果表明榄香烯乳联合化疗组肿瘤细胞HAase和TIMP-1蛋白表达显著降低,提示榄香烯乳联合化疗对小鼠Lewis肺癌的抑瘤作用与增强细胞外基质有关。
[1] LI C, HONG W. Research status and funding trends of lung cancer biomarkers[J]. J Thorac Dis, 2013, 5(5):698-705.
[2] JOHNSON ML, PATEL JD. Chemotherapy and targeted therapeutics as maintenance of response in advanced non-small cell lung cancer[J]. Semin Oncol, 2014, 41(1):93-100.
[3] 孙燕. 进一步提高中西医结合防治肿瘤的临床研究水平[J]. 中国新药杂志, 2011, 20(17): 1588-1592.
[4] LIN G, LI Y, CHEN S, et al. Integrated Chinese-Western therapy versus western therapy alone on survival rate in patients with non-small-cell lung cancer at middle-late stage[J]. J Tradit Chin Med, 2013, 33(4):433-438.
[5] LI QQ, WANG G, LIANG H, et al. β-elemene promotes cisplatin-induced cell death in human bladder cancer and other carcinomas[J]. Anticancer Res, 2013, 33(4):1421-1428.
[6] YAO CC, TU YR, JIANG J, et al. β-elemene reverses the drug resistance of lung cancer A549/DDP cells via the mitochondrial apoptosis pathway[J]. Oncol Rep, 2014, 31(5):2131-2138.
[7] 符慧群,唐雪元,潘宇亮. 川芎嗪和顺铂联用对小鼠Lewis肺癌生长和转移的抑制作用[J]. 南华大学学报:医学版, 2008, 36(1):46-49.
[8] CHAN BA, COWARD JI. Chemotherapy advances in small-cell lung cancer[J]. J Thorac Dis, 2013, 5(5):S565-S578.
[9] LIMA JP, SANTOS LV, SASSE EC, et al. Camptothecins compared with etoposide in combination with platinum analog in extensive stage small cell lung cancer: systematic review with meta-analysis[J]. J Thorac Oncol, 2010, 5(12):1986-1993.
[10] JIANG L, YANG KH, GUAN QL, et al. Cisplatin plus etoposide versus other platin-based regimens for patients with extensive small-cell lung cancer: a systematic review and meta-analysis of randomised, controlled trials[J]. Intern Med J, 2012, 42(12):1297-1309.
[11] 张晔,曲秀娟,刘云鹏,等. β-榄香烯对肾癌细胞的体外放射增敏作用[J]. 西安交通大学学报:医学版, 2011, 32(6):664-667.
[12] XU HB, ZHENG LP, LI L, et al. Elemene, one ingredient of a Chinese herb, against malignant tumors: a literature-based meta-analysis[J]. Cancer Invest, 2013, 31(2):156-166.
[13] 刘鲁明. 未来10年中西医结合肿瘤学展望[J]. 中国中西医结合杂志, 2011, 31(7):870-872.
[14] EISSA S, BADR S, BARAKAT M, et al. The diagnostic efficacy of urinary survivin and hyaluronidase mRNA as urine markers in patients with bladder cancer[J]. Clin Lab, 2013, 59(7-8):893-900.
[15] PESTA M, KULDA V, KUCERA R, et al. Prognostic significance of TIMP-1 in non-small cell lung cancer[J]. Anticancer Res, 2011, 31(11):4031-4038.
(编辑 卓选鹏)
Inhibitory effects of elemene in combination with chemotherapy on Lewis lung carcinoma in mice
DANG Xiao-min1, SUN Zhong-min1, YANG Lan1, SHANG Dong1, HU Hao2
(1. Department of Respiration, the First Affiliated Hospital; 2. Department of Pharmacology, Medical School of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To investigate the inhibitory effects of elemene in combination with chemotherapy on Lewis lung carcinoma in mice and the possible mechanisms of the therapeutic effects. Methods Lewis lung carcinoma in C57BL mice was established with Lewis cell line successfully. Thirty-two mice with Lewis lung carcinoma were randomly divided into four groups with 8 in each: lung carcinoma model group, chemotherapy group (etoposide 3 mg/kg and cisplatin 3 mg/kg) (6 mg/kg), elemene group (100 mg/kg), and elemene plus chemotherapy group (106 mg/kg). After the mice were treated 7 days with intraperitoneal injection of the corresponding medicine, we observed the spleen index and thoracic gland index, and measured growth inhibition rate and metastasis inhibition rate. Histomorphology of tumor tissue, protein expressions of hyaluronidase (HAase) and tissue inhibitor of matrix metalloproteinase 1 (TIMP-1) were measured to evaluate the effects of elemene in combination with cisplatin on Lewis lung carcinoma in mice. Results Compared with those in chemotherapy group, the growth inhibition rate and metastasis inhibition rate were increased obviously in elemene + chemotherapy group. The spleen index and thoracic gland index were also increased. Elemene in combination with chemotherapy improved the morphological structure of tumor tissue and decreased the protein expression of TIMP-1. Conclusion Elemene in combination with chemotherapy can inhibit the growth of Lewis lung carcinoma in mice. The possible mechanisms might be associated with enhancing extracellular matrix and immune regulation.
Lewis lung carcinoma; elemene; chemotherapy; hyaluronidase (HAase); tissue inhibitor of matrix metalloproteinase 1 (TIMP-1)
2014-05-10
2014-08-20
陕西省科学技术研究发展计划项目(No.2008K09-01, 2011K12-01) Supported by the Sci-tech Research and Development Project of Shaanxi Province (No.2008K09-01, 2011K12-01)
孙忠民. E-mail: sunzm67@sohu.com
R734.2
A
10.7652/jdyxb201501021
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.1654.018.html(2014-11-19)
