大鼠弥漫性轴索损伤后免疫炎症反应的 变化及氢气对其的影响
2015-02-23马旭东宋锦宁赵永林张斌飞李丹东刘尊伟赵君杰赵雅慧
马旭东,宋锦宁,赵永林,张斌飞,李丹东,刘尊伟,赵君杰,赵雅慧
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
◇专题研究◇
大鼠弥漫性轴索损伤后免疫炎症反应的 变化及氢气对其的影响
马旭东,宋锦宁,赵永林,张斌飞,李丹东,刘尊伟,赵君杰,赵雅慧
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
目的 探讨免疫炎症反应在大鼠弥漫性轴索损伤(DAI)中的作用及氢气对其保护作用。方法 将96只SD雄性大鼠随机平均分为正常组、假手术组、DAI模型组(6 h、1 d、3 d)和氢气干预组(6 h、1 d、3 d)。采用头颅瞬间旋转损伤装置制作大鼠DAI模型,干预组每日2次腹腔注射高纯度氢气(10 mL/kg)。各组于预定时间点通过HE染色、嗜银染色观察组织形态学的变化,GFAP免疫荧光染色观察胶质细胞增生活化情况,Western blotting分析炎症因子IL-6、IL-1β和信号通路JNK、p-JNK蛋白的表达。结果 与假手术组比较,DAI顶叶皮髓交界区出现轴索肿胀、迂曲、轴索球等DAI特征性改变,GFAP阳性细胞数量增多(P<0.05),IL-6、IL-1β和p-JNK表达增高(P<0.01),氢气干预组较模型组脑组织形态学有所改善,GFAP阳性细胞数减少(P<0.05),IL-6、IL-1β和p-JNK表达降低(P<0.01)。结论 免疫炎症反应参与了DAI急性期脑损伤的病理生理过程,星形胶质细胞的活化和炎症因子的大量释放导致脑损伤的加重。氢气能够通过减轻免疫炎症反应改善DAI急性期脑损伤。减轻免疫炎症反应程度对DAI急性期脑保护具有一定意义。
弥漫性轴索损伤;免疫炎症反应;氢气;颅脑损伤
脑弥漫性轴索损伤(diffuse axonal injury, DAI)是一种常见的特殊类型的创伤性脑损伤(traumatic brain injury, TBI),以轴索断裂、轴索回缩球形成为主要病理特征,因其发病后的病理机制目前仍然不十分清楚,故一直是神经外科领域研究的热点和难点[1-2]。免疫炎症反应是引起TBI后继发性损伤的重要病理机制之一,在TBI早期即可发现炎症细胞的聚集、胶质细胞的激活和炎症介质如TNF-α、IL-1、IL-6等释放的增加,大量的炎性因子还能进一步引起级联反应,导致细胞的直接死亡、凋亡程序启动,引起继发性损伤[3-5]。但是,DAI不同于TBI,它是以广泛轴索损伤为主要病理变化,免疫炎症反应在DAI中的作用还有待于进一步研究。
氢气作为近年来发现的具有生物活性的气体,具有减轻免疫炎症反应等生物学功能,在脑缺血、外伤、神经系统退行性疾病等多种疾病模型中获得了较好的治疗效果[6-8]。为了揭示免疫炎症反应在大鼠DAI中的作用及氢气对其治疗作用,本研究通过腹腔注射氢气对DAI大鼠模型进行干预,并通过HE染色、嗜银染色观察组织形态学的变化,GFAP免疫荧光染色观察胶质细胞增生活化情况,Western blotting分析炎症因子IL-6、IL-1β和相关信号通路JNK、p-JNK蛋白的表达,旨在进一步阐明DAI的病理机制,并探索DAI临床治疗的新思路。
1 材料与方法
1.1 实验动物和主要试剂、仪器 SPF级具有相同遗传背景的健康成年雄性SD大鼠96只,体质量250~300 g,由西安交通大学医学院实验动物中心提供,实验动物生产许可证号SCXK(陕)08-018。本实验动物伦理已经过西安交通大学医学院生物伦理委员会批准。纯氢气由高纯度氢气发生器产生(SPH-300,上海仪电分析仪器有限公司,中国);蛋白提取试剂盒(中杉金桥,中国);GFAP小鼠单克隆抗体(Millipore,美国);IL-6兔多克隆抗体(博士德,中国);IL-1β兔多克隆抗体(博士德,中国);JNK兔单克隆抗体(CST,美国);p-JNK兔单克隆抗体(CST,美国);辣根过氧化物酶标记的IgG二抗(Santa Cruz,美国);FITC标记的羊抗鼠荧光二抗(博奥森,中国);DAPI(MP Biomedicals,法国);PVDF膜(Millipore,美国);凝胶成像系统(JS-380A,中国);图像采集与分析系统(Leica-Q550CW,德国);荧光显微镜(OLYMPUS,日本);SPSS16.0统计软件(美国);Quantity One 4.62凝胶成像分析软件(美国)。
1.2 实验分组 实验动物随机分为正常组、假手术组、DAI模型6 h、1 d、3 d组和氢气干预6 h、1 d、3 d组,共8组,每组12只,6只用于Western blotting检测,另6只用于形态学检测和免疫荧光检测。
1.3 模型制作 采用刘晓斌等的头颅瞬间旋转损伤装置制作大鼠DAI模型[1]。大鼠用100 g/L水合氯醛腹腔麻醉(2 mL/kg)后以两个耳棒及门齿孔将大鼠头颅固定于装置上,待其麻醉清醒并出现挣扎后进行打击。假手术组:麻醉出现挣扎后即从装置上取下。DAI模型组:触发扳机,弹簧驱动旋转装置,使大鼠头颅瞬时侧向旋转90°,每只共进行8次打击。氢气干预组:造模同DAI模型组,之后立即腹腔注射纯氢气10 mL/kg,之后相同剂量每天腹腔注射2次,间隔12 h。
1.4 组织形态学检测 各组各时间点经100 g/L水合氯醛腹腔麻醉(3 mL/kg),生理盐水左心灌流至流出液清亮,40 g/L多聚甲醛溶液灌注至四肢抽搐、内脏颜色变白,开颅取脑并置于40 g/L多聚甲醛溶液中固定48 h。将固定好的脑组织修块、冲洗、脱水,透明及浸蜡包埋。将蜡块取顶叶部位连续冠状位切片,3张片厚约4 μm用于HE染色,3张片厚约10 μm用于Gless嗜银染色,3张片厚约4 μm用于GFAP免疫荧光染色。
1.5 GFAP免疫荧光染色 上述切片脱蜡,梯度乙醇水化,微波抗原修复,PBS洗片,山羊血清封闭,小鼠单克隆抗GFAP抗体(1∶200)于4 ℃孵育过夜,PBS洗片,滴加FITC标记的抗小鼠荧光二抗(1∶200),室温避光孵育2 h,PBS洗片,DAPI复染10 min,自来水冲洗后甘油缓冲液封片。荧光显微镜观察结果并拍照,用photoshop cs5对荧光照片merge。每张切片于顶叶皮层区域随机取3个×400倍视野计数GFAP阳性细胞。
1.6 脑组织IL-6、IL-1β、JNK及p-JNK Western blotting检测 各组各时间点生理盐水灌注后取双侧大脑皮质,RIPA裂解液提取组织蛋白,以BSA为标准,BCA法蛋白定量。取50 μg蛋白样品,SDS-PAGE电泳,湿转法转移至PVDF膜,50 g/L脱脂牛奶或50 g/L牛血清白蛋白中37 ℃封闭1~2 h后,一抗(IL-6,1∶200;IL-1β,1∶200;JNK,1∶1 000;p-JNK,1∶1 000;β-actin,1∶1 000)4 ℃孵育过夜。PBST或TBST缓冲液洗膜后,将膜与辣根过氧化物酶标记的二抗(1∶5 000)室温孵育1 h,洗膜后化学发光法观察显影,凝胶成像系统拍照后采用Quantity One软件对测定条带作灰度半定量分析。
2 结 果
2.1 大脑皮层的形态学观察 观察DAI后6 h至3 d 大鼠脑顶叶皮层与胼胝体交界区HE染色及Glees嗜银染色切片(图1)。假手术组HE染色,光镜下可见脑组织结构清晰完整,神经细胞密集,排列整齐,神经元胞质丰富,淡染,核居中,核仁清楚,胶质细胞分布正常,胼胝体区域结构完整、致密。嗜银染色可见神经元轴突光滑纤细、走形连续。DAI模型组HE染色可见大量神经元收缩变性,核固缩,轴突水肿增宽,胶质细胞数目增多,胼胝体结构疏松。银染可见神经纤维不清,轴突肿胀、扭曲、断裂,排列紊乱,轴索球形成。上述变化6 h即可出现,至3 d时最为典型。氢气干预组与DAI模型组病理变化相同,但变性坏死的神经细胞及肿胀的轴突相对较少。
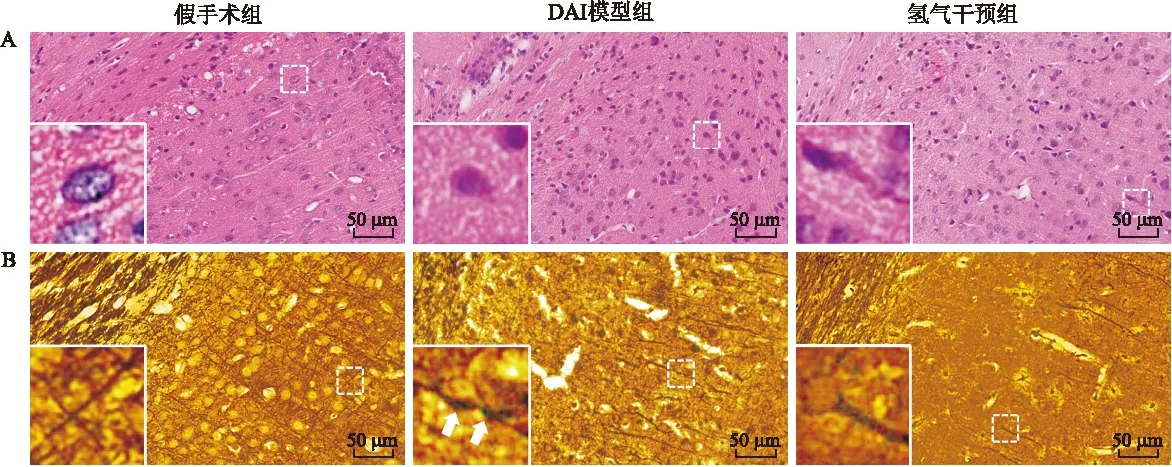
图1 各组大鼠3 d顶叶皮髓交界区的组织形态学变化
Fig.1 Morphological changes of the brain 3 d after DAI (×400)
A:HE染色,假手术组组织形态正常,DAI模型组可见轴突肿胀、神经元收缩变性,氢气干预组病理变化同模型组,但程度较轻;B:嗜银染色,假手术组组织形态正常,DAI模型组可见神经纤维紊乱、肿胀、轴索球形成(箭头所示),氢气干预组病理变化程度有所改善。
2.2 大脑皮层GFAP免疫荧光染色及阳性细胞计数 GFAP免疫荧光染色显示,DAI后,模型组和氢气干预组6 h至3 d顶叶皮层GFAP阳性细胞计数逐渐升高,模型组由4.8±0.9/视野升至5.2±1.5、6.3±2.0和10.3±1.5/视野;氢气干预组增加至5.0±1.7、6.2±1.9和8.3±1.4/视野。经检验各组数据方差齐,正态分布,方差分析显示3 d时GFAP阳性细胞计数有统计学差异(F=22.1,P<0.05),LSD-t检验显示DAI模型组、氢气干预组之间及其与假手术组之间GFAP阳性细胞计数差异具均有统计学意义(P<0.05,图2)。
2.3 皮层IL-6、IL-1β、JNK及p-JNK Western blotting分析 DAI模型组皮层IL-6、IL-1β、p-JNK表达和p-JNK/JNK比值于DAI后6 h~3 d各时间点均增加,而JNK表达未见明显变化。氢气干预组上述指标亦升高,但程度不如DAI模型组显著。LSD检验显示6 h、1 d、3 d时模型组与假手术组之间、氢气干预组与模型组之间IL-6、IL-1β、p-JNK表达和p-JNK/JNK比值差异均有统计学意义(P<0.05,图3~图5)。
3 讨 论
DAI不同于一般类型的TBI,各种外力导致头颅瞬间加速或减速时,由于脑组织间密度不完全相同,组织间运动速度不均,产生剪切作用引起白质广泛损伤造成DAI,其病理机制复杂[9-10]。传统理论认为,DAI属于原发伤,伤后即刻存在,无法干预,这也使得目前临床上DAI的治疗仅局限于对症处理,治疗效果不理想。目前,研究普遍认为DAI中确实存在剪应力的损伤,但这种损伤并不直接导致轴索断裂,而后引起的继发性损伤才是导致轴索断裂的主要原因[11-13],这使得通过某些手段干预并阻止继发性轴索损伤,改善DAI预后成为可能。已经明确免疫炎症反应在脑缺血、外伤等疾病中起到重要的作用,脑损伤后免疫炎症反应与钙离子内流、兴奋性氨基酸释放、氧化应激、线粒体障碍等关系密切,其相互促进,产生级联反应,引起损伤加重[14-15]。因此,免疫炎症反应在加重DAI继发性损伤中可能起到重要作用。
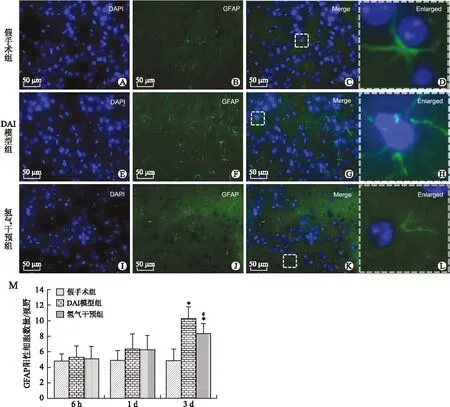
图2 各组大鼠3d顶叶皮层GFAP免疫荧光染色及GFAP阳性细胞计数的比较
Fig.2 GFAP immun of luorescent staining and count of GFAPpositive cells in the cortex in each group ( × 400,3 d)
A、E、I:DAPI染色;B、F、J:GFAP免疫荧光染色;C、G、K:DAPI及GFAP荧光的重合图像;D、H、L:C、G、K中标识区域的放大图,以DAPI和GFAP荧光重合且形态清晰者为GFAP阳性细胞;M:DAI模型组第3天GFAP阳性细胞数量增多,氢气干预组较模型组减少;与假手术组比较,*P<0.05;与DAI模型组比较,#P<0.05。
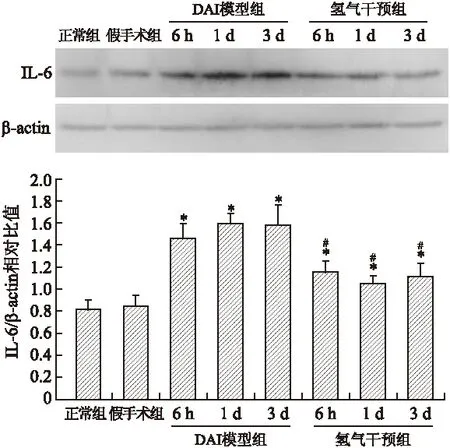
图3 各组大鼠皮层IL-6的表达和灰度值的比较
Fig.3 Expression and gray intensity analysis of IL-6 in rat brain tissues
与假手术组比较,*P<0.05;与DAI模型组比较,#P<0.05。
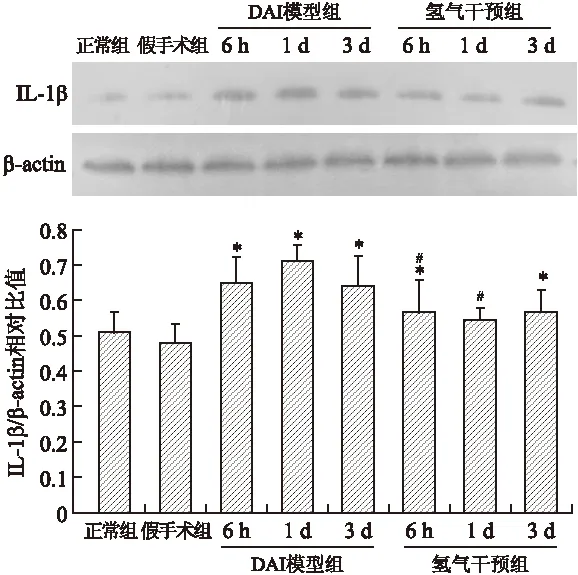
图4 各组大鼠皮层IL-1β的表达和灰度值的比较
Fig.4 Expression and gray intensity analysis of IL-1β in rat brain tissues
与假手术组比较,*P<0.05;与DAI模型组比较,#P<0.05。
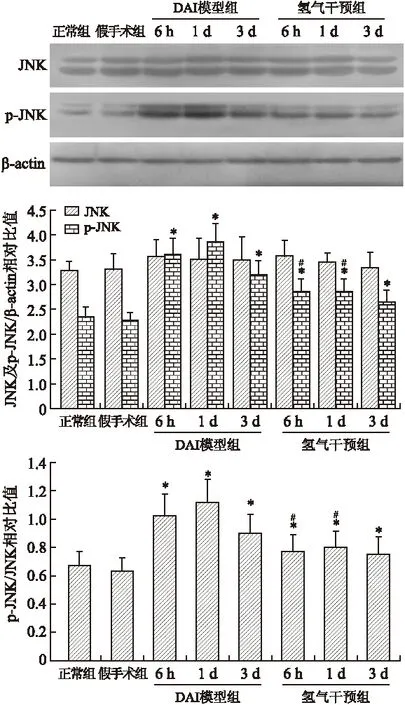
图5 各组大鼠皮层JNK、p-JNK的表达和灰度值的比较
Fig.5 Expression and gray intensity analysis of JNK and p-JNK in rat brain tissues
与假手术组比较,*P<0.05;与DAI模型组比较,#P<0.05。
本实验通过头颅瞬间旋转损伤装置[9]制作的DAI模型伤后均出现一定程度的昏迷和神经功能缺损,脑组织形态学观察可见轴突肿胀、迂曲、断裂、轴索球形成等特征性变化,表现出典型的DAI特点。实验进一步证实,DAI后6 h、1 d、3 d,炎症因子IL-6、IL-1β表达均升高,与免疫炎症反应密切相关的JNK信号通路中磷酸化的JNK表达也增多,说明免疫炎症反应的确伴随DAI出现,在DAI继发性损伤中可能起到了重要的作用。星形胶质细胞在大脑免疫炎症反应过程中起着重要的作用,增生活化的星形胶质细胞会产生大量促炎因子,如TNF-α、IL-6、IL-1α、IL-1β、干扰素-γ等,可直接诱导神经元死亡、增加氧自由基和抑制神经发生,从而加重神经损伤[5]。本实验通过GFAP免疫荧光染色显示,DAI后3 d顶叶皮层区域星形胶质细胞数量明显增多,提示DAI后大鼠脑组织存在星形胶质细胞增生、活化,免疫炎症反应的确参与了DAI的病理过程。
近年来,研究发现氢气具有抗氧化应激、减轻免疫炎症等多种生物学功能,在脑神经系统退行性疾病、脑缺血、外伤等疾病中表现出良好的治疗效果[6-8]。本课题组前期研究已经证实氢气具有减轻DAI后氧化应激程度的作用[16],但对其是否具有减轻DAI后免疫炎症反应程度的作用未做进一步研究。本次实验通过对DAI模型给予氢气进行干预,实验结果显示,氢气干预组较模型组大鼠皮层星形胶质细胞有所减少,炎症因子IL-6、IL-1β及相关信号通路p-JNK表达降低,说明氢气具有减轻免疫炎性反应的作用。分析其原因,由于既往研究已经表明氢气具有抗氧化应激作用,其作用靶点可能是直接中和·OH和ONOO-。我们在前期研究中也证实氢气能够改善DAI大鼠脑组织抗氧化酶活性并降低脂质过氧化物水平[16],而氧化应激和免疫炎症反应在疾病发生过程中往往同时存在,相互促进,因此氢气的抗炎作用可能是其抗氧化应激作用的继发效应。但是,目前对于氢气直接特异性清除自由基的抗氧化应激机制仍存在争议。近期又有研究显示氢气具有调控信号通路及调控某些基因表达的作用[7,17]。在氢气的众多生物学效应中,哪些是其直接作用靶点,哪些是其继发效应目前并不明确,仍需进一步研究。
综上所述,本研究显示免疫炎症反应参与了DAI急性期脑损伤的病理生理过程,星形胶质细胞的活化和炎症因子的大量释放导致脑损伤的加重。通过各种方法减轻DAI后免疫炎症反应程度是改善DAI预后的有效方法,而氢气由于具有减轻免疫炎症反应的作用,可能成为治疗DAI的有效药物。对于氢气抗免疫炎症反应的机制本研究并未涉及,其作用靶点的揭示有待于深入的研究。
[1] 刘晓斌,宋锦宁,陈景宇,等. 脑弥漫性轴索损伤实验装置的研制及动物模型的建立[J]. 西安交通大学学报:医学版, 2008, 29(5):595-598.
[2] 宋锦宁,刘守勋,戈治理,等. 脑弥漫性轴索损伤的特点及临床诊断[J]. 中国神经精神疾病杂志, 1997, 23(3):141-144.
[3] MUSTAFA AG, AL-SHBOUL OA. Pathophysiology of traumatic brain injury[J]. Neurosciences, 2013, 18(3):222-234.
[4] PRINS M, GRECO T, ALEXANDER D, et al. The pathophysiology of traumatic brain injury at a glance[J]. Dis Mod Mech, 2013, 6(6):1307-1315.
[5] LAIRD MD, VENDER JR, DHANDAPANI KM. Opposing roles for reactive astrocytes following traumatic brain injury[J]. Neurosignals, 2008, 16(2-3):154-164.[6] OHSAWA I, ISHIKAWA M, TAKAHASHI K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13(6):688-694.
[7] OHNO K, ITO M, ICHIHARA M, et al. Molecular hydrogen as an emerging therapeutic medical gas for neurodegenerative and other diseases[J]. Oxid Med Cell Longev, 2012:353152.
[8] OHTA S. Recent progress toward hydrogen medicine: Potential of molecular hydrogen for preventive and therapeutic applications[J]. Curr Pharm Design, 2011, 17(22):2241-2252.
[9] LI Y, SONG J, LIU X, et al. High expression of STIM1 in the early stages of diffuse axonal injury[J]. Brain Res, 2013, 1495(5):95-102.
[10] CHEN G, GO L, MAO B. Biomechanical mechanism of diffuse axonal injury[J]. J Biomed Eng, 2002, 19(3):500-504.
[11] 李上勋,刘丹,何光龙,等. 弥漫性轴索损伤的研究进展[J]. 中国法医学杂志, 2010, 25(5):338-341.
[12] SMITH DH, HICKS R, POVLISHOCK JT. Therapy development for diffuse axonal injury[J]. J Neurotraum, 2013, 30(5):307-323.
[13] 李宇,宋锦宁,闫文涛. DAI后神经元钙离子超载机制的研究现状及进展[J].中华神经医学杂志, 2012, 11(5):527-530.
[14] SINISCALCHI A, GALLELLI L, MALFERRARI G, et al. Cerebral stroke injury: the role of cytokines and brain inflammation[J]. J Basic Clin Physiol Pharmacol, 2014, 25(2):131-137.
[15] SU Y, FAN W, MA Z, et al. Taurine improves functional and histological outcomes and reduces inflammation in traumatic brain injury[J]. Neuroscience, 2014, 266(6):56-65.
[16] 马旭东,宋锦宁,赵永林,等. 氢气通过抗氧化应激减轻大鼠弥漫性轴索损伤[J]. 西安交通大学学报:医学版, 2014, 11(6):775-781.
[17] NAKAI Y, SATO B, USHIAMA S, et al. Hepatic oxidoreduction-related genes are upregulated by administration of hydrogen-saturated drinking water[J]. Biosci Biotechnol Biochem, 2011, 75(4):774-776.
(编辑 韩维栋)
Changes of immuno-inflammatory responses by intraperitoneal injection of hydrogen after diffuse axonal injury in rats
MA Xu-dong, SONG Jin-ning, ZHAO Yong-lin, ZHANG Bin-fei, LI Dan-dong, LIU Zun-wei, ZHAO Jun-jie, ZHAO Ya-hui
(Department of Neurosurgery, the First Affiliated Hospital, Medical School of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To explore the role of immuno-inflammatory reaction in diffuse axonal injury (DAI) and the therapeutic action of hydrogen in DAI model. Methods Totally 96 adult male SD rats were divided into 8 groups (n=12 in each): normal group, sham group, DAI groups (6 h, 1 d and 3 d) and DAI with hydrogen treatment groups(6 h, 1 d and 3 d). Rat DAI model was induced by an experimental facility developed to make the rat head spin 90 degrees at the moment to cause shearing injury. Hydrogen gas of high purity was injected intraperitoneally to DAI rat models twice per day (10 mL/kg). The histo-morphology, GFAP immunofluorescent staining, Western blotting (IL-6, IL-1, JNK and p-JNK) in parietal cortex were investigated at 6 h, 1 d and 3 d after DAI. Results DAI-related changes such as axon swelling and axonal ball were found in the conjunction area between DAI-affected parietal cortex and corpus callosum compared with those in sham group. The number of GFAP-positive cells as well as IL-6, IL-1, JNK and p-JNK expressions were significantly increased after DAI (P<0.05,P<0.01). Hydrogen treatment could reverse the changes mentioned above. Conclusion Immuno-inflammatory reaction is involved in DAI pathophysiological process in acute phase. The release of large numbers of inflammatory factors and activation of astrocytes may lead to the deterioration of brain damage. Hydrogen can improve acute brain injury of DAI by reducing immuno-inflammatory reaction.
diffuse axonal injury(DAI); immuno-inflammatory reaction; hydrogen gas; traumatic brain injury
2014-07-17
2014-10-15
国家自然科学基金资助项目(No.30471774);教育部新世纪优秀人才支持计划资助项目(No.NCET-05-0831);陕西省自然科学基金资助项目(No.2003C1-16) Supported by the National Natural Science Foundation of China (No.30471774), the New-Century Excellent Talents Program of Ministry of Education (No. NCET-05-0831), and the Natural Science Foundation of Shaanxi Province (No.2003C1-16)
宋锦宁. E-mail: jinnings@126.com
R651.1+5
A
10.7652/jdyxb201501004
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.1024.012.html(2014-11-19)
